磁性Fe3O4/石墨烯Photo-Fenton催化剂的制备及其催化活性
2012-11-09何光裕钱茂公陈海群
何光裕 张 艳 钱茂公 陈海群*, 汪 信
磁性Fe3O4/石墨烯Photo-Fenton催化剂的制备及其催化活性
何光裕1,2张 艳1钱茂公1陈海群*,1汪 信*,2
(1常州大学江苏省精细化工重点实验室,常州 213164)
(2南京理工大学教育部软化学与功能材料重点实验室,南京 210094)
采用共沉淀法制备磁性Fe3O4/GE(石墨烯)催化剂,实现Fe3O4纳米颗粒生长和氧化石墨烯还原同步进行,采用FTIR、XRD、TEM及低温氮吸附-脱附等对Fe3O4/GE纳米催化剂的物相、颗粒粒径及比表面积进行了表征。在H2O2存在条件下,以亚甲基蓝为目标降解物,考察了在模拟太阳光下Fe3O4/GE的催化活性,当氧化石墨烯与Fe3O4的质量比为1∶10时,经过2 h催化反应,在pH=6条件下,对亚甲基蓝的降解率达到98.7%,经过10次循环使用后对染料溶液的降解率仍保持在95.7%以上,明显优于纯的Fe3O4。
纳米Fe3O4/GE;磁分离;Photo-Fenton反应
近年来,利用太阳能光催化处理废水中难降解有机污染物,已引起国内外学者的普遍关注。Photo-Fenton反应过程无污染、反应速度快,已广泛应用于有机废水的降解。其中非均相Photo-Fenton反应体系不仅保留了均相反应处理范围广、反应速度快的优点,同时避免了因铁离子流失造成的二次污染,减少了处理成本[1-4]。然而在对催化剂进行分离、回收再利用时也存在催化剂流失量大、利用率低等局限性。如果在非均相Photo-Fenton催化反应中引入磁性介质,反应结束后通过简单的磁分离方式进行回收,不仅设备投入少、处理周期短,还能避免催化剂的流失,实现降解过程连续化操作,因此,制备具有高稳定性、高降解效率的可磁分离Photo-Fenton催化剂具有良好的应用前景。
四氧化三铁是一种重要的反式尖晶石铁氧体,自身无毒、成本低廉,是应用最为广泛的软磁性材料之一,以Fe3O4/H2O2体系降解有机污染物,所产生的羟基自由基(·OH)几乎能消除所有的有机污染物,具有较高的催化活性[5-7]和较宽的pH值应用范围[5-6]。但是由于纯的四氧化三铁具有大的磁偶极相互作用,在制备过程和降解废水过程中容易团聚,降低了Fe3O4的催化活性[7],且稳定性较差[8]。
最新发现的新型二维碳材料石墨烯,除了具有更大的比表面积、高化学稳定性、较好的吸附能力外,还具有更为优异的电子传输能力,在太阳能光电转化领域有广阔的应用前景,是一种理想的载体材料[9-12]。将磁性金属氧化物负载在石墨烯上,可以充分利用石墨烯良好的电输运性能、大的比表面积和强的吸附能力,从而提高Photo-Fenton反应的效率;同时解决纳米粒子容易团聚的问题。我们的前期研究表明,将磁性尖晶石半导体,如CoFe2O4、ZnFe2O4等[13-15],与石墨烯复合后,兼顾了磁性和光催化性能,具有较高的光催化性能。然而,将Fe3O4与石墨烯复合并作为非均相Photo-Fenton试剂在水处理方面的研究尚未见报道。
本工作以氧化石墨烯、氨水和水溶性二价铁盐及三价铁盐为原料,采用共沉淀法制得磁性四氧化三铁/石墨烯(Fe3O4/GE)催化剂,其中氧化石墨烯的还原、Fe3O4纳米颗粒的形成及其在石墨烯片层上的负载一步完成。采用XRD、FTIR、TEM及低温氮吸附-脱附等技术对样品进行了表征,并考察了H2O2-Fe3O4/GE体系在模拟太阳光照射条件下对亚甲基蓝的降解性能,实现了催化活性高、稳定性好、易分离且可直接循环使用的目标。
1 实验部分
1.1 化学试剂
亚甲基蓝(MB,国药集团化学试剂有限公司),石墨粉(分析纯,上海华谊集团),浓硫酸(H2SO4,分析纯,上海五四化学试剂厂),过硫酸钾(K2S2O8,分析纯,江苏强盛化工有限公司),过氧化氢(H2O2,分析纯,无锡新苑化工有限公司),五氧化二磷(P2O5,分析纯,江苏澄星磷化工股份有限公司),高锰酸钾(KMnO4,分析纯,国药集团化学试剂有限公司),六水合氯化铁 (FeCl3·6H2O,国药集团化学试剂有限公司),七水合硫酸亚铁(FeSO4·7H2O,国药集团化学试剂有限公司),氨水(NH3·H2O,分析纯,江苏永丰化学试剂厂),无水乙醇(分析纯,上海振兴化工一厂),去离子水(自制)。
1.2 氧化石墨烯溶液的制备
取10 mg(m0)以改进Hummers方法[16-17]制得的氧化石墨,加入到50 mL去离子水中,超声剥离30 min后,高速离心去除不溶物,得到的上层清液为氧化石墨烯溶液。烘干残留物,称重为m1,根据公式c=(m0-m1)/V,计算氧化石墨烯溶液的浓度。
1.3 磁性Fe3O4/GE催化剂的制备及表征
1.3.1 磁性Fe3O4/GE催化剂的制备
在装有搅拌装置、冷凝器和温度计的250 mL四口烧瓶中制备Fe3O4/GE催化剂。选取氧化石墨烯加入量与理论Fe3O4生成量的质量比为1∶5的实验实例: 将 1.7490 g 的 FeCl3·6H2O 与 2.696 3 g 的FeSO4·7H2O(nFeCl3·6H2O∶nFeSO4·7H2O=1 ∶1.5) 分 别 加 入30 mL的蒸馏水中超声30 min。室温(25℃)下以约10 mL·min-1的速度滴入经超声30 min后的100 mL氧化石墨烯水溶液(3 mg·mL-1)中,混合均匀后加热至60℃,然后快速滴加氨水将pH值调至9~10之间,恒温匀速搅拌2 h。反应结束后抽滤,并依次用水和无水乙醇反复洗涤滤饼至洗脱液为中性后,在60℃真空干燥6 h,研磨样品,将产品记为Fe3O4/GE(5),其余氧化石墨烯加入量与理论Fe3O4生成量比值 1∶1、1∶10 和 1∶15 的催化剂依次记为 Fe3O4/GE(1)、Fe3O4/GE(10)及 Fe3O4/GE(15)。
1.3.2 磁性Fe3O4/GE催化剂的表征
样品的物相表征采用D/max 2000 PC X射线衍射仪(XRD,日本理学Rigaku公司,Cu Kα射线,λ=0.154 18 nm,扫描范围 2θ为 5°~80°)测定;样品的红外光谱测定采用Nicolet370型傅里叶红外光谱仪(FTIR,美国Nicolet公司,KBr压片);样品的拉曼光谱测试采用Renishaw Invia拉曼光谱仪(英国雷尼绍公司,氩离子激光器,波长514 nm);样品粒径和形貌表征采用JEOL JEM2100型透射电子显微镜(TEM,日本电子公司);比表面积的确定采用ASAP2010C型表面孔径吸附仪 (美国Micromeritics仪器公司,77 K低温氮气吸附)。
1.4 磁性Fe3O4/GE催化剂的催化性能评价
光催化反应在南京胥江机电厂生产的XPA系列光化学反应仪中进行,光源为350 W氙灯(波长范围 200~1 100 nm,主波长 400~700 nm,紫外光<5%,未使用滤波片滤光)。取50 mL 20 mg·L-1亚甲基蓝溶液(pH=6)于100 mL四口烧瓶中,加入0.025 g的磁性Fe3O4/GE催化剂,在室温避光条件下匀速搅拌30 min,使染料与吸附剂间达到吸附-脱附平衡。然后移至光化学反应器中,加入0.5 mL的5 mol·L-1H2O2,鼓入空气(3.5 L·min-1),开启氙灯并开始计时,期间每隔一定时间取样进行磁力沉降,通过Shimadzu UV 1700 UV-Vis分光光度计检测其UVVis吸收光谱,根据样品最大波长664 nm处的吸光度来确定降解过程中亚甲基蓝浓度的变化。
2 结果与讨论
2.1 磁性Fe3O4/GE复合材料的结构
2.1.1 XRD 分析
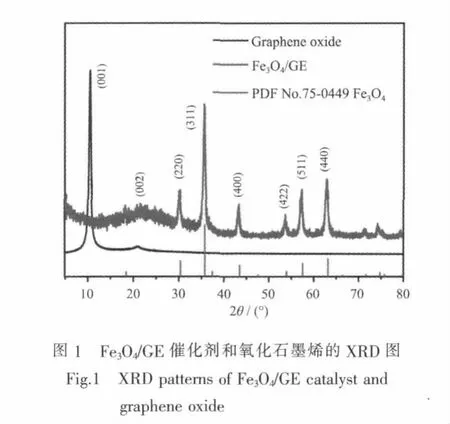
图1为Fe3O4/GE催化剂和氧化石墨烯的XRD图。Fe3O4/GE催化剂的XRD图中氧化石墨烯(001)的特征峰消失,而在21.6°处出现了石墨烯(002)晶面宽的衍射峰,说明在反应过程中加入的NH3·H2O在与铁离子反应的同时也将氧化石墨烯表面大部分含氧官能团还原,而且得到的石墨烯片层呈现不规则堆叠,晶体结构完整度下降。 其中 30.2°(220)、35.5°(311)、 43.2°(400)、53.6°(422)、57.1°(511)和 62.7°(440)处的衍射峰与标准卡片(PDF No.75-0449)中立方晶系的Fe3O4图相吻合。从图1还可以看出,制备的催化剂颗粒晶型较好,特征峰明显,衍射峰较宽不尖锐,说明产物的粒径比较细小。根据Fe3O4的(220)、(311)、(400)、(511)、(440)晶面衍射峰的半高宽,采用Scherrer公式计算催化剂样品中Fe3O4颗粒的平均粒径为 15.33 nm。
2.1.2 FTIR 分析
图2是Fe3O4/GE催化剂及氧化石墨烯的FTIR光谱。磁性Fe3O4/GE催化剂的FTIR谱图中所有含氧官能团(C=O、O-H、C-OH和C-O-C)的特征峰几乎全部消失,其中氧化石墨烯的C=O键的伸缩振动峰在1 716 cm-1处,而磁性Fe3O4/GE复合物中羧基的C=O键伸缩振动峰大大降低并蓝移至1 634 cm-1处,说明氧化石墨烯片层上的大部分含氧官能团在反应过程中被还原[18]。559 cm-1处的透射峰对应于Fe-O的伸缩振动,与Fe3O4标准波数580 cm-1谱图[19]对比,图中Fe3O4的特征吸收峰向低波数移动,这是因为COO-Fe原子的相互作用[20]削弱了纳米颗粒中Fe-O键的键能及Fe3O4粒子能量及半径变小的结果。

2.1.3 Raman 分析
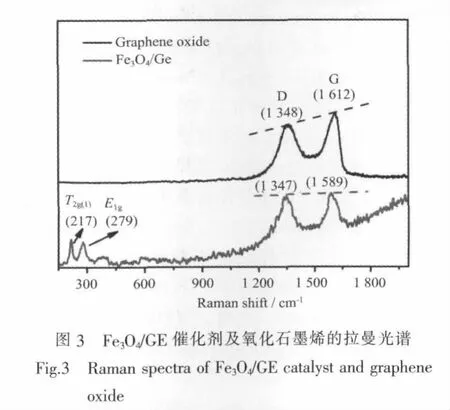
图3为氧化石墨烯及Fe3O4/GE的拉曼光谱。在Fe3O4/GE催化剂的拉曼光谱中,217、279 cm-1处出现的两个强度较大的峰为Fe3O4在激光辐照下产生赤铁矿的特征峰[21];在390和580 cm-1附近强度较小而宽的峰为Fe3O4的特征峰[22]。与氧化石墨烯的拉曼光谱相比,Fe3O4/GE拉曼光谱中氧化石墨烯的特征峰D和G峰依然存在,但是D峰从1 348移至1 347 cm-1,G 峰从 1 612 cm-1移至 1 589 cm-1,而且两者的强度有了明显的变化;将负载Fe3O4前后样品的D峰和G峰的强度(ID/G)进行对比,发现负载后ID/G值由0.86增强至0.96,表明氧化石墨烯被还原为石墨烯[13,23],与XRD和FTIR的表征结果一致。
2.1.4 TEM 分析
图4为Fe3O4/GE催化剂的TEM图,可清晰地观察到Fe3O4纳米颗粒均匀的附着在石墨烯表面,粒径分布均匀,约为15 nm,与前面计算得到的粒径大小基本一致。从图上可以清楚地看见片状透明的石墨烯,这说明石墨烯的层数较少;由于氧化还原后的石墨烯边缘羧基数量多于片层中间的羧基量,从而导致石墨烯边缘和褶皱上观察到的Fe3O4粒子比基面上多。右下角内插图为颗粒的HRTEM像,根据晶面间距d值可以确定该颗粒为立方晶系Fe3O4。
2.1.5 比表面积及孔径分布
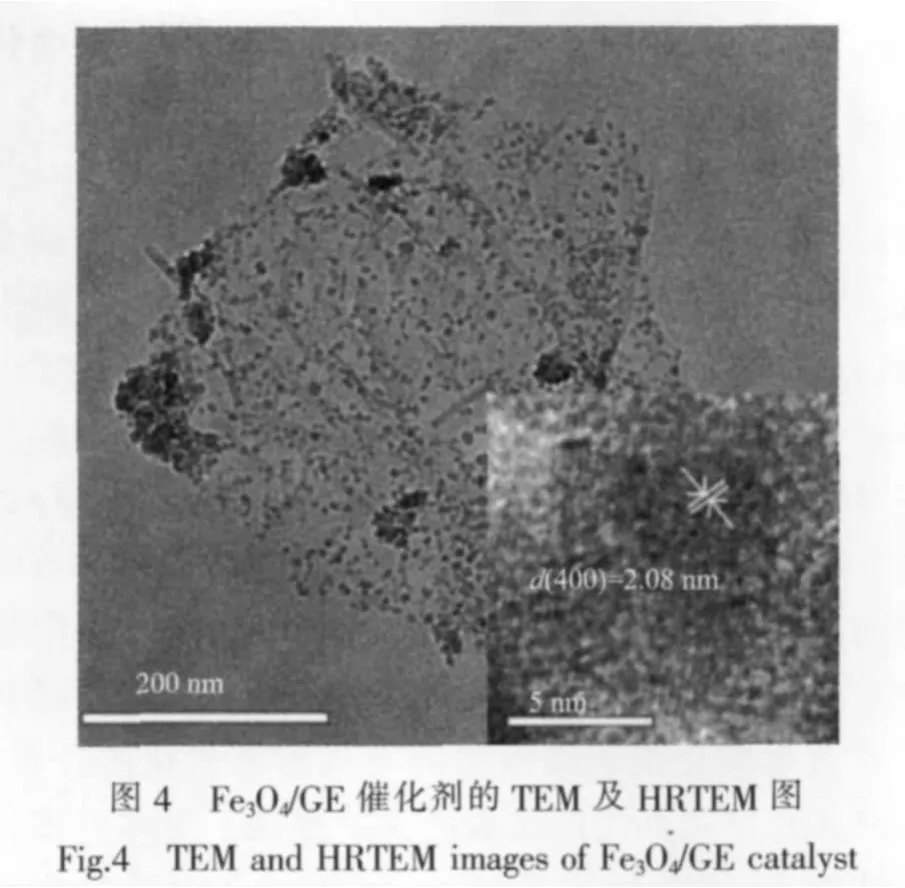
图5为不同样品的N2吸附-脱附等温线和孔径分布。采用BET法算得样品的比表面积见表1。由表1可见,Fe3O4/GE样品具有较大的比表面积(134 m2·g-1),为纯 Fe3O4的比表面积的 2 倍(74 m2·g-1)。从图 4可以看出,样品的氮气吸脱附等温线均属于Ⅳ型,滞后环明显存在。Fe3O4的滞后环出现在较高的相对压力(P/P0)范围 0.7~1内,而 Fe3O4/GE的滞后环出现在较低的相对压力(P/P0)范围0.4~1内。滞后环出现在较高的相对压力范围可能是由于在Fe3O4纳米颗粒间形成的空间引起的,滞后环出现在较低的相对压力范围说明在Fe3O4/GE催化剂中,石墨烯的加入有助于使负载的Fe3O4均匀分散从而获得更大的有效表面积,在一定程度上抑制了Fe3O4的团聚,进一步提高了催化剂的性能。
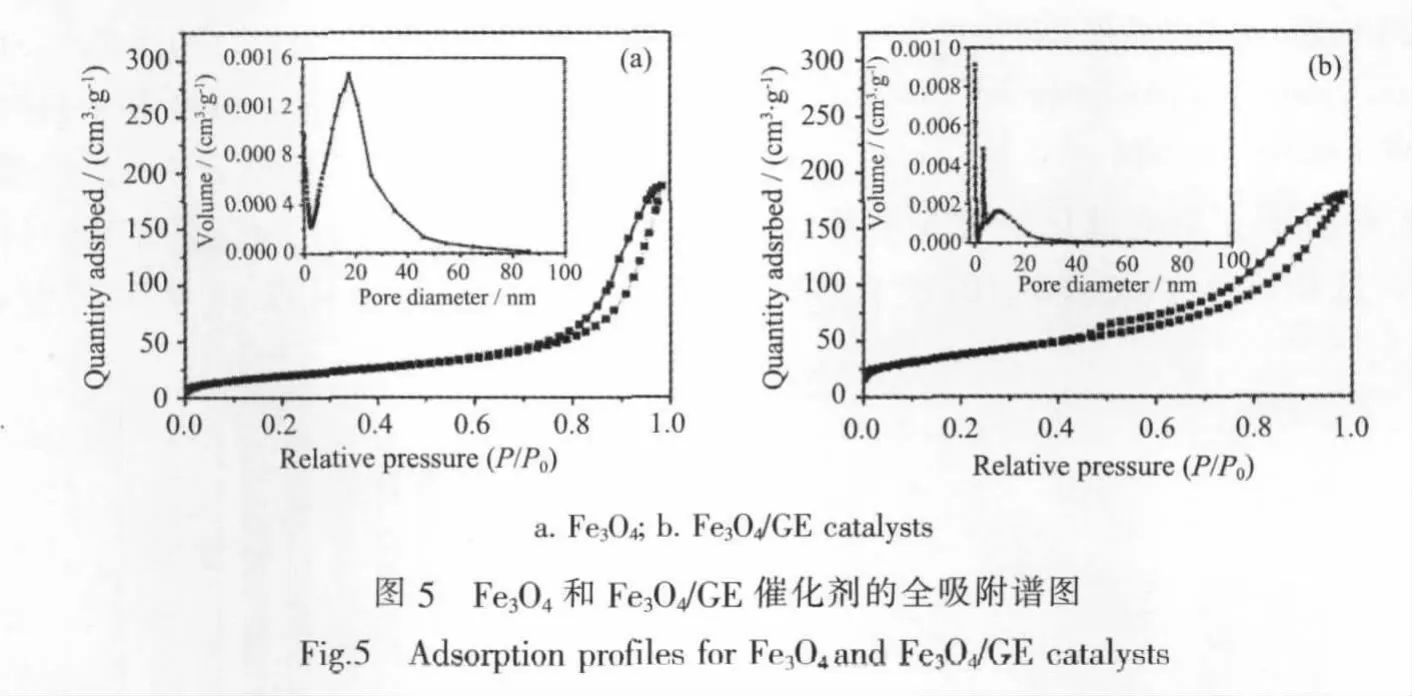

表1 Fe3O4和Fe3O4/GE催化剂的比表面及孔参数Table 1 BET surface area and pore parameters of Fe3O4and Fe3O4/GE catalyst
2.2 Fe3O4/GE和H2O2降解亚甲基蓝的协同效应的研究
图6的分界线前显示了亚甲基蓝分别在Fe3O4和Fe3O4/GE催化剂上达到吸附-脱附平衡后的剩余量,证实Fe3O4/GE对亚甲基蓝具有很好的吸附性能,这是因为Fe3O4/GE催化剂大的比表面提供了更多的吸附活性位点,同时亚甲基蓝与石墨烯片层间还具有静电引力和π-π堆积相互作用[25]。Taylor提出:一个固体只有当其对反应物分子具有化学吸附能力时才能催化某个反应[24]。也就是说化学吸附是发生催化作用的必要条件[15,24,26],而催化降解过程其实质就是催化剂表面吸附的有机物被氧化的过程,Fe3O4/GE催化剂大的比表面无疑提供了更多的催化活性中心,因此相对于Fe3O4而言,Fe3O4/GE催化剂对有机物的降解效果更好。
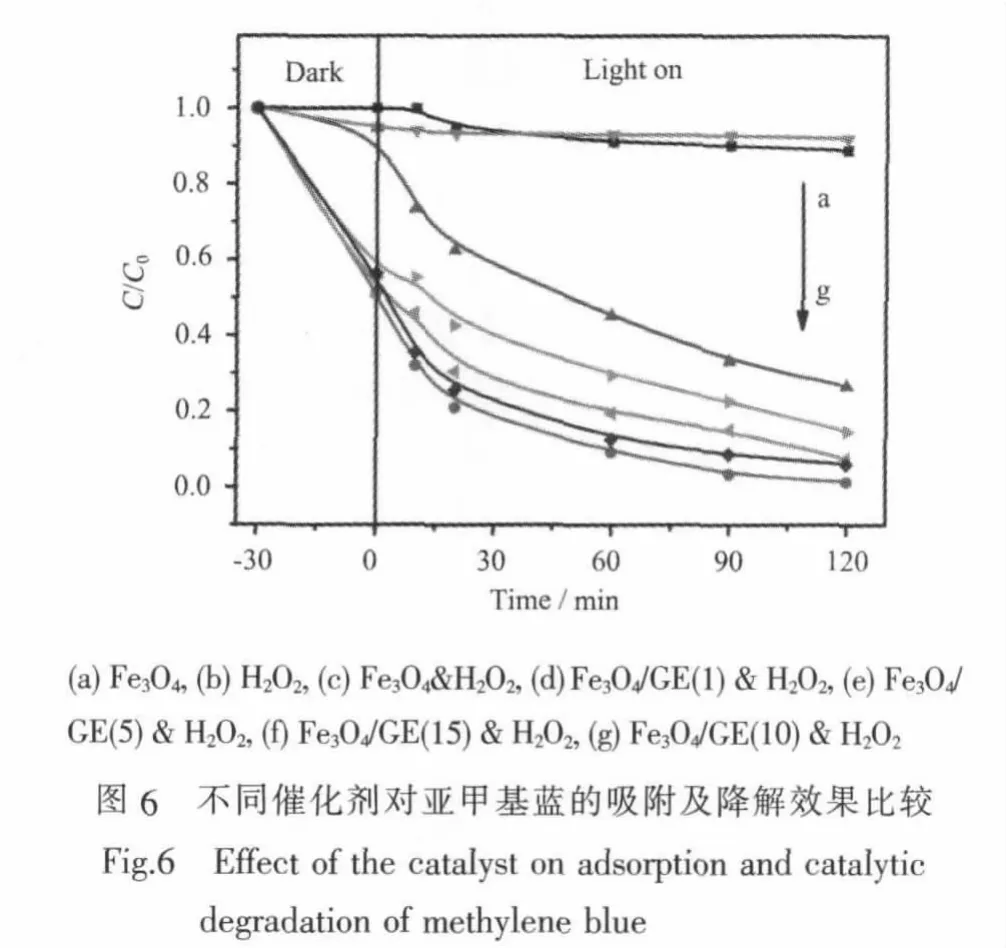
在模拟太阳光照射下,不同催化剂对亚甲基蓝的降解效果由高到低依次为Fe3O4/GE(10)&H2O2>Fe3O4/GE(15)&H2O2>Fe3O4/GE(5)&H2O2>Fe3O4/GE(1)&H2O2>Fe3O4&H2O2>H2O2>Fe3O4。 在光照 2 h后,H2O2、Fe3O4、Fe3O4&H2O2和 Fe3O4/GE(10)&H2O2对亚甲基蓝的降解率分别为8.0%、11.2%、73.4%和98.7%。显然,石墨烯的引入可显著提高催化剂的催化活性,其作用可归结为:石墨烯作为一种具有极高比表面积的载体,能使活性组分更加均匀地负载于其上,并避免了团聚等现象的产生,扩大反应的有效接触面积,提高了对H2O2的催化活性,同时也为染料的吸附和电荷的传输提供了一个有利的平台。它不仅起到了重要的吸附作用,而且提供了较高的电子迁移率,有效地抑制了电荷的复合,从而达到更高的催化效果。
2.3 Fe3O4/GE复合材料的磁分离及循环稳定性
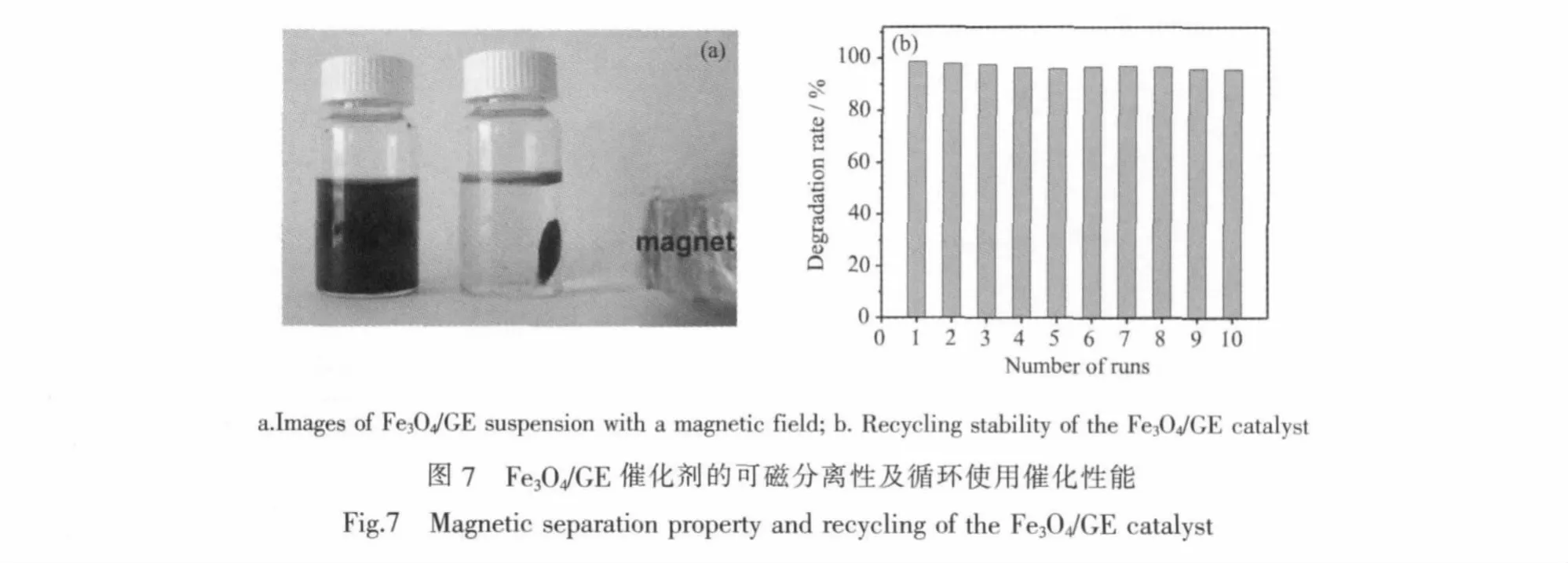
磁性的Fe3O4赋予了Fe3O4/GE催化剂很好的磁分离性能。从图7a可以看出,在外加磁场作用下,催化剂可快速与反应体系分离,在一定程度上避免了催化剂的流失。Fe3O4/GE催化降解亚甲基蓝的活性和循环使用稳定性如图7b所示。由图可见,在模拟太阳光照射下循环使用10次后,催化剂活性没有明显变化,亚甲基蓝的降解率仍可达到95.7%,表明该磁性催化剂可稳定有效地降解废水中的污染物。
2.4 Fe3O4/GE体系催化氧化染料的反应机理
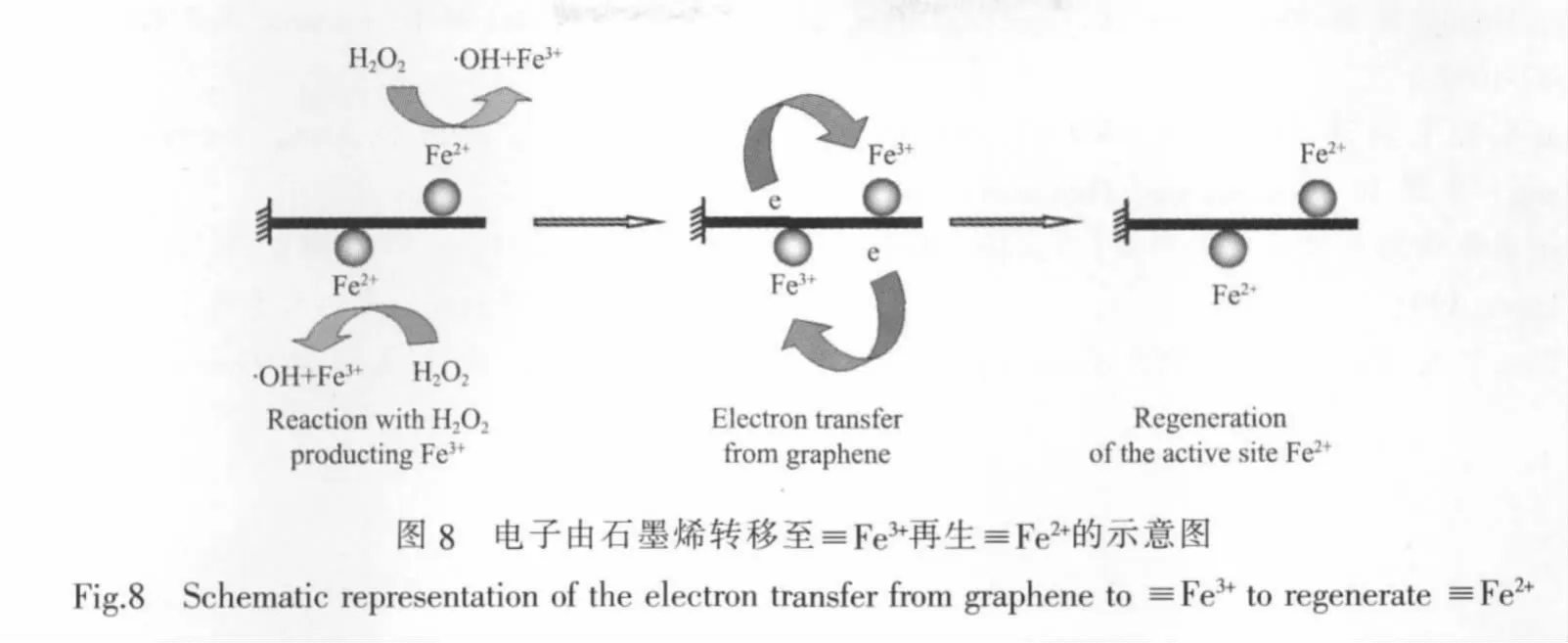
该催化剂反应的作用机制主要是通过催化H2O2分解产生自由基·OH来降解有机物;首先H2O2吸附在Fe3O4/GE颗粒表面形成≡Fe3+…H2O2和≡Fe2+…H2O2(“≡”代表氧化物表面结构)表面复合物前驱体,然后在≡Fe3+…H2O2和≡Fe2+…H2O2中发生电子转移可以产生≡Fe2+、·O2H和≡Fe3+[27]。同时,电子也可以从石墨烯转移至≡Fe3+,产生/再生反应的活性位点≡Fe2+(图7)。Wang等[6]通过使用ESR光谱证明了在Fe3O4和H2O2体系中产生具有极高的氧化能力的·O2H和·OH,一旦它们与染料分子接触,就可以使染料分子降解和矿化。同时,它们又可以与位于吸附剂表面的H2O2、Fe3+、Fe2+反应或互相反应使链反应终止或延长。另外,光源的激发可促使Fe3+与水中的OH-反应直接产生·OH和Fe2+,加速亚甲基蓝的降解速度和维持Fe2+/Fe3+的循环[28-29]。而且染料污染物本身对可见光有非常高的摩尔吸光系数,在可见光照射下,染料分子容易处于激发态,极易给出电子,加速Fe3+还原为Fe2+[29-30],而石墨烯优异的电子运输能力,无疑加速了电子转移的速率,使得电子与空穴有效分离,进一步提高了光催化效率。
3 结 论
本工作采用共沉淀法制备了磁性Fe3O4/GE催化剂,氧化石墨烯的还原、Fe3O4纳米颗粒的形成及其在石墨烯片层上的负载一步完成。Fe3O4在石墨烯表面分布均匀,平均粒径在15 nm左右,具有较高的比表面积(134 m2·g-1)。磁性Fe3O4/GE催化剂在模拟太阳光激发条件下可快速催化降解亚甲基蓝,在pH=6,光照2 h对亚甲基蓝的降解率即可以达到98.7%,循环使用10次后,降解率仍可达到95.7%,说明该催化剂具有较高的催化活性和稳定性,反应结束后在外加磁场作用下可快速与反应体系分离。
[1]GAO Jian(高 剑),WU Ling(吴棱),LING Shi-Jing(梁 诗 景),et al.Chinese J.Catal.(Cuihua Xuebao),2010,31(3):317-321
[2]Klamerth N,Malato S,Agüera A,et al.Environ.Sci.Technol.,2012,46(5):2885-2892
[3]Kasiri M,Aleboyeh H,Aleboyeh A.Appl.Catal.B,2008,84:9-15
[4]Banic N,Abramovic B,Krstic J,et al.Appl.Catal.B,2011,107:363-371
[5]Wang W,Li T L,Liu Y,et al.Adv.Mater.Res.,2011,233:487-490
[6]Wang N,Zhu L,Wang M,et al.Ultrason.Sonochem.,2010,17(3):78-83
[7]Jiang J,Zou J,Zhu L,et al.J.Nanosci.Nanotechno.,2011,11(6):4793-4799
[8]Zhu M,Diao G.J.Phys.Chem.C,2011,115(39):18923-18934
[9]Geim A K,Novoselov K S.Nat.Mater.,2007,6(3):183-191
[10]Novoselov K S,Geim A K,Morozov S V,et al.Science,2004,306(5696):666-669
[11]Yang X W,Zhu J W,Qiu L,et al.Adv.Mater.,2011,23,2833-2838
[12]Stoller M D,Park S,Ruoff R S,et al.Nano Lett.,2008,8(10):3498-3502
[13]Fu Y S,Chen H Q,Wang X,et al.Appl.Catal.B,2012,111-112:280-287
[14]Fu Y S,Xiong P,Chen H Q,et al.Ind.Eng.Chem.Res.,2012,51(2):725-731
[15]Fu Y S,Wang X.Ind.Eng.Chem.Res.,2011,50(16):7210-7218
[16]Kovtyukhova N I,Ollivier P J,Martin B R,et al.Chem.Mater.,1999,11(3):771-778
[17]Chen H Q,Müller M B,Gilmore K J,et al.Adv.Mater.,2008,20,3557-3561
[18]He G Y,Chen H Q,Wang X,et al.J.Mater.Chem.,2011,21:14631-14638
[19]Thomas T E,Lansdorp P M.Progr.Clin.Biol.Res.,1994,389:65-67
[20]Yang X Y,Zhang X Y,Chen Y S,et al.J.Mater.Chem.,2009,19:2710-2714
[21]Cao F Y,Chen C L,Chen Q W,et al.Carbon,2007,45(4):727-731
[22]Nasrazadani S,Raman A.Corros.Sci.,1993,34(8):1355-1365
[23]Wang Z Y,Huang B B,Dai Y,et al.CrystEngComm,2012,14:1687-1692
[24]Zhang H,Lü X,Li Y,et al.ACS Nano,2009,4(1):380-386
[25]PAN Lü-Rang(潘 履 让 ).Design and Preparation of the Solidcatalyst(固体催化剂的设计与制备).Tianjin:Nankai University Press,1993.
[26]Zhang Y,Tang Z R,Fu X,et al.ACS Nano,2010,4(10):7303-7314
[27]Lin S S,Gurol M D.Environ.Sci.Technol.,1998,32(10):1417-1423
[28]Kremer M L,Stein G.Trans.Faraday Soc.,1959,55:959-973
[29]DENG Qing-Heng(邓景衡).Thesis for the Doctorate of Zhongshan University(中山大学博士论文).2009.
[30]Cheng M,Ma W,Li J,et al.Environ.Sci.Technol.,2004,38:1569-1575
Preparation and Catalytic Properties of Fe3O4/Graphene Magnetically Separable Photo-Fenton Catalyst
HE Guang-Yu1,2ZHANG Yan1QIAN Mao-Gong1CHEN Hai-Qun*,1WANG Xin*,2
(1Key Laboratory of Fine Chemical Engineering,Changzhou University,Changzhou,Jiangsu 213164,China)
(2Key Laboratory for Soft Chemistry and Functional Materials of Ministry Education,Nanjing University of Science and Technology,Nanjing 210094,China)
A magnetically separable Fe3O4/Graphene(GE)catalyst was prepared by a facile co-precipitation method.The method features the reduction of graphene oxide and formation of Fe3O4nanoparticles in one step.Fe3O4/Graphene catalyst was characterized in terms of particle size,crystal structure and surface area by TEM,FTIR,XRD and low temperature nitrogen adsorption-desorption.In the presence of H2O2,the catalytic activities were evaluated by degradation of Methylene blue aqueous solution under simulated sunlight irradiation.The results indicate that catalyst with graphene oxide/Fe3O4mass ratio of 1:10 shows the highest degradation rate of 98.7%at pH value of 6 in 2 h.The catalyst can be easily separated by an external magnetic field.A degradation rate of 95.7%can be maintained after 10 cycles.
nano Fe3O4/GE;magnetically separable;photo-fenton reaction
O643.3;TQ426.6
A
1001-4861(2012)11-2306-07
2012-04-10。收修改稿日期:2012-05-22。
国家自然科学基金(No.51202020)、江苏省科技厅前瞻性计划(BY2012099)和常州市国际科技合作计划(CZ20110022)资助项目。
*通讯联系人。 E-mail:chenhq@cczu.edu.cn,wxin@public1.ptt.js.cn,Tel:(025)84315667
