“Turn-on”型磷光Hcy/Cys纳米探针的制备与性质研究
2012-11-09刘湘梅刘淑娟杨会然于海霞汪静霞
刘湘梅 刘淑娟 杨会然 于海霞 汪静霞 翟 钊 赵 强 黄 维
“Turn-on”型磷光Hcy/Cys纳米探针的制备与性质研究
刘湘梅 刘淑娟 杨会然 于海霞 汪静霞 翟 钊 赵 强*黄 维*
(南京邮电大学信息材料与纳米技术研究院,有机电子与信息显示国家重点实验室培育基地,南京 210046)
在本工作中,我们以制备纯水相检测的纳米探针为目标,以二氧化硅纳米粒子作为载体,以含特异性检测基团的长发光寿命的磷光铱配合物作为信号单元,通过共价键接枝方法得到几种纳米探针。采用SEM、TEM、SAXRD和氮气吸附等表征方法对纳米探针的表面形貌和内部结构进行表征,并用磷光发射光谱研究基于不同载体所得到的纳米探针的光物理性质以及对高半胱氨酸(Hcy)和半胱氨酸(Cys)的响应性,最后通过理论计算对其响应机理进行探讨。实验结果表明,以MCM-41作为载体的杂化纳米探针具有更强的发光强度和更好的响应性,并且在纯水体系中实现了对半胱氨酸和高半胱氨酸的高选择性检测。
磷光纳米探针;二氧化硅纳米粒子;磷光重金属配合物;生物传感
生命科学的迅速发展要求人们从单细胞和单分子水平上原位、活体、实时地了解物质之间的相互作用以及生命的过程。光学成像具有成像迅速、连续实时监测、无创性或微创性、可同时观察多分子事件、无放射性损伤、探针可重复导入以及不需要切片可进行原位活体成像等优点,是医学成像研究中应用最广泛的一种分子成像方法。
目前用于生物成像的光学探针主要包括荧光蛋白和生物发光蛋白类、有机染料[1-6]以及量子点类[7]。其中荧光蛋白和生物发光蛋白特异性识别很好,但是价格昂贵并且容易失去活性结合位点而限制了其进一步的临床应用;有机染料尤其是有机荧光染料的水溶性、光稳定性以及生物相容性方面还存在一些局限[8];量子点类探针其潜在毒性也令人担忧。磷光重金属配合物由于具有室温下高的三线态光量子效率、大的斯托克斯位移、较长的发射寿命、可见区激发、良好的光化学稳定性以及发射波长易调节等优点,近期在生物成像领域的应用备受关注[9-13]。
二氧化硅纳米粒子由于具有很好的生物相容性、表面易修饰、高比表面积以及制备简单可控等优点,常被用来作为发光材料载体制备光学探针,该设计策略能增强探针的亲水性能,可以避免为引入亲水基团而进行的繁琐的有机合成步骤[14-15]。另外,由于二氧化硅载体材料具有有效的 “透明”优点,它们在近红外区、可见光和紫外区均不发生光吸收,从而能保持杂化材料中发光染料的光物理性质,因而在光学成像探针领域引起广泛关注。目前已经有一些关于发光纳米粒子成像探针的报道,但是其中大部分工作都仅仅是用商业荧光材料作为信号单元,而基于长寿命磷光信号的杂化探针尤其是即具有发光功能又具有检测功能的二氧化硅杂化纳米探针报道较少[16-19]。
在本工作中,我们将磷光重金属铱配合物通过共价键引入到不同类型的二氧化硅纳米粒子中,得到有机无机杂化纳米探针,用于检测高半胱氨酸(Hcy)和半胱氨酸(Cys)。 通过 SEM、TEM、XRD 以及N2吸附表征纳米探针的形貌和结构,通过磷光光谱测试其对高半胱氨酸和半胱氨酸的响应性。
1 实验部分
1.1 纳米粒子载体的合成
实心纳米粒子按照经典的Stöber方法制备[20]。将100 mL乙醇和5 mL氨水混合,常温搅拌下滴加3 mL正硅酸乙酯(TEOS),继续搅拌12 h,离心分离洗涤备用。MCM-41的制备根据文献报道的制备方法,采用表面活性剂CTAB做模板剂(0.2 g),水(96 mL)作为反应介质,TEOS 作为硅源(1.2 mL),NaOH(0.7 mL,2 mol·L-1) 作为催化剂,通过水解缩合合成[21]。SBA-15的制备以三段共聚物P123为模板剂,TEOS为硅源,在酸性条件下合成介孔纳米粒子SBA-15,其原料物质的量比组成为:nP123∶nHCl∶nH2O∶nTEOS=0.017∶5.88∶197∶1[22]。
1.2 铱配合物杂化纳米探针的合成
铱配合物杂化纳米探针的合成分为4步,如图1所示。第一步,N^N配体的合成,反应产物用乙醇重结晶后,得黄色针状固体 (76%)。1H NMR(400 MHz,CDCl3)9.21(d,1H),8.95(d,1H),8.28(d,1H),7.99(d,1H),7.66(dd,1H),7.52(dd,1H),6.9(s,1H),4.3(s,2H)。第二步,铱配合物的合成,铱的二氯桥化合物根据文献方法合成[23]。称取铱二氯桥化合物0.15 mmol和 5-氨基-1,10-邻菲咯啉 0.375 mmol加入到反应瓶中,再加入15 mL CH2Cl2和甲醇的混合溶剂(2∶1,V/V),磁力搅拌回流 3~5 h 后,降至室温,加入5倍当量的六氟磷酸钾(KPF6),继续搅拌约1 h后,减压旋蒸除去溶剂,将所得固体混合物再溶于约10 mL的CH2Cl2中,将不溶物过滤除去,滤液减压旋蒸除去溶剂后得到固体,用柱层析方法(二氯甲烷/丙酮)过柱提纯,得到棕黄色固体,产率为63%,配合物通过1H NMR进行表征。1H NMR(400 MHz,DMSO-d6)9.78(d,2H),9.03(d,1H),8.40~8.43(dd,3H),8.18 ~8.21(dd,2H),8.15(d,1H),7.99 ~8.03(t,2H),7.93~7.96(dd,1H),7.72(d,1H),7.67~7.69(dd,1H),7.54~7.60(m,4H),7.15~7.20(m,2H),7.11(s,1H),6.97(s,2H),6.75(d,1H),6.72(d,1H)。 第三步,用异氰酸丙基三乙氧基硅烷对铱配合物功能化。取铱配合物(0.03 mmol)于圆底烧瓶中,抽真空充氮气,在氮气保护下用注射器注入经除水处理的四氢呋喃5 mL充分溶解后,再注入异氰酸丙基三乙氧基硅烷150 μL(2.5 mmol),70 ℃加热回流 24 h,然后加入冷正己烷沉降。通过离心分离,再迅速将下层沉淀溶解于3 mL无水四氢呋喃两次沉降/离心/溶解除去未反应的异氰酸丙基三乙氧基硅烷。第四步,将该产物溶解在无水四氢呋喃中,分别加入到含SBA-15、MCM-41以及实心纳米粒子的四氢呋喃悬浮液中,反应24 h,离心洗涤,干燥,得到有机无机杂化纳米粒子。通过硅酯键与二氧化硅表面的硅醇羟基水解缩合共价键连接,这样防止染料分子的泄露,提高稳定性。
1.3 实验仪器和表征方法
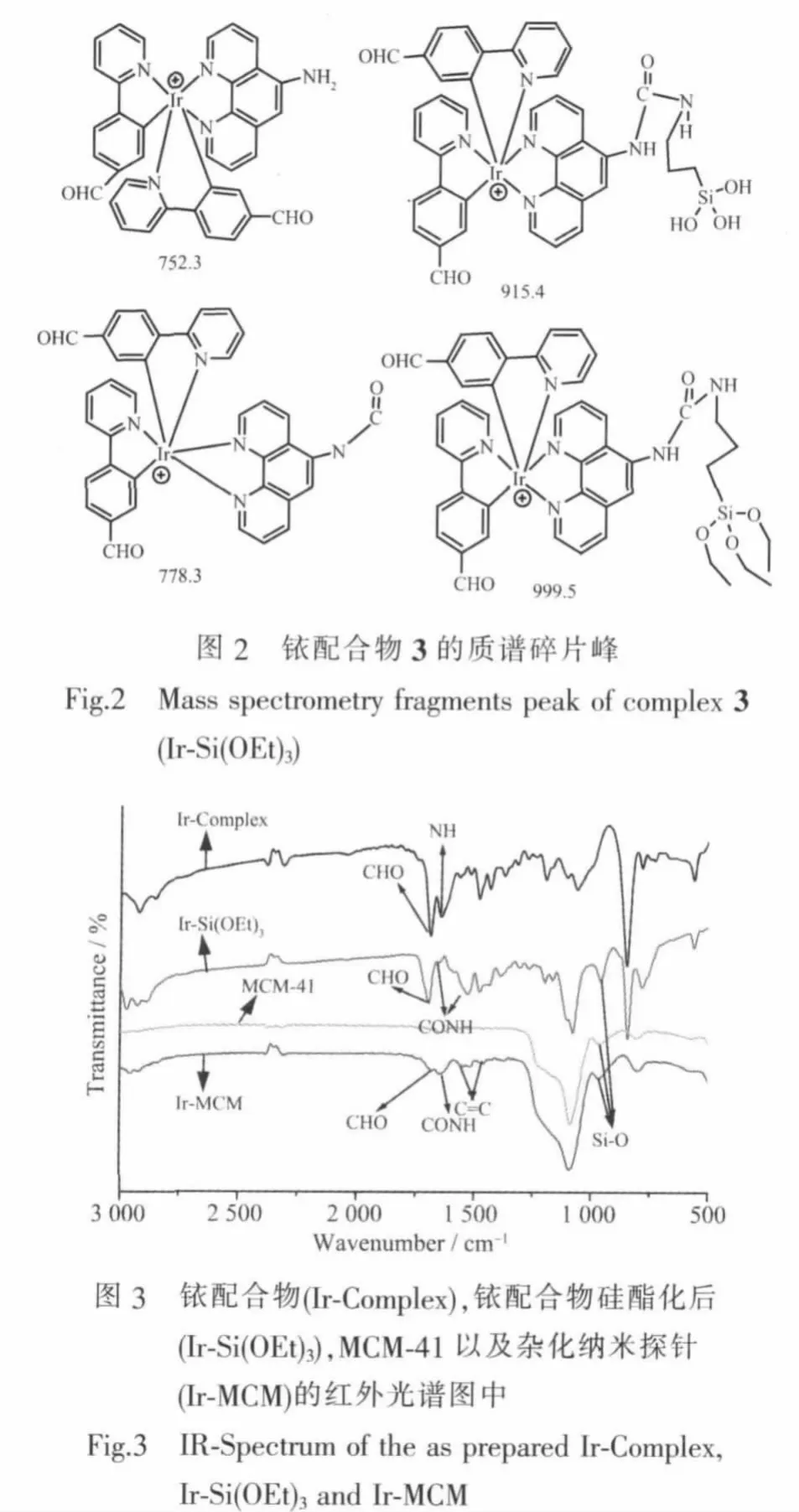
核磁共振谱用Bruker AdvanceⅢ (400 MHz)型核磁共振仪在室温下测定;质谱用Bruker autoflex基质辅助激光解吸离子化时间-飞行时间质谱仪(MALDI-TOF/TOF)测定;扫描电子显微镜(SEM)观察(日立S-4800场发射扫描电镜,10 kV操作电压);透射电子显微镜(TEM)观察(JEOL JEM-2100,加速电压为150 kV)。氮气吸附-脱附测量(3H-2000PS2表面积分析仪,北京贝士德仪器公司)。通过吸附在p/p0=0.04~0.20 收集 6 个点数据计算 BET(Brunauer-Emmett-Teller)比表面积。孔径分布采用BJH(Barrett-Joyner-Halenda)方法估计。粉末小角X射线衍射(XRD)在Bruker Advance-D8衍射仪上进行测定,Cu靶,Kα辐射源。磷光发射光谱在 Shimadzu RF-5301PC光谱仪上测定;热重分析在SDT2960型热重-差热仪上测定;红外光谱由Shimadzu IR Prestige-21傅里叶红外光谱仪测定。
1.4 理论计算
所有计算都应用量子化学通用的计算程序Gaussian03完成[24]。采用B3LYP(Becke型3参数密度泛函模型,此模型采用Lee-Yang-Parr泛函)密度泛函理论(DFT)对配合物的结构进行优化来计算配合物以及与半胱氨酸反应后的产物的单线态和最低的三线态(T1)能级。采用LANL2DZ基组处理铱原子的核心电子,而6-31G*基组被用来处理配合物中所有其它原子。在优化三线态结构基础上采用时间密度泛函理论(TD-DFT)来计算配合物的激发态。计算结果给出了HOMO、LUMO以及LUMO+1等的轨道分布。
1.5 半胱氨酸和高半胱氨酸检测实验
对Hcy和Cys的检测我们是在PBS缓冲液(pH值7.4)中通过光度法测定。通常情况下,测试前先将不同浓度的氨基酸和杂化纳米粒子悬浮液在37℃反应15 min后测试其发射强度,其中纳米粒子的浓度为1 mg·mL-1。激发波长为365 nm,狭缝宽度为5 nm。
2 结果与讨论
2.1 配体以及配合物表征
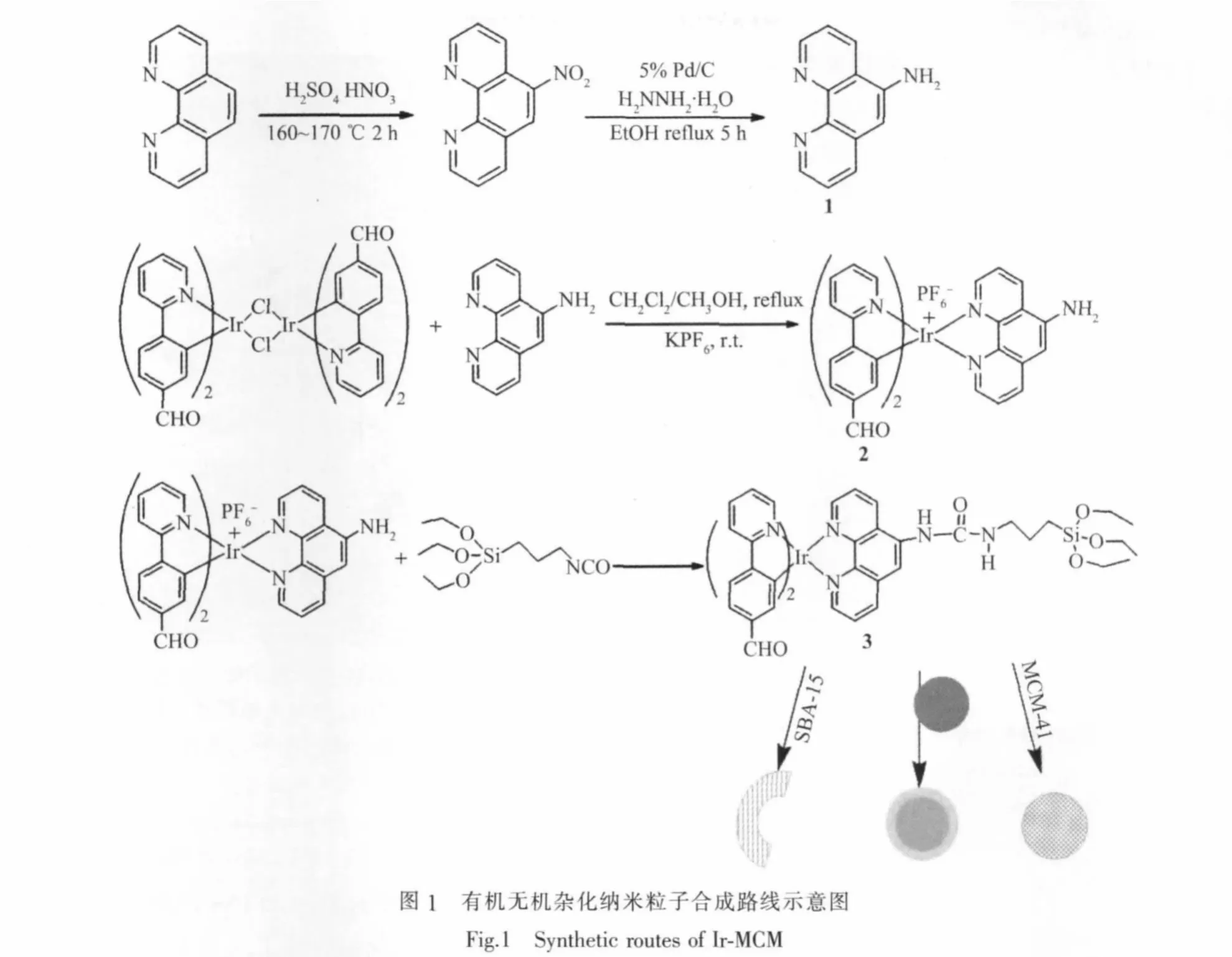
图1所示N^N配体1和铱配合物2通过1H NMR和MALDI-TOF-MS进行表征。功能化配合物3的质谱碎片峰如图2所示,实验结果证明,铱配合物N^N配体上的NH2与-CNO反应。从不同阶段的红外光谱(如图3)我们可以看出,铱配合物与异氰酸丙基三乙氧基硅烷反应后,Ir-Si(OEt)3红外光谱在1 600 cm-1的吸收证明酰胺键(CONH)的生成。与纳米粒子接枝后,Ir-MCM红外光谱出现了铱配合物在1 500~1 700 cm-1的吸收峰和MCM-41的特征峰,证明在杂化探针中铱配合物的存在。通过TGA测试得到杂化纳米粒子(Ir-MCM)中配合物的含量约为47%。
2.2 二氧化硅纳米粒子的形貌表征
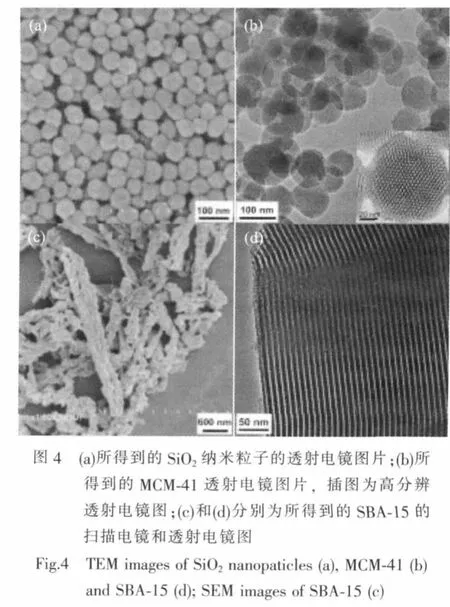
图4a是所得到的实心纳米粒子透射电镜图。从图中我们可以看出,纳米粒子的平均直径约为80 nm。图4b是所得到的MCM-41的透射电镜图。从图中我们可以看出,所制备的MCM-41纳米粒子粒径约为80~100 nm,从高倍透射电镜图(图4b插图)我们可以看出内部孔道成规则六方紧密堆积。图4c和图4d分别是所得到的SBA-15的扫描电镜和透射电镜图,SBA-15长径比比较大,并且内部孔道直径相对MCM-41更大。
2.3 杂化纳米粒子对Hcy和Cys的响应性
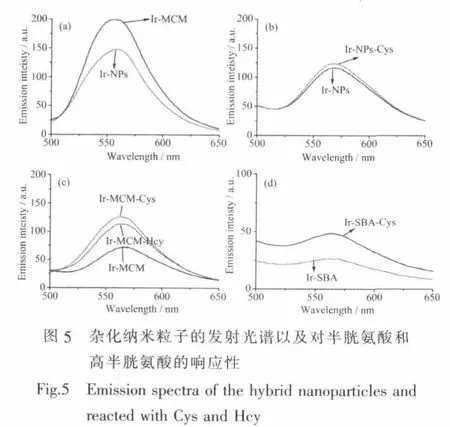
在本工作中,我们研究了几种不同结构的杂化纳米粒子的光物理性质以及对Hcy和Cys的响应性。我们分别采用SiO2实心纳米粒子、MCM-41以及SBA-15作为载体,制备杂化纳米粒子,分别标为Ir-NPs、Ir-MCM以及Ir-SBA,并研究其杂化纳米粒子的光物理性能。从图5a我们可以看出,杂化纳米粒子的发射波长在565 nm附近,在相同的质量浓度下,Ir-MCM的发光强度明显比Ir-NPs强,这可能是因为MCM-41的比表面积比较大,所负载的铱配合物分子比较多,并且我们测试了杂化纳米粒子(Ir-MCM)的磷光寿命为321.42 ns。当加入半胱氨酸后,从图5b、5c和5d我们可以看出,Ir-NPs由于比表面积相对较低,响应性也比较低;而Ir-SBA由于SBA-15粒径比较大,光散射比较强(图5d),也不适合作为本体系的探针载体。因此,通过本实验我们筛选出对半胱氨酸的响应性最大的Ir-MCM杂化粒子作为探针做系统研究。
2.4 Ir-MCM杂化纳米探针的结构表征
以MCM-41作为载体的杂化纳米粒子的表面结构以及内部孔道结构通过SEM、TEM、XRD和氮气吸附-脱附等温线进行表征。图6是所制备的负载前(MCM)(图6a和图6c)和负载铱配合物后的(Ir-MCM)纳米粒子(图6b和6d)的透射电镜和扫描电镜图片。
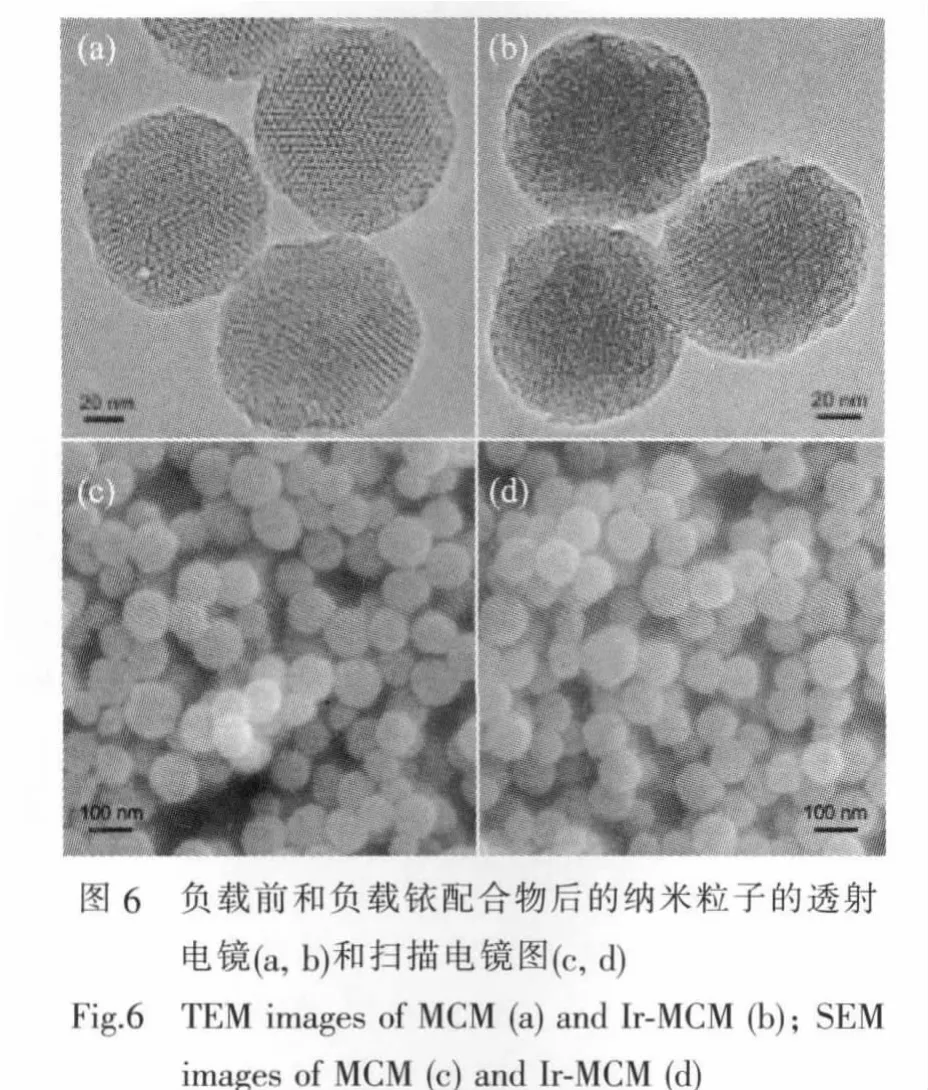
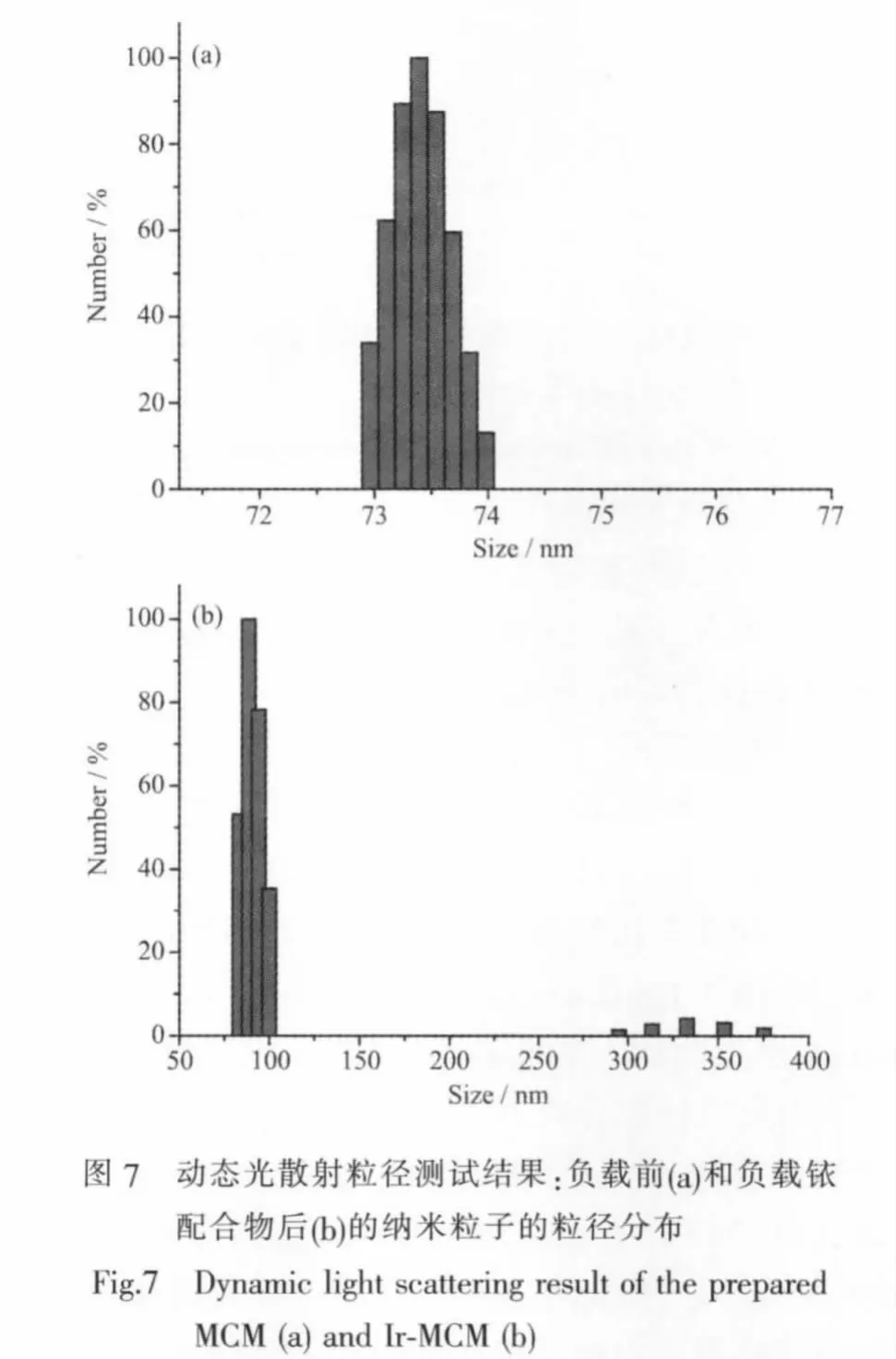
对比图6a和图6b我们可以看出,负载前的MCM-41粒径约为80 nm,并且比较分散,内部孔道呈二维六方紧密排列,孔道与孔壁具有很明显的对比度,证明所得到的MCM内部孔道清晰可见并且长程有序。当负载铱配合物后,杂化纳米粒子(Ir-MCM)没有明显聚集,粒子界面没有负载前清晰,而且内部孔道也没有负载前(图6a)清晰,这证明探针分子已经被接枝到介孔纳米粒子的内孔壁和外部表面上。动态光散射粒径分析结果表明,负载前(如图7a)的纳米粒子单分散性比较好,粒径约74 nm,粒径分布很窄。负载铱配合物后(如图7b),杂化纳米粒子粒径90 nm,粒径分布相对较宽,尤其是在350 nm附近的粒子可能是由于有机配合物负载过程中造成少部分纳米粒子团聚造成。
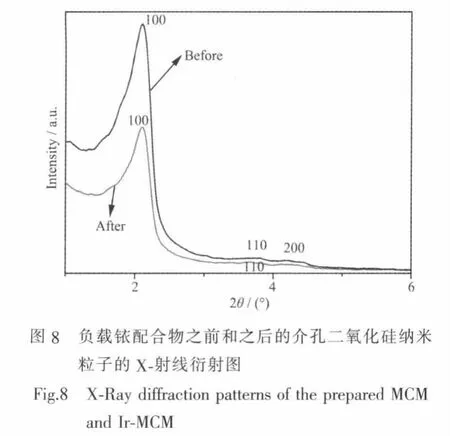
X-射线衍射是利用衍射图中的衍射峰位置和强度来测定晶格常数和晶型,利用衍射峰的角度及峰形测定晶粒的直径和结晶度。介孔材料在XRD谱图上,只有2θ在2°~10°的低角度区有明显的衍射峰,其强度可作为判断介孔材料有序度的基本手段之一。图8是所得到的MCM和Ir-MCM的XRD结果。从图中可以看出,在MCM样品中观察到(100)面的强峰和(110,200)2个弱峰,这可以说明该介孔纳米粒子具有二维六方紧密堆积的内部结构,并且孔道长程有序规则。负载铱配合物后,Ir-MCM样品的(100)面的峰值强度下降,而(110,200)面的峰变得不再明显,这表明负载铱配合物后,杂化纳米粒子的内部介孔结构还是存在,但是有序度有些降低,而且因为介孔的孔壁接枝铱配合物后,可能也导致衍射衬度降低,从而峰强度降低。
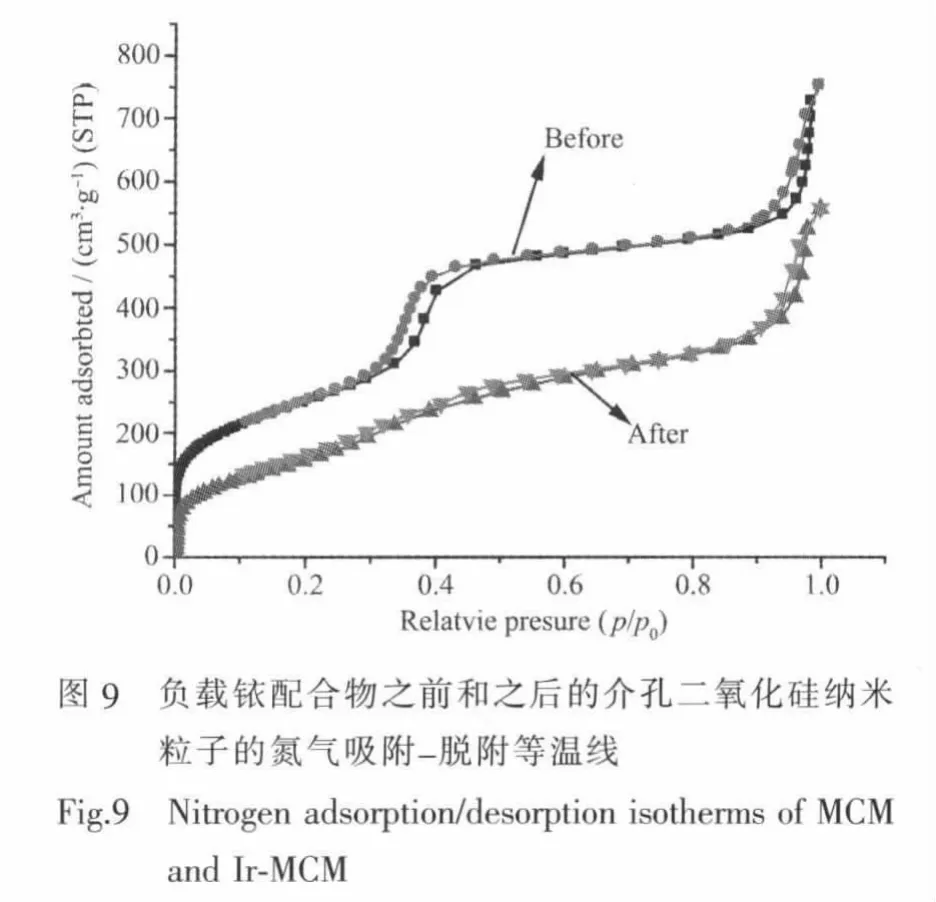
氮气吸附-脱附等温线也是表征介孔材料结构特征的重要手段。如图9所示,所制备的负载前MCM和负载后的Ir-MCM纳米粒子的氮气吸附-脱附等温线的形状,按照IUPAC的划分属于典型Ⅳ的等温线[25]。本工作中的负载前的样品所得到的滞后环属于 H1 型,相对压力 p/p0=0.28~0.4,反映了该材料的内部孔道比较规则,孔径具有相对窄的孔径分布,用 BET(Brunauer-Emmett-Teller)法计算后得到MCM 比表面积为 898.43 m2·g-1, 孔容为 1.20 cm3·g-1。当负载铱配合物后,Ir-MCM的等温线具有较低的氮气吸附量,而且滞后环不清晰,根据等温线数据计算后得到Ir-MCM的比表面积和孔容分别为600.35 m2·g-1和 0.87 cm3·g-1, 这些结果表明,MCM的内部孔道表面被成功接枝了铱配合物。
MCM和Ir-MCM的孔径分布根据样品的吸附-脱附等温线采用BJH方法进行计算。MCM和Ir-MCM的孔径分布如图10所示,MCM的平均孔径为2.90 nm,而且该材料的孔径分布很窄。当接枝铱配合物后,Ir-MCM的BJH孔径下降至2.53 nm,而且孔径分布相对较宽,小孔径孔道所占比例相对较多,这可能是由于铱配合物的负载,MCM内部孔隙部分被配合物占据,而在相对较大孔径区域的孔可能是由于铱配合物在MCM表面部分团聚形成的堆积空隙造成。总的来说,负载后的纳米粒子的比表面积、孔容和孔径都降低,并且孔径分布较宽的出现,这也进一步证实了探针分子铱配合物在MCM内孔壁和外表面的接枝。

2.5 光物理性质
纳米探针在水中具有很好的分散性是其在实际生物检测中实现应用的先决条件。本工作中所合成的MCM纳米粒子和杂化纳米探针Ir-MCM在水中均有很好的稳定性。我们将纳米探针Ir-MCM分散在PBS缓冲溶液中,悬浮液呈现橙红色,用365 nm激发波长激发,悬浮液的发射波长在565 nm(如图11),该峰比较宽,说明该纳米粒子的发射峰能量来自CT态跃迁。当加入不同浓度的半胱氨酸或者高半胱氨酸后(n氨基酸/n配合物=0~200 eq.),悬浮液的发射波长位置没有发生明显移动,但是发射峰明显增强(如图 11)。
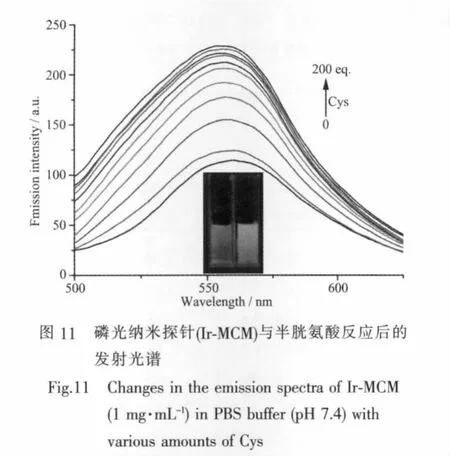
而在同样的探针浓度下,加入其它氨基酸如L-组氨酸、L-亮氨酸、L-苏氨酸、L-精氨酸、L-天门冬氨酸、L-酪氨酸、L-色氨酸、L-脯氨酸、L-异亮氨酸、L-缬氨酸、L-蛋氨酸、L-赖氨酸、L-谷氨酰胺、L-丙氨酸、L-谷氨酸、L-甘氨酸、L-羟脯氨酸、L-丝氨酸和 L-苯丙氨酸,没有观察到明显变化。当用紫外灯(365 nm)照射时,加入半胱氨酸的样品用肉眼可以观察到亮度明显增加(图11插图),加入高半胱氨酸也有同样的现象。
根据文献报道[1,15-16,26-27]和以上的实验现象,我们提出一种可能的响应机理(图12)。铱(Ⅱ)配合物中环金属配体带的醛基能与β-和γ-烷基巯基类氨基酸如Hcy和Cys形成相应的五元杂环((thiazolidine)或六元杂环(thiazinane)。为进一步了解反应机制,我们用TDDFT计算方法计算出醛基对配合物的光物理性质影响。我们选取带硅酯基的配合物(Ir-Complex)以及配合物与半胱氨酸反应后的产物(Ir-Cys)在水相中的基于最低三线态(T1)结构来计算分子前线轨道分布,根据轨道分布来验证所提出的反应机理。
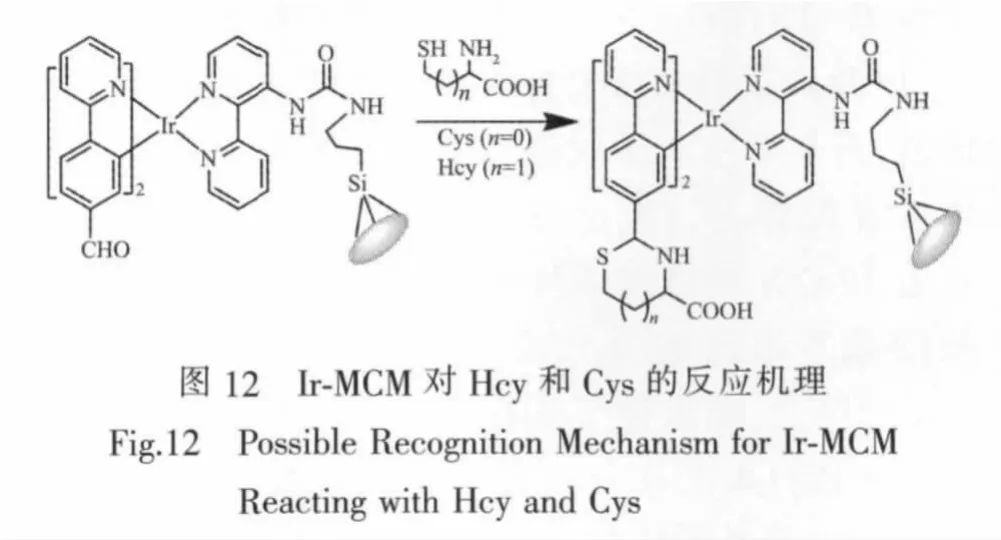
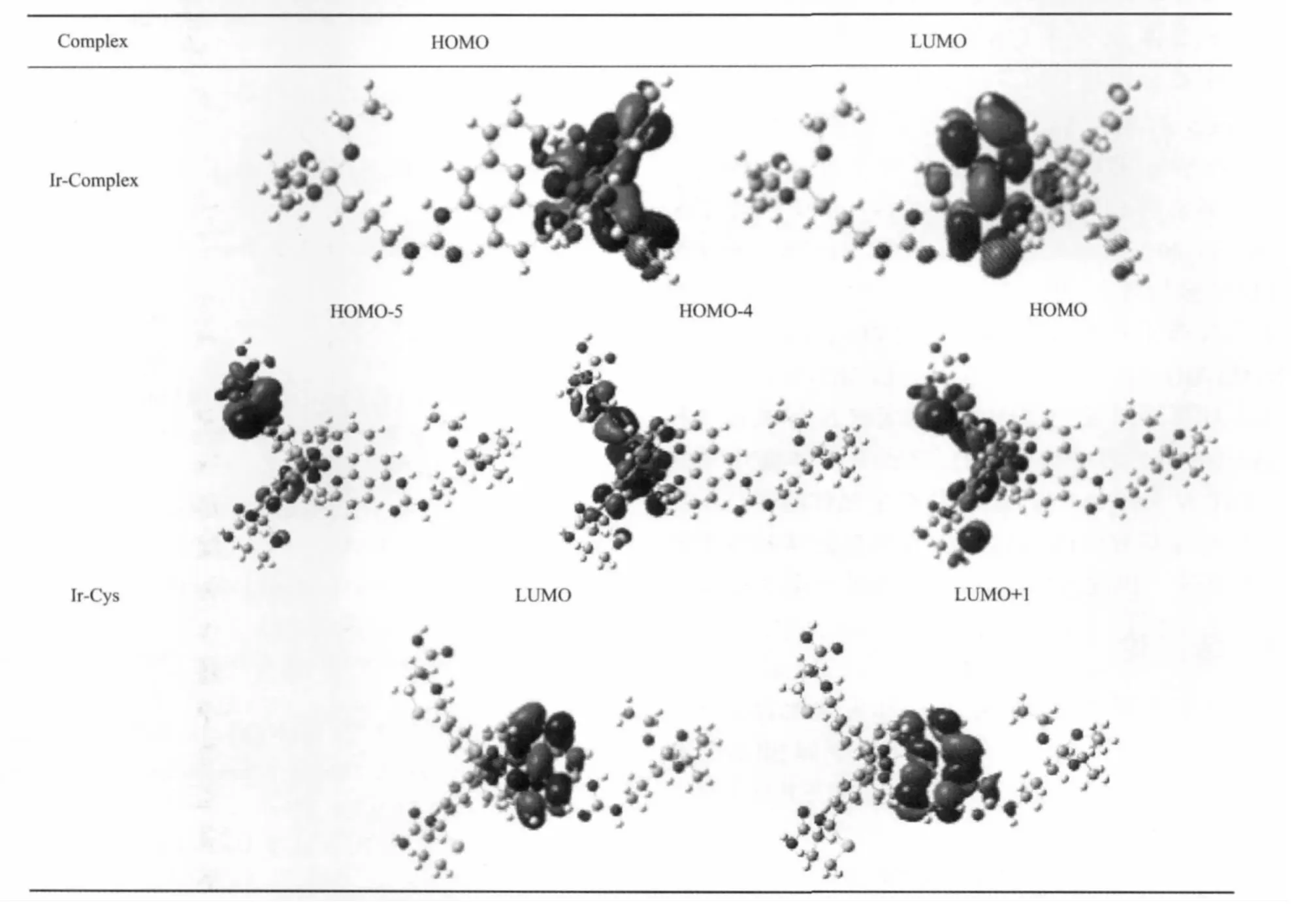
表1 配合物Ir-Complex和配合物Ir-Cys的前线轨道分布Table 1 HOMO,LUMO and LUMO+1 distributions of Ir-Complex and Ir-Cys at the triplet states

表2 理论计算得到的配合物Ir-Complex和配合物Ir-Cys在水溶液中最低三线态能级Table 2 Calculated phosphorescence emissions of Ir-Complex and Ir-Cys in aqueous solution with TDDFT method
如表1所示,配合物Ir-Complex的最高占据分子轨道 (HOMO)主要分布在2个C^N配体的苯环上,以及少量分布在C^N配体的吡啶环和金属中心Ir上;而最低空分子轨道(LUMO)主要分布在辅助配体N^N配体上。配合物Ir-Cys的HOMO主要分布在Ir和C^N配体的苯环和C^N配体醛基与半胱氨酸的巯基形成的五元杂环上;LUMO主要分布在N^N配体上,少量分布在Ir金属中心上。
HOMO-4主要分布在一个C^N配体醛基与半胱氨酸的巯基形成的五元杂环上,少量分布在另一个C^N配体的苯环上和Ir金属中心上;LUMO+1主要分布在辅助配体N^N上;HOMO-5分布在其中一个C^N配体,另一个C^N配体的苯环和吡啶以及铱金属中心分布相对较少。如表2所示,配合物Ir-Complex的最低能量三线态主要来自HOMO→LUMO(59%)的跃迁,根据轨道分布进一步证明了三线态金属-C^N配体的电荷转移 (dπ(Ir)→π*C^N]3MLCT)和三线态配体内电荷转移 ([πC^N→π*N^N]3LLCT)参与其中。相比之下,配合物Ir-Cys的最低能量三线态主要来自HOMO→LUMO(37%)、HOMO-5→LUMO+1(31%)和 HOMO-4→LUMO+1(43%)的跃迁。计算结果进一步证实金属-C^N配体电荷转移([dπ(Ir)→π* 的 C^N]3MLCT),三线态配体间电荷转移([πC^N→π*N^O]3LLCT)以及C^N配体醛基与半胱氨酸的巯基形成的五元杂环也参与配体间的电荷转移跃迁。因此,这是造成探针光谱变化的原因。
3 结 论
我们选择具有很好亲水性和生物相容性的二氧化硅实心纳米粒子、介孔纳米粒子如SBA-15和MCM-41作为铱配合物载体,设计合成了对半胱氨酸和高半胱氨酸具有高选择性的磷光纳米探针。实验结果表明,由于MCM-41相比其它几种载体兼备高比表面积和尺寸适中的粒径优势,从而使得到的杂化纳米探针具有更强的发光强度和更好的响应性。基于MCM-41的杂化探针实现了在纯水体系中检测半胱氨酸,减少了复杂的有机合成步骤,提高了磷光配合物的利用率,降低了成本。该设计策略为以后在实际应用如细胞成像和生物传感领域开发优异的磷光细胞探针能提供有效途径。
[1]Zhang M,Li M,Zhao Q,et al.Tetrahedron Lett.,2007,48(13):2329-2333
[2]Zhang D,Zhang M,Liu Z,et al.Tetrahedron Lett.,2006,47(39):7093-7096
[3]Zhao Q,Huang C,Li F.Chem.Soc.Rev.,2011,40(5):2508-2524
[4]Zhao Q,Li F,Huang C,Chem.Soc.Rev.,2010,39(8):3007-3030
[5]Mou X,Wu Y,Liu S,et al.J.Mater.Chem.,2011,21(36):13951-13962
[6]Xu W,Liu S,Sun H,et al.J.Mater.Chem.,2011,21(21):7572-7581
[7]Burns A,Ow H,Wiesner U,Chem.Soc.Rev.,2006,35(11):1028-1042
[8]Quang D T,Kim J S,Chem.Rev.,2010,110(10):6280-6301
[9]Shiu H Y,Wong M K,Che C M.Chem.Commun.,2011,47(15):4367-4369
[10]Shiu H Y,Chong H C,Leung Y C,et al.Chem-Eur.J.,2010,16(11):3308-3313
[11]Chen H,Zhao Q,Wu Y,et al.Inorg.Chem.,2007,46(26):11075-11081
[12]Xiong L,Zhao Q,Chen H,et al.Inorg.Chem.,2010,49(14):6402-6408
[13]LI Xiang-Hong(李襄宏),ZHAO Xin-Di(赵鑫帝),LÜ Kang-Le(吕康乐),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(2):303-307
[14]Ma Y,Liu S,Yang H,et al.J.Mater.Chem.,2011,21(47):18974-18982
[15]YIN Dong-Guang(尹东光),ZHANG Li(张礼),LIU Bin-Hu(刘斌虎),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(3):419-425
[16]Liu X,Xi N,Liu S,et al.J.Mater.Chem.,2012,22(16):7894-7901
[17]Bagwe R P,Yang C,Hilliard L R,et al.Langmuir.,2004,20(19):8336-8342
[18]Zhang D,Wu Z,Xu J,et al.Langmuir.,2010,26(9):6657-6662
[19]Lai C W,Wang Y H,Lai C H,et al.Small,2008,4(2):218-224
[20]Stöber W,Fink A,Bohn E.J.Colloid Interf.Sci.,1968,26(1):62-69
[21]Cai Q,Luo Z S,Pang W Q,et al.Chem.Mater.,2001,13(2):258-263
[22]Zhao D,Sun J,Li Q,et al.Chem.Mater.,2000,12(2):275-279
[23]Lamansky S,Djurovich P,Murphy D,et al.J.Am.Chem.Soc.,2001,123(18):4304-4312
[24]Trucks G,Schlegel H,Scuseria G,et al.Gaussian03,revision C.02;Gaussian,Inc.:Wallingford,CT:2004.
[25]Sing K,Everett D,Haul R,et al.Pure Appl.Chem.,1985,57(4):603-19
[26]Rusin O,Luce N N S,Agbaria R A,et al.J.Am.Chem.Soc.,2004,126(2):438-439
[27]Wang W,Rusin O,Xu X,et al.J.Am.Chem.Soc.,2005,127(45):15949-15958
“Turn-on” Phosphorescent Nanoprobes for Sensing Homocysteine and Cysteine
LIU Xiang-MeiLIU Shu-Juan YANG Hui-Ran YU Hai-Xia WANG Jing-XiaZHAI ZhaoZHAO Qiang*HUANG Wei*
(Key Laboratory for Organic Electronics&Information Displays(KLOEID);Institute of Advanced Materials,Nanjing University of Posts&Telecommunications,Nanjing 210046,China)
In this work,we designed and fabricated a series of new nanoprobes by using the high specific surface area and good biocompatibility of mesoporous silica nanoparticles as a probe carrier and the long lifetime luminescence of phosphorescent complexes as signal unit.The structures and physical properties of prepared nanoprobes were characterized by SEM,TEM,XRD and nitrogen adsorption/desorption isotherms.Spectrophotometric determination was performed in phosphate buffer saline(PBS)buffer for Hcy/Cys sensing.To further understand the response mechanism,the effect of the aldehyde(CHO)group on the photophysical properties was calculated by using TDDFT calculation method.The result demonstrated that the as-prepared nanoprobe exhibited high selectivity for Hcy and Cys in pure PBS,which provides the advantage in developing excellent phosphorescent cellular probes for practical applications.
silica nanoparticles;phosphorescence nanoprobes;iridium complexes;biosensor
O614.82;O613.72
A
1001-4861(2012)11-2271-09
2012-05-15。收修改稿日期:2012-06-15。
国家自然科学基金(No.61006007),中国博士后科研课题(No.20100471354),江苏省博士后科研课题(No.1002024C)资助项目。
*通讯联系人。 E-mail:iamqzhao@njupt.edu.cn,iamwhuang@njupt.edu.cn,电话:+86-+86(25)85866008
