新疆酸马奶中抗氧化益生乳酸菌的筛选
2012-10-25李海英姚新奎唐血梅祝春梅曾亚琦刘婷婷韩煜茹
车 驰,李海英,姚新奎,唐血梅,董 婷,孟 军,祝春梅,曾亚琦,刘婷婷,韩煜茹
(新疆农业大学,新疆乌鲁木齐 830052)
新疆酸马奶中抗氧化益生乳酸菌的筛选
车 驰,李海英,姚新奎*,唐血梅,董 婷,孟 军,祝春梅,曾亚琦,刘婷婷,韩煜茹
(新疆农业大学,新疆乌鲁木齐 830052)
目的:筛选出性状优良、具有抗氧化活性的乳酸菌菌株,为开发具有抗氧化活性的功能性食品提供理论依据。方法:通过菌株对H2O2的耐受能力实验、羟自由基清除实验、还原活性测定实验以及亚铁离子螯合能力测定实验,对28株乳酸菌活细胞体、无细胞提取物以及胞外分泌物的抗氧化能力进行测定。结果:两株益生乳酸菌S3、Y11具有较高的抗氧化能力,对实验所用的不同浓度过氧化氢具有一定的耐受能力;当添加样品量为1.5mL时,两株菌的活细胞体和无细胞提取物对羟自由基的清除率分别为38.1%和25.2%,52.3%和29.7%;两株菌均具有还原活性,A700nm值分别为2.272和3.083;两株菌对亚铁离子(Fe2+)的螯合率分别为36.62%和43.16%。结论:28株乳酸菌菌株的抗氧化能力存在差异,乳酸菌菌体内可能含有较多的起抗氧化作用的活性物质,并筛选出2株具有较强抗氧化能力的乳酸菌菌株。
抗氧化,益生乳酸菌,筛选,还原能力
氧化作用是有机体的必要代谢过程,但是过度的氧化作用会造成生物大分子的损伤[1]。氧化代谢过程中不断产生各种活性氧分子(ROS),如羟自由基(·OH)、超氧阴离子自由基(·)、烷氧自由基(RO·)、过氧化氢(H2O2)等,可对 DNA、脂质及蛋白质造成损伤,并引发诸如癌症、动脉硬化、糖尿病、心血管病等多种疾病[2-4]。乳酸菌具有多种生理功能[5],如缓解腹泻,调节肠道菌群平衡;降低血脂胆固醇水平;调节血压作用;提高免疫功能[6-9]等。研究表明:某些乳酸菌具有显著的抗氧化活性,孟和毕力格等报道了酸马奶中的嗜酸乳杆菌MG2-1菌株具有抗氧化活性[10]。在检测乳酸菌的抗氧化活性时,目前主要测定菌株耐受H2O2的能力、清除超氧阴离子自由基(·)的能力、清除羟自由基(·OH)的能力、螯合Fe2+的能力、抗脂质过氧化能力、清除二苯代苦味肼基自由基(DPPH·)的能力及还原活性。本研究通过菌株对H2O2的耐受能力实验、羟自由基清除实验、还原活性测定实验以及亚铁离子螯合能力测定实验,对新疆少数民族地区传统自制酸马奶中的28株乳酸菌的活细胞体、无细胞提取物以及胞外分泌物的抗氧化能力进行测定,从中筛选出具有较好抗氧化活性的益生乳酸菌。为将具有抗氧化活性的乳酸菌应用于功能性食品的开发和生产提供理论依据。
1 材料与方法
1.1 材料与设备
28株乳酸菌菌株 编号S1~S14,样品采于新疆乌鲁木齐水西沟牧民家庭自制酸马奶;Y1~Y14 样品采于伊犁地区牧民家庭自制酸马奶,由实验室分离、保存;MRS培养基 蛋白胨10g,牛肉膏10g,酵母提取物5g,葡萄糖20g,乙酸钠5g,柠檬酸氢二氨2g,KH2PO42g,吐温 80 1mL,MnSO4·4H2O 0.25g,MgSO4·7H2O 0.58g,琼脂 15g,溴甲酚绿 0.03g,加水定容至 1000mL,pH6.2~6.4,灭菌,接入样品前加入0.4mmol/L H2O2;PBS 缓冲液 NaCl 8g,KCl 0.2g,Na2HPO4·7H2O 1.14g,KH2PO40.24g,加水定容至1000mL,pH7.4;铁氰化钾、L﹣半胱氨酸盐酸盐、过氧化氢、FeSO4、邻-菲罗啉、三氯乙酸、三氯化铁、抗坏血酸等试剂 均为国产分析纯。
TGL-16M高速台式冷冻离心机 长沙湘仪离心机仪器有限公司;TU-1810紫外可见分光光度计北京普析通用仪器有限责任公司;立式压力蒸汽灭菌器、数显电热培养箱 上海博迅实业有限公司医疗设备厂;超声波细胞粉碎仪 JY96-IIN;酸度计美国梅特勒-托利多仪器有限公司;恒温水浴振荡器 北京桑翌实验仪器研究所。
1.2 实验方法
1.2.1 乳酸菌的培养及菌体、胞外分泌物、无细胞提取物的制备 供试菌于MRS培养基37℃静置培养24h后,发酵液5000r/min离心15min,收集菌体,并用双蒸水洗涤3次,最后用双蒸水将乳酸菌的菌数调整到1010cfu/mL,即为待测菌体(IC)。
供试菌于MRS培养基37℃静置培养24h后,收集发酵液,用双蒸水将乳酸菌的菌数调整到1010cfu/mL,在5000r/min转速下离心15min,收集上清液,即为胞外分泌物。
供试菌于MRS培养基37℃静置培养24h后,发酵液5000r/min离心15min,收集菌体,用PBS洗涤3次,重悬于PBS,调整菌数到1010cfu/mL,冰浴超声破碎细胞,4℃ 12000×g离心30min,收集上清液,即为无细胞提取物(CFE)[11]。
1.2.2 乳酸菌在不同浓度H2O2溶液中的耐受能力测定 在100mL灭过菌的三角瓶中加入60mL MRS培养基,分别添加过氧化氢溶液,使培养基中的起始H2O2浓度分别为0.4、0.7、1.0mmol/L,并按体积分数1%的接种量接入分离所得的菌株培养液,置于37℃恒温培养箱中培养24h,取样测定OD600值,观察每株菌在不同起始过氧化氢浓度下的生长趋势,筛选具有高过氧化氢耐受性的乳酸菌[12]。
1.2.3 乳酸菌清除羟自由基(·OH)能力的测定在10mL具塞试管中依次加入5mmol/L硫酸亚铁溶液1mL,5mmol/L水杨酸-乙醇溶液1mL,3mmol/L双氧水溶液1mL,混合均匀后加入不同体积(0.5、1.0、1.5、2.0、2.5mL)的待测液,与待测液相同体积的1mmol/L的抗坏血酸做阳性对照,用双蒸水补齐至刻度,在(37±0.1)℃的恒温水中反应15min后,6000r/min离心 10min,然后以双蒸水做参比,在510nm下测定吸光度[13]。计算清除率:

其中A0为对照液的吸光度,Ax为加入待测液后的吸光度,每一吸光值平行测三次,取其平均值。
1.2.4 乳酸菌还原活性的测定 反应液中乳酸菌待测液0.5mL,1%铁氰化钾0.5mL,磷酸盐缓冲液(PBS 0.2mol/L,pH6.6)0.5mL,混合后在 50℃ 水浴中反应20min,冷却并加入10%三氯乙酸0.5mL,沉淀蛋白,离心后取1mL上清液与1mL 0.1%三氯化铁反应,于700nm测吸光值,其中L-半胱氨酸盐酸盐(1%)作为标品[14]。
1.2.5 乳酸菌与亚铁离子(Fe2+)螯合能力的测定1% 抗 坏 血 酸 0.1mL,0.4% FeSO40.1mL,NaOH(0.2mol/L)1mL的混合液加入0.5mL的乳酸菌的待测液,混合液37℃水浴20min,三氯乙酸沉淀蛋白,3000×g、4℃离心10mim,取0.2mL上清液加入2mL 0.1%邻-菲罗啉反应10min,于510nm测吸光值,以磷酸盐缓冲液(PBS 0.2mol/L,pH6.6)作为空白对照[15]。
2 结果与讨论
2.1 乳酸菌在不同浓度过氧化氢溶液中的耐受能力
过氧化氢是一种强氧化剂,可以对细胞和组织造成直接破坏,或作为羟自由基(·OH)前体间接参与氧化过程。
将乳酸菌菌株分别接种于含有不同浓度的过氧化氢培养基中,37℃培养24h,检测其菌体浓度(OD600值表示),结果见表1~表2。
从表1~表2可以看出,S3、Y6、Y11三株乳酸菌在过氧化氢浓度分别为0.4、0.7、1.0mmol/L的培养基中生长所测得的OD600值与空白溶液中的OD600没有太大的变化,表明这三株乳酸菌在实验所用的过氧化氢浓度下其生长几乎不受影响,说明这三株乳酸菌对过氧化氢有一定的耐受能力。
2.2 乳酸菌对羟自由基(·OH)的清除能力
本实验对S3、Y6、Y11三株菌的菌体及无细胞提取物进行了羟自由基清除能力的研究,以对羟自由基具有较强清除能力的抗坏血酸做阳性对照,结果见图1~图3。

图1 乳酸菌S3菌体及无细胞提取物清除羟自由基能力Fig.1 ·OH-scavenging capabilities by live cells and cell-free extracts of strain S3
从图1~图3可以看出,三株乳酸菌S3、Y6、Y11的活细胞体及无细胞提取物均表现出一定的清除羟自由基的能力,当添加样品量为1.5mL时,乳酸菌S3的活细胞体及无细胞提取物对羟自由基的清除率分别为38.1%和25.2%;乳酸菌Y6的活细胞体及无细胞提取物对羟自由基的清除率分别为50.3%和30.6%;乳酸菌Y11的活细胞体及无细胞提取物对羟自由基的清除率分别为52.3%和29.7%,而添加相同体积的1mmol/L的抗坏血酸,其对羟自由基的清除率为22.8%。另外,乳酸菌对羟自由基的清除能力与乳酸菌的添加量呈现正比关系。
2.3 乳酸菌的还原活性
一般情况下,样品的还原力与抗氧化能力呈正相关,于700nm波长测定吸光度,吸光度越大,表明样品的还原能力越强。结果见表3~表4。
从表3~表4可以看出,28株乳酸菌均表现出一定的还原能力,其中菌株 S3、S8、S11、Y5、Y6、Y10、Y11、Y12的还原能力比标品的还原能力强,其中菌株Y11的还原能力最强,A700nm为3.083;菌株S1的还原能力最弱,A700nm为0.043。实验表明:乳酸菌具有还原能力的活性物质的含量在不同菌株间具有差异。

表1 含有不同浓度H2O2培养基中乳酸菌的菌体浓度Table 1 Density of lactobacillus in media with various H2O2concentrations
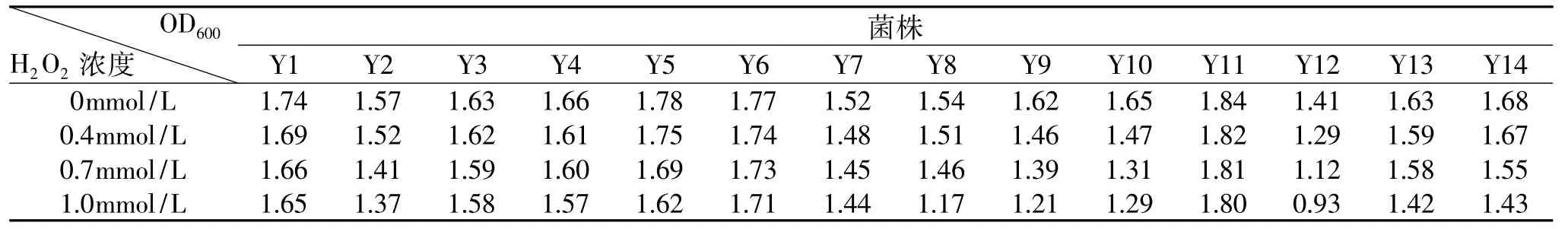
表2 含有不同浓度H2O2培养基中乳酸菌的菌体浓度Table 2 Density of lactobacillus in media with various H2O2concentrations

表3 乳酸菌菌株胞外分泌物的还原能力Table 3 Reducing activity of extracellular secretion from lactobacillus

表4 乳酸菌菌株胞外分泌物的还原能力Table 4 Reducing activity of extracellular secretion from lactobacillus

表5 乳酸菌体与亚铁离子(Fe2+)的螯合能力Table 5 Ferrous ion chelating abilities of lactobacillus

表6 乳酸菌体与亚铁离子(Fe2+)的螯合能力Table 6 Ferrous ion chelating abilities of lactobacillus

图2 乳酸菌Y6菌体及无细胞提取物清除羟自由基能力Fig.2 ·OH-scavenging capabilities by live cells and cell-free extracts of strain Y6
2.4 乳酸菌与亚铁离子(Fe2+)的螯合能力

图3 乳酸菌Y11菌体及无细胞提取物清除羟自由基能力Fig.3 ·OH-scavenging capabilities by live cells and cell-free extracts of strain Y11
有些蛋白质常会结合亚铁离子(Fe2+),在特定位置上形成羟基,促进脂质过氧化反应的进行,引起生物大分子的损伤。各菌株对亚铁离子(Fe2+)的螯合能力结果见表5~表6。
从表5~表6可以看出,28株乳酸菌菌体对亚铁离子(Fe2+)均有一定的螯合能力,其无细胞提取物对亚铁离子(Fe2+)的螯合能力较弱。乳酸菌S3、Y5、Y10、Y11对亚铁离子(Fe2+)的螯合率分别为36.62%、38.71%、31.03%、43.16%,高于其余菌株。实验结果表明:乳酸菌菌体组成成分中可能含有较多的螯合亚铁离子(Fe2+)的活性物质。
3 结论
本研究以具有抗氧化活性为筛选指标,对28株乳酸菌的活细胞体、无细胞提取物以及胞外分泌物的抗氧化能力进行测定,从中筛选出两株益生乳酸菌S3、Y11,两株菌在过氧化氢溶液中具有较好的耐受性,具有较高的清除羟自由基的能力和螯合亚铁离子(Fe2+)的能力,具有高效的还原活性。实验结果表明:乳酸菌菌体内可能含有较多的起抗氧化作用的活性物质,下一步应分离出这种起抗氧化作用的活性物质,并对其进行深入研究,为将具有抗氧化活性乳酸菌应用于功能性食品的开发和生产提供充分的理论依据。
[1]李素云,王立芹,郑嫁琳,等.自由基与衰老的研究进展[J].中国老年学杂志,2007,27(20):2046-2048.
[2]张江巍,曹郁生,李海星,等.乳酸菌抗氧化活性及检测方法 .[J].中国乳品工业,2005,33(9):53-56.
[3]张江巍,曹郁生.乳酸菌抗氧化活性的研究进展[J].中国乳品工业,2005,33(1):34-36.
[4]李勇,孔令青,高洪,等.自由基与疾病研究进展[J].动物医学进展,2008,29(4):85-88.
[5]王娇.乳酸菌生理功能的研究进展[J].四川食品与发酵,2005,41(2):43-46.
[6]Gotz V,Romankiewicz JA,Moss J.Prophylaxis against ampicillin-associated diarrhea with a lactobacillus preparation[J].American Journal of Hospital Pharmacy,1979(36):754-757.
[7]Gilliland S E,Speck M L.Deconjugation of bile-acids by intestinal lactobacilli[J] .Applied and Environmental Microbiology,1977(33):15-18.
[8]Akalin A S,Gonc S,Duzel S.Influence of yogurt and acidophilus yogurt on serum cholesterol levels in mice[J].Journal of Dairy Science,1997(11):2721-2725.
[9] Perdigon G,Locascio M,MediciM.Interaction of bifidobacteria with the gut and their influence in the immune function[J].Biocell,2003(1):1-9.
[10]孟和毕力格,周雨霞,张和平,等.酸马奶中乳杆菌MG2-1株的抗氧化作用研究[J].中国乳品工业,2005,33(9):21-24.
[11]Wang Y C,Yor C,Chou C C.Antioxidative activities of soymilks fermented with lactic acid bacteria and bifidobacteria[J].Food Microbiology,2006(23):128-135.
[12]Van Niel E W,Hofvendahl K,Hahn-Hagerdal B.Formation and conversion of oxygen metabolites by Lactococcus lactis subsp.Lactis ATCC 19435 under Different Growth Conditions[J].Appl Environ Microbiol,2002(68):4350-4356.
[13]李志英,张海容,梁会艳.5种葡萄酒清除羟自由基的比较[J].酿酒科技,2006,142(4):26-29.
[14]Winklhofer Roob B M,Ellemunter H,Fruhwirth M,et al.Plasma vitamin C concentrations in patients with cystic fibrosis:evidence of associations with lung inflammation[J].Am EricanJo Urnalof Clinical Nutrition,1997,65(6):1858-1866.
[15]Amanatidou A,Smid E J,Bennik M H J,et al.Antioxidative properties of lactobacillus sake upon exposure to elevated oxygen concentrations[J].FEMS Microbiology Letters,2001,203(1):87-94.
Screening of antioxidative lactobacillus from Koumiss in Xinjiang
CHE Chi,LI Hai-ying,YAO Xin-kui*,TANG Xue-mei,DONG Ting,MENG Jun,ZHU Chun-mei,ZENG Ya-qi,LIU Ting-ting,HAN Yu-ru
(Xinjiang Agricultural University,Urmuqi 830052,China)
Objective:In order to provide theoretical evidences for developing functional food with antioxidative activity,lactobacillus strains with antioxidative activity were selected.Methods:The antioxidant capabilities of 28 lactobacillus strains of live cells,cell- free extracts and extracellular secretions were determined through H2O2tolerance capability,scavenging capabilities of hydroxyl free radical,reducing activities and chelation abilities of ferrous ion.Results:S3 and Y11 displayed the excellent antioxidant capabilities among 28 lactobacillus strains.The two desired strains showed excellent tolerance in different concentration of H2O2in culture media;Scavenging efficiencies of S3 and Y11 cell suspension and cell-free extracts were 38.1%,25.2%and 52.3%,29.7%for hydroxyl free radicals when addition level was 1.5mL;The two lactobacillus strains showed good reducing activities,the values of A700nmwere 2.272 and 3.083;The percentage of chelating ferrous ion(Fe2+)capacity were 36.62%and 43.16%,respectively.Conclusion:28 lactobacillus strains had different antioxidant capabilities.Antioxidative active substances might exist in lactobacillus live cells,and 2 lactobacillus strains with antioxidative activity were selected.
antioxidative activity;lactobacillus;screening;reducing activity
TS252.1
A
1002-0306(2012)17-0176-04
2011-10-24 *通讯联系人
车驰(1985-),女,在读硕士研究生,研究方向:乳及乳制品质量安全控制技术。
国家农业部公益性行业专项(201003075);新疆维吾尔自治区科技重大专项(201130101)。
