美拉德反应条件对ε-聚赖氨酸-壳聚糖复合物乳化性及抑菌性的影响
2012-10-24王莹莹梁春璇许朵霞高彦祥
王莹莹,祈 欣,梁春璇,许朵霞,袁 芳,高彦祥,*
(1.中国农业大学食品科学与营养工程学院,北京100083;
2.中国计量科学研究院,北京 100083)
美拉德反应条件对ε-聚赖氨酸-壳聚糖复合物乳化性及抑菌性的影响
王莹莹1,祈 欣2,梁春璇1,许朵霞1,袁 芳1,高彦祥1,*
(1.中国农业大学食品科学与营养工程学院,北京100083;
2.中国计量科学研究院,北京 100083)
采用干热美拉德反应制备了ε-聚赖氨酸-壳聚糖共价复合物,研究了反应时间及反应温度对共价复合物乳化性和抑菌性的影响。褐变检测、凝胶渗透色谱分析以及红外分析表明:ε-聚赖氨酸和壳聚糖在干热反应后发生共价交联并且结构发生了变化。当ε-聚赖氨酸与壳聚糖质量比1∶5时,在70℃下反应6h的共价复合物不仅提高了乳化稳定性和乳化活性,而且保留了其抑菌活性。
ε-聚赖氨酸,壳聚糖,美拉德反应,乳化性,抑菌性
ε-聚赖氨酸作为新型天然防腐剂,已于2003年10月被FDA批准为安全食品保鲜剂,而且ε-聚赖氨酸在体内可被分解为人体必需的L-赖氨酸,所以ε-聚赖氨酸天然、营养、安全。ε-聚赖氨酸作为天然抗菌剂应用于食品工业中的一个难题是其易与蛋白质或酸性多糖结合,可能造成抗菌活性的丧失[1]。此外,由于ε-聚赖氨酸乳化性能差,使其应用受到限制,多用于淀粉食品[1-2]。HoYuTing 等[3]通过凝胶过滤层析法和SDS-PAGE证实了葡聚糖通过美拉德反应共价结合到ε-聚赖氨酸上,该共价接枝物的乳化性能不仅优于 ε-聚赖氨酸,还优于商业乳化剂Sunsoft SE-11(蔗糖脂肪酸酯)和Q-18S(多缩丙三醇酯)。而且,该接枝物保留了ε-聚赖氨酸的大部分抑菌能力。壳聚糖是天然多糖中唯一大量存在的碱性氨基多糖,具有很多优良特性,包括成膜性、保湿性、抗菌性等,并能发生诸如水解、螯合、絮凝、吸附等多种化学反应[4]。国内外研究表明:壳聚糖具有一定乳化性,可以做乳化剂使用[5-8]。也有学者将壳聚糖通过美拉德反应共价结合到蛋白质上,提高蛋白质的乳化性质。例如,大豆蛋白的乳化性很低,而Usui等[9]制备的大豆蛋白-壳聚糖接枝物的乳化活性提高了2倍,乳化稳定性提高了8倍。本文以ε-聚赖氨酸和壳聚糖为实验原料,研究了美拉德反应条件(主要是温度和时间)对ε-聚赖氨酸-壳聚糖共价复合物的乳化性和抑菌性的影响。旨在为新型多功能食品添加剂(乳化剂和抑菌剂)的开发提供理论基础。
1 材料与方法
1.1 材料与仪器
ε-聚赖氨酸 浙江银象生物工程有限公司;壳聚糖 浙江金壳生物化学有限公司,脱乙酰度91.3%;葵花籽油 购自超市;实验菌种 中国农业大学食品科学与营养工程学院微生物实验室提供;Mueller-Hinton 肉汤培养基(MHB)、Mueller-Hinton琼脂培养基(MHA) 北京奥博星生物技术公司。
冷冻干燥机 Alpha 1-2 D Plus 德国 Marin Christ;激光光散射仪DAWN EOS 美国Wyatt公司;高速剪切机Ultra-turrax T25 Digital 德国 IKA公司;高压均质机NS1001L2K 意大利Niro-Soavi公司;激光粒度仪Nano-ZS90 英国Malvern公司;浓缩体系稳定性分析仪Turbiscan Lab Expert 法国Formulation公司。
1.2 实验方法
1.2.1 ε-聚赖氨酸与壳聚糖共价复合物的制备及褐变检测 将ε-聚赖氨酸与壳聚糖以质量比1∶5分散于适量去离子水中[10-11],冷冻干燥后,将冻干粉置于底部盛有饱和KBr(相对湿度79%)的干燥器中,分别采用60、70、80℃反应温度,反应 1~12h,在不同的反应时间内取样。将上述样品用1%乙酸溶液配制成总物质含量为1%(w/v)的溶液,于420nm处测定吸光值A420,1%乙酸溶液为空白对照[12]。
1.2.2 凝胶渗透色谱(GPC)分离条件 将壳聚糖及其接枝物样品溶于乙酸缓冲液中,用0.22μm微孔过滤膜过滤后进样,采用Wyatt EOS光散射检测器和Wyatt optilab示差检测器;流速和柱温分别控制在0.5mL/min和 35.0℃;进 样 量 200μL;激 光 波长690nm。
1.2.3 红外分析 将制备好的ε-聚赖氨酸-壳聚糖复合物溶于乙酸缓冲液,再置于蒸馏水中透析1周,然后将所得透析液冷冻干燥制成干粉。准确称取适量样品,加入一定量干燥的溴化钾,一同研磨成均匀的粉末,压成薄片,再用傅里叶红外分光光度计作全波段(4000~450cm-1)扫描。
1.2.4 乳状液的制备 将反应前后的样品分别以1%的质量浓度溶于醋酸缓冲液(pH4.0)中,搅拌过夜,至完全溶解,形成水相。在高速剪切机的搅拌下缓慢将3mL葵花籽油加入147mL水相中,以10000r/min剪切10min,形成粗乳状液;再将粗乳状液通过高压均质机(一、二级均质压力分别为6、60MPa)均质三次,制成ε-聚赖氨酸-壳聚糖复合物乳状液。
1.2.5 乳状液粒径分析 将制备的乳状液用去离子水稀释1000倍后,采用Zetasizer Nano-ZS90激光粒度仪室温分析乳液粒径大小,结果以平均粒径(nm)表示。
1.2.6 乳状液物理稳定性快速评价 本实验采用Turbiscan Lab Expert浓缩体系稳定性分析仪对乳状液的稳定性进行快速分析。仪器采用脉冲近红外光源(λ=880nm)自下而上扫描样品,两个同步光学探测器分别搜集透射光和背散射光。在一定时间内连续扫描样品,获得透射光与背散射光信号对样品高度的函数曲线图,即可反映出样品中颗粒运动趋势,进而预测出纳米乳状液的稳定性。实验选用稳定性系数来分析乳状液的稳定性。稳定性系数越小,表示样品越稳定。实验中,每个样品取20mL置于Turbiscan测试瓶中(样品高度约为43mm),将测试瓶放入检测池中,温度设定为常温25℃,每30min扫描一次,扫描8h,记录扫描图谱。
1.2.7 抑菌实验 菌种活化:用接种环将原始菌种接种到新鲜培养基斜面上,于37℃培养箱培养24h;细菌菌悬液制备:从菌种斜面上刮取少量菌体接种于MHB培养基增菌,37℃培养箱培养20~24h后,采用活菌计数法测定菌数,将制备好的菌液放入4℃冰箱保存备用。
称取一定量不同条件下制备的ε-聚赖氨酸-壳聚糖复合物溶于1%乙酸溶液(无菌水配制)中,制成浓度为2%的样品溶液,并用1%乙酸溶液做空白对照。用打孔器制备直径为6mm的滤纸片。将灭过菌的滤纸片分别放入不同样品溶液中,浸泡40min,取出待用。将0.1mL 106~107cfu/mL的细菌悬液接种于固体LB培养基上,涂布均匀,用无菌镊子取浸泡过的滤纸片贴于含菌平板上[13],再将培养皿于温度4℃条件下放置2h,然后将细菌培养皿置于37℃培养箱中培养24h。测量抑菌圈直径。
2 结果与讨论
2.1 ε-聚赖氨酸-壳聚糖复合物褐变检测
温度对美拉德反应影响较大,有研究表明,反应温度与美拉德反应速度呈正相关,温度相差10℃,反应速度相差3~5倍[14]。如图1所示,60℃条件下,时间对褐变影响不大;随着温度的升高,时间对褐变的影响显著;80℃加热时,6h以后褐变较为严重。
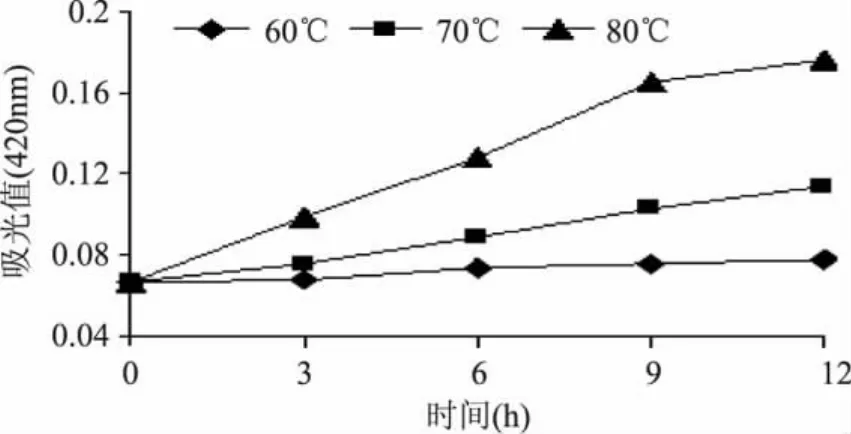
图1 不同温度下Maillard反应进程Fig.1 Progress curves of Maillard reaction at different temperatures
2.2 ε-聚赖氨酸-壳聚糖复合物凝胶渗透色谱分析
图2中,斜线表示分子量,其斜率由化学性质决定,反映分子链的光学性质,斜率发生变化,表示物质的化学性质发生变化。由图2可以看出,ε-聚赖氨酸-壳聚糖混合物(mixture)的斜率明显区别于80℃反应6h的ε-聚赖氨酸-壳聚糖共价复合物(conjugate)的斜率,表明ε-聚赖氨酸-壳聚糖混合物在加热处理下,发生了Maillard反应,共价结合生成了ε-聚赖氨酸-壳聚糖接枝物。反应前后物质的相对分子质量分布变化如表1所示,接枝物与混合物相比,相对分子质量在40ku以下的组分含量减少,相对分子质量在20~40ku及15ku以下的组分变化尤其明显;40~100ku分子段的组分含量略有增加,相对分子质量在100ku以上的组分含量增加较多。
2.3 红外分析
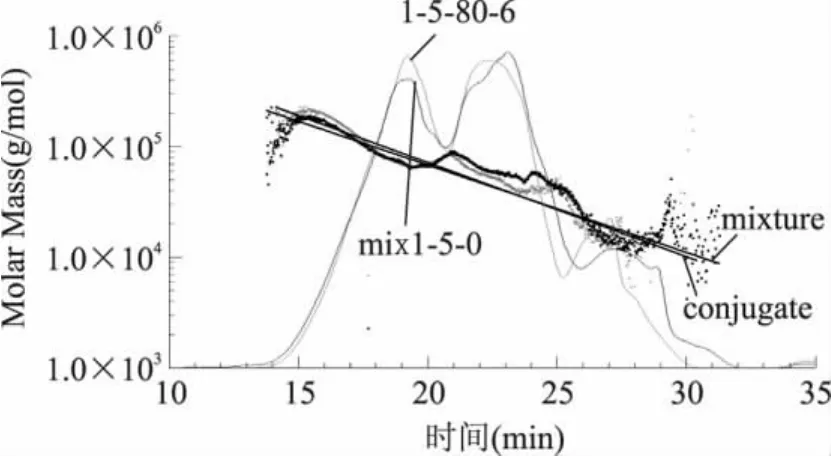
图2 ε-聚赖氨酸-壳聚糖复合物凝胶渗透色谱图Fig.2 The gel permeation chromatographyof ε-polylysine/chitosan
图3中,ε-聚赖氨酸-壳聚糖共价复合物与壳聚糖相比,其特征谱带酰胺Ⅰ谱带和酰胺Ⅱ谱带的吸收明显增强。壳聚糖的还原末端与ε-聚赖氨酸的氨基反应形成的席夫碱中的C=N结构引起了1560cm-1处吸收的增强[13],在壳聚糖与纤维素二糖的美拉德反应中也出现了类似的结果[15]。CH(R1,R2)NH2结构中的C-N伸缩振动在1200~1100cm-1处具有吸收[16],所以ε-聚赖氨酸-壳聚糖共价复合物在1153.89cm-1处吸收峰的增强是由共价结合到壳聚糖上的ε-聚赖氨酸中丰富的α氨基引起的,C-O伸缩也在该处具有吸收[17]。1080cm-1附近出现强C-O伸缩振动吸收峰[18]。以上分析表明,ε-聚赖氨酸与壳聚糖发生了美拉德反应,以共价键的形式结合起来。
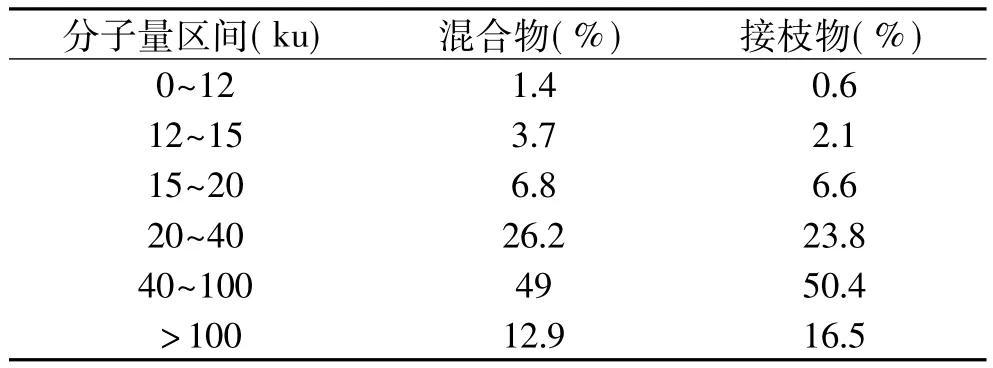
表1 ε-聚赖氨酸/壳聚糖复合物相对分子质量分布Table 1 Molecular weight of ε-polylysine/chitosan
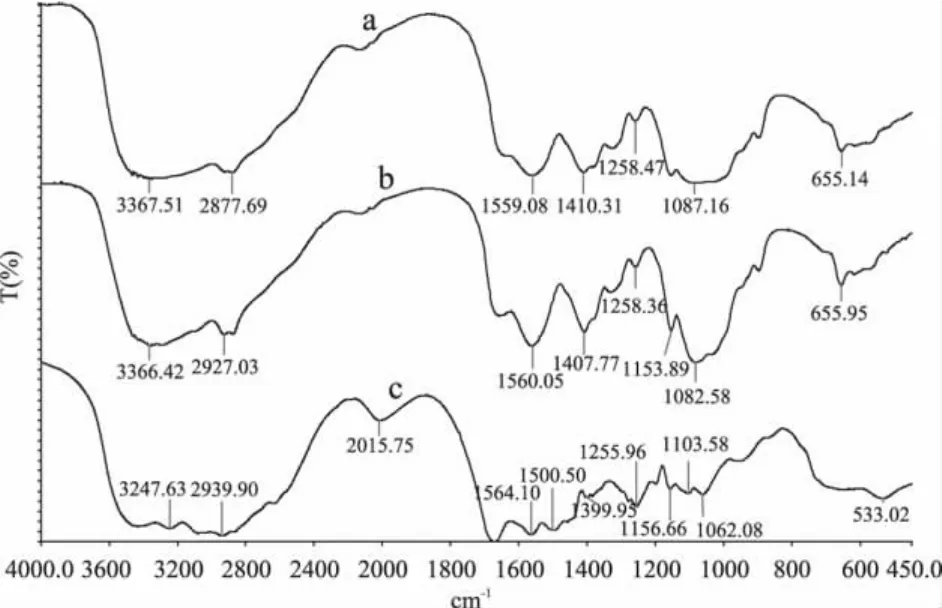
图3 ε-聚赖氨酸、壳聚糖及其共价复合物FT-IR图谱Fig.3 FT-IR spectrum of ε-polylysine,chitosan and conjugate
2.4 反应条件对ε-聚赖氨酸-壳聚糖共价复合物制备乳状液粒径及稳定性的影响
由图4及图5可知,热处理前后的壳聚糖制备乳状液的粒径和稳定性无差异,可见壳聚糖性质稳定,干热处理对其性质无影响。通过Maillard反应,质量比为1∶5的ε-聚赖氨酸-壳聚糖反应3h的共价复合物制备的乳液粒径比0h的显著性降低,而且随着反应时间的延长继续下降,6h以后趋于稳定。在相同时间下,80℃的粒径最小,70℃次之,60℃最大,表明温度越高,反应程度越高。适度交联,可以使直线型的壳聚糖分子形成具有一定分支结构的大分子,能够有效地包裹油滴[3],从而提高壳聚糖的乳化活性。ε-聚赖氨酸是阳离子表面活性物质,在水中带正电;分子内部有疏水性的亚甲基,外部有亲水的羧基和氨基。ε-聚赖氨酸-壳聚糖共价复合物与壳聚糖相比,增加了壳聚糖的阳离子和亚甲基数目,提高复合物乳化性的同时使其具有一定的疏水性,从而使复合物能快速且紧密地吸附在油水界面上。
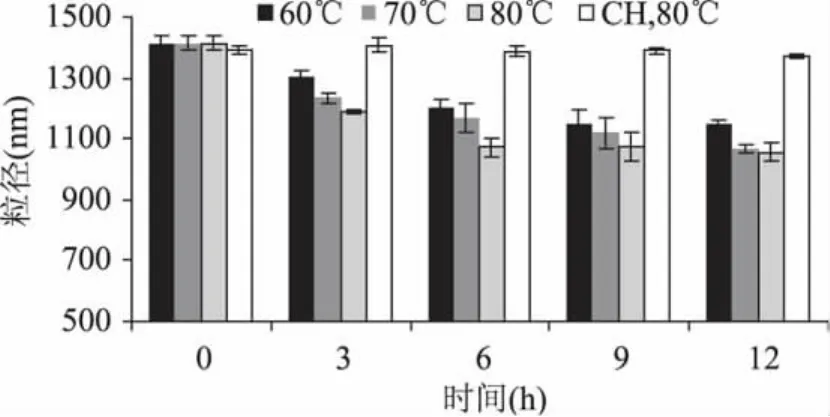
图4 不同温度和时间对ε-聚赖氨酸-壳聚糖复合物制备乳状液粒径的影响Fig.4 Influence of reaction tempreture andtime during preparation of ε-polylysine-chitosan conjugateson the droplet size of emulsions
ε-聚赖氨酸-壳聚糖共价复合物的乳化稳定性系数变化如图5所示,60、70、80℃的稳定性系数在3h时显著降低,随着反应时间的延长,70、80℃的稳定性系数在6h以后逐渐增大,即乳化稳定性变差,80℃尤其明显,由0h的1.40降至6h的0.61,随后在9、12h分别增至1.19、1.76。这是由于在80℃条件下,ε-聚赖氨酸与壳聚糖反应剧烈造成的。ε-聚赖氨酸若由n个赖氨酸聚合而成,则具有n+1个自由氨基,反应基团多,反应活性大,尤其是ε-聚赖氨酸末端的ε氨基。Maillard反应一般分为三个阶段,蛋白质-多糖复合物主要是第一阶段的Amadori重排产物中的一类,反应时间过长将影响复合物的功能性[19]。反应温度60℃与80℃相比,反应较温和,3、6、9h的稳定性系数无显著性差异。在壳聚糖与溶菌酶的
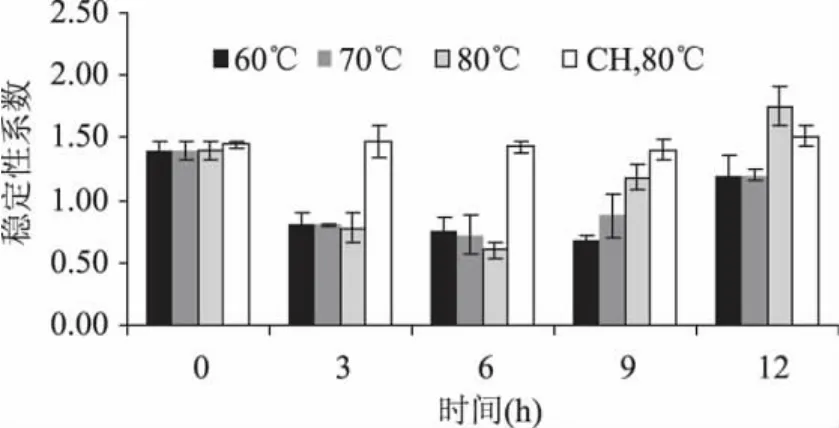
图5 不同温度和时间对ε-聚赖氨酸-壳聚糖复合物制备乳状液稳定性的影响Fig.5 Influence of reaction tempreture and time during preparation of ε-polylysine-chitosan conjugates on emulsions stability

表2 不同温度、不同时间条件下的ε-聚赖氨酸-壳聚糖共价复合物对大肠杆菌的抑菌直径(mm)Table 2 Antibacterial activity of ε-polylysine-chitosan conjugates heated for different reaction tempretures and times on Escherichia coli(mm)
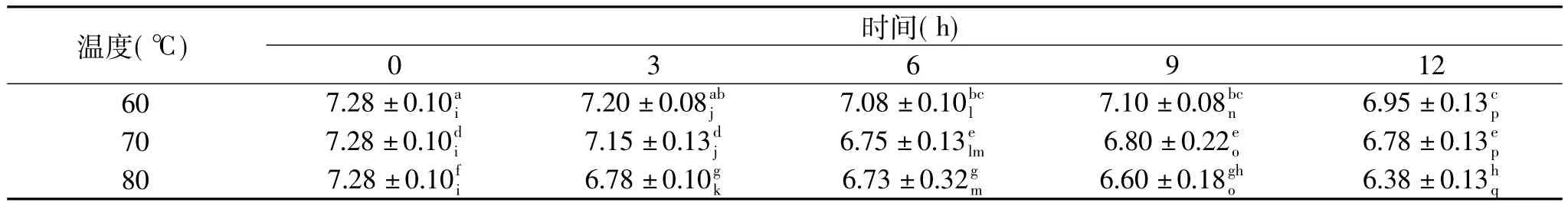
表3 不同温度、不同时间条件下的ε-聚赖氨酸-壳聚糖共价复合物对金黄色葡萄球菌的抑菌直径(mm)Table 3 Antibacterial activity of ε-polylysine-chitosan conjugates heated for different reaction tempretures and times on Staphylococcus aureus(mm)
Maillard反应中,共价复合物由于具有了壳聚糖的阳离子排斥力,可以抑制油滴的聚合,从而提高了其乳状液的稳定性[10]。ε-聚赖氨酸-壳聚糖共价复合物中由于ε-聚赖氨酸的加入,阳离子增多,分子间静电排斥力增大,使乳液稳定性提高,但是当反应程度较大时,生成的物质分子量过大,交联程度过高,蛋白质多糖共价复合物的溶解性降低[19],从而降低了乳状液的稳定性。
2.5 美拉德反应条件对ε-聚赖氨酸-壳聚糖共价复合物抑菌性质的影响
由表2及表3可以看出,不同反应程度的ε-聚赖氨酸-壳聚糖共价复合物对大肠杆菌和金黄色葡萄球菌呈现出不同的抑菌性。1%乙酸空白对照未出现抑菌圈,表明该浓度乙酸溶液对ε-聚赖氨酸-壳聚糖共价复合物的抑菌性没影响。对于大肠杆菌,60℃和70℃条件下不同处理时间的ε-聚赖氨酸-壳聚糖共价复合物的抑菌性未出现变化,而80℃对其影响明显,加热3h后抑菌性明显降低。在60℃和70℃条件下,加热6h时,ε-聚赖氨酸-壳聚糖共价复合物对金黄色葡萄球菌的抑菌性明显降低,由0h时的7.28mm分别下降到7.08、6.75mm,70℃对其影响更为显著。80℃对金黄色葡萄球菌的影响呈现出与大肠杆菌相同的趋势。
不同反应程度的ε-聚赖氨酸-壳聚糖共价复合物对大肠杆菌和金黄色葡萄球菌的抑菌性不同,可能与ε-聚赖氨酸和壳聚糖的抑菌机理有关。对于壳聚糖的抑菌机理,通常有两种解释,一种是大分子的壳聚糖吸附在微生物细胞表面,形成一层高分子膜,阻止了营养物质向细胞内运输,从而起到杀菌和抑菌作用[20];令一种是壳聚糖的正电荷与微生物细胞膜表面的负电荷之间的相互作用,改变了微生物细胞膜的通透性,引起微生物细胞死亡[21]。Vaara[22]和Santini[23]等研究 ε-聚赖氨酸的抑菌机理发现,ε-聚赖氨酸在水溶液中由于带有正电荷(-NH+3),能够与革兰氏阴性菌细胞外膜结合并将其破坏,从而导致细胞死亡。Ting等[3]人研究美拉德反应对ε-聚赖氨酸抑菌性的影响,发现 ε-聚赖氨酸与葡聚糖在80℃、pH11的条件下,反应初期对ε-聚赖氨酸的抑菌性没有影响,但是延长加热时间则会导致ε-聚赖氨酸对部分微生物的抑菌浓度有所降低。李春林[24]在亚临界水体系里研究了这二者的美拉德反应,也出现了类似的结果,在110℃、5MPa下,反应达到75min时,复合物的最小抑菌浓度(MIC)提高到原来的2倍。
表2及表3中,80℃条件下,ε-聚赖氨酸-壳聚糖共价复合物对大肠杆菌和金黄色葡萄球菌的抑菌性显著降低,是由于该条件下ε-聚赖氨酸和壳聚糖反应程度较大,造成ε-聚赖氨酸自由氨基大量损失,而自由氨基是ε-聚赖氨酸的“消毒因子”;此外,ε-聚赖氨酸和壳聚糖交联过度,导致生成的复合物分子量过大,分子移动性和灵活性变差,从而降低了其抑菌性。
3 结论
研究表明,ε-聚赖氨酸、壳聚糖混合物在加热条件下发生Maillard反应,生成ε-聚赖氨酸-壳聚糖共价复合物。在适当的反应条件下(ε-聚赖氨酸、壳聚糖质量比1∶5、反应温度70℃、反应时间6h),生成的共价复合物不仅提高了乳化稳定性和乳化活性,而且保留了抑菌能力。
[1]Hiraki J.Basic and applied studies on ε - polylysine[J].J Antibact Antifungal Agents,1995,23:349-354.
[2]Otsuka N,Kuwahara Y,Manabe M.Effect of ε-poly-lysine on preservation of boiled noodles[J].Nippon Shokuhin Kogyo Gakkaishi,1992,39(4):344-347.
[3]Ho Y T,Ishizaki S,Tanaka T.Improving emulsifying activity of ε-polylysine by conjugation with dextran through the maillard reation[J].Food Chemistry,2000,68(4):499-455.
[4]强涛涛,王学川,任龙芳.壳聚糖化学改性的研究进展[J].皮革化工,2005,22(5):14-17.
[5]Schulz P C,Rodrõ guez M S,Del Blanco L F,et al.Emulsification properties of chitosan[J].Colloid Polymer Science,1998,276(12):1159-1165.
[6]Rodrguez M S,Albertengo L A,Agull E.Emulsification capacity of chitosan[J].Carbohydrate Polymers,2002,48(3):271-276.
[7]Payet L,Terentjev E M.Emulsification and stabilization mechanisms of O/W emulsions in the presence of chitosan[J].Langmuir,2008,24(21):12247-12252.
[8]Li X K,Xia W S.Effects of concentration,degree of deacetylation and molecular weight on emulsifying properties of chitosan[J].International Journal of Biological Macromolecules,2011,48(5):768-772.
[9]Usui M,Tamura H,Nakamura K,et al.Enhanced bactericidal action and masking of allergen structure of soy protein by attachmentofchitosan through Maillard-type proteinpolysaccharide conjugation[J].Nahrung- Food,2004,48(1):69-72.
[10]Song Y,Babiker E E,Usui M,et al.Emulsifying properties and bactericidal action of chitosan-lysozyme conjugates[J].Food Research International,2002,35(5):459-466.
[11]Babiker E E.Effect of chitosan conjugation on the functional properties and bactericidal activity of gluten peptides[J].Food Chemistry,2002,79(3):367-372.
[12]Ajandouz E H,Tchiakpe L S,Ore F D,et al.Effects of pH on caramelization and Maillard reaction kinetics in fructose-lysine model systems[J].Journal of Food Science,2001,66(7):
926-931.
[13]Li X X,Shi X W,Wang M,et al.Xylan chitosan conjugate-A potential food preservative[J].Food Chemistry,2011,126(2):520-525.
[14]阚建全.食品化学[M].北京:中国农业大学出版社,2002.
[15]Umemura K,Kawai S.Modification of chitosan by the Maillard reaction using cellulose modelcompounds[J].Carbohydrate Polymers,2007,68(2):242-248.
[16]吴瑾光.近代傅里叶变换红外光谱技术及应用:上卷[M].北京:科学技术文献出版社,1994.
[17]Umemura K,Kawai S.Preparation and characterization of Maillard reacted chitosan films with hemicellulose model compounds[J].Journal of Applied Polymer Science,2008,108(4):2481-2487.
[18]王学东,吴国庆,陈相英,等.乳糖化聚赖氨酸共价结合物的制备和分析[J].潍坊医学院学报,2003,25(2):119-120.
[19]许朵霞,许洪高,毛立科,等.蛋白质多糖共价复合物的研究进展[J].食品研究与开发,2008,29(11):186-190.
[20]Liu H,Du Y M,Wang X H,et al.Chitosan kills bacteria through cell membrane damage[J].International Journal of Food Microbiology,2004,95(2):147-155.
[21]Helander I M,Nurmiaho-Lassila E L,Ahvenainen R,et al.Chitosan disrupts the barrier properties of the outer membrane of gram - negative bacteria[J].International Journal of Food Microbiology,2001,71(2-3):235-244.
[22]Vaara M.Agents that increase the permeability of the outer membrane[J].Microbiological Review,1992,56(3):395-411.
[23]Santini M,Cesare C,Pietro L.Polylysine induces changes in membrane electrical properties of K562 cells[J].Journal of Biomedical Materials Research,1997,35(2):165-174.
[24]李春林.亚临界水中ε-聚赖氨酸葡聚糖共价复合反应的研究[D].北京:中国农业大学,2011.
Effect of Maillard reaction conditions on emulsifying properties and antibacterial activity of ε-polylysine-chitosan conjugates
WANG Ying-ying1,QI Xin2,LIANG Chun-xuan1,XU Duo-xia1,YUAN Fang1,GAO Yan-xiang1,*
(1.College of Food Science & Nutritional Engineering,China Agricultural University,Beijing 100083,China;2.National Institute of Metrology,Beijing 100083,China)
In this study,the conjugation of ε-polylysine and chitosan through Maillard reaction under different dry heating conditions had been investigated.Emulsifying properties and antibacterial activity of ε-polylysine-chitosan conjugates were compared at different reaction temperatures and reaction times.The browning at 420nm,gel permeation chromatography of ε-polylysine-chitosan conjugates and FTIR proved the conjugation of ε-polylysine and chitosan.It was found that the conjugates formed from ε-polylysine and chitosan(1∶5 weight ratio)at 70℃ for 6h had excellent emulsifying properties and retained the antibacterial activity of ε-polylysine and chitosan.
ε-polylysine;chitosan;Maillard reaction;emulsifying properties;antibacterial activity
TS202.3
A
1002-0306(2012)17-0134-05
2012-02-15 *通讯联系人
王莹莹(1986-),女,硕士研究生,研究方向:食品添加剂。
国家自然科学基金资助项目(31071609)。
