Imoto比色法测定壳寡糖含量的研究
2012-10-24谭佩毅黄秀锦
谭佩毅,黄秀锦
(江苏食品职业技术学院,江苏淮安 223003)
Imoto比色法测定壳寡糖含量的研究
谭佩毅,黄秀锦
(江苏食品职业技术学院,江苏淮安 223003)
从标准品的选择、波长选定、试剂用量、比色条件、线性关系等方面研究了Imoto比色法测定壳寡糖含量的最佳条件。结果表明,测定波长为438nm,比色最佳条件为10g/L铁氰化钾3.5mL、0.5mol/L Na2CO33.5mL、水浴加热时间85min、加热温度95℃;以氨基葡萄糖盐酸盐作为标准对照品,浓度在0~60μg/mL范围内线性关系良好。采用该比色法测得水解液中壳寡糖含量为39.77μg/mL,RSD值为2.15%。
壳寡糖,Imoto比色法,氨基葡萄糖盐酸盐
壳聚糖(Chitosan)是甲壳素部分脱乙酰基后的产物[1],具有显著的生物生理活性[2]和良好的功能性质,已在食品、化妆品、生物制药、农业、环境保护以及废水处理等领域中都得到了应用[3]。但由于壳聚糖分子量较大,分子间及分子内存在大量的氢键,使得壳聚糖分子结构紧密,且只能溶解于稀乙酸等酸性溶液中形成透明状的黏液[4-5],因此壳聚糖在以上领域中的应用很大程度上受到了限制。壳寡糖(chitooligosaccharides)又称寡聚氨基葡糖,是壳聚糖降解后得到的由2~10个氨基葡糖通过β-1,4-糖苷键连接而成的低聚糖[6]。壳寡糖是天然糖中唯一大量存在的碱性氨基寡糖[7],由于分子量和聚合度较低,溶解性和吸收率较好,易于被人体、动物及植物机体吸收利用[8],因此,在保健品、营养剂、食品添加剂等方面都具有良好的应用价值。壳寡糖来源广泛,安全无毒,水溶性好,有多种生物活性,已引起国内外医药研究者的广泛关注。但测定壳寡糖含量的方法尚不成熟,目前基本采用测定D-氨基葡萄糖的方法间接测定壳寡糖含量,目前氨基葡萄糖常见的测定方法有Elson-Morgan法[9-10]、Imoto法[11-12]、苯酚-硫酸法[13]和3,5-二硝基水杨酸法(DNS法)[14]。其中Elson-Morgan法操作繁琐且回收率低,不适用于氨基糖与乙酰氨基糖混合的体系;苯酚-硫酸法显色较浅,不适于氨基糖及乙酰氨基糖类物质的测定;DNS法有较好的显色效果,但此法的灵敏度略低[15];Imoto法具有显色效果较好,可用于测定氨基糖与乙酰氨基糖混合的体系,且灵敏度较高,稳定性好,重复性好[16]。本实验分别从标准品的选择、吸收波长的确定、试剂用量及线性关系等方面进行考察,确定Imoto比色法测定壳寡糖含量的最佳条件,并通过重现性、回收率等实验对该方法进行考察。
1 材料与方法
1.1 材料与仪器
壳寡糖(黄色粉末) 自制;葡萄糖、氨基葡萄糖、乙酰氨基葡萄糖、氨基葡萄糖盐酸盐 Sigma公司;HCl、铁氰化钾、无水Na2CO3均为分析纯。
TU-1900紫外可见分光光度计 北京普析通用仪器有限责任公司;SHA-C恒温水浴锅 上海医疗器械厂;JA1003A电子精密天平 上海伦捷机电仪表有限公司。
1.2 实验方法
1.2.1 溶液的配制
1.2.1.1 标准溶液的配制 精确称取40℃真空干燥至恒重的葡萄糖、氨基葡萄糖、乙酰氨基葡萄糖、氨基葡萄糖盐酸盐对照品各100.00mg,置于100mL容量瓶中,加水溶解并定容至刻度,摇匀即得1mg/mL对照品储备液[17]。
1.2.1.2 10g/L铁氰化钾溶液的配制 准确称取1.00g铁氰化钾置于100mL棕色容量瓶中,去离子水定容,摇匀备用。
1.2.1.3 0.5mol/L Na2CO3溶液的配制 准确称取5.30g无水Na2CO3置于100mL容量瓶中,加入50mL温水,搅拌溶解后冷却至室温,加水定容至100mL。
1.2.1.4 壳寡糖溶液的配制 准确称取1.00g壳寡糖置于100mL容量瓶中,用0.5mol/L乙酸溶液定容至100mL,振荡溶解后备用。
1.2.2 壳寡糖水解液的制备 准确量取壳寡糖溶液1mL置入小烧杯中,沿壁缓缓加入4mL 6mol/L HCl溶液,混合后置于沸水浴中水浴4h,流水冷却后备用[5]。1.2.3 比色条件的确定
1.2.3.1 标准品及波长的选择 分别量取葡萄糖、氨基葡萄糖、乙酰氨基葡萄糖、氨基葡萄糖盐酸盐标准溶液和壳寡糖水解液各1.0mL置于25mL比色管中,分别加入3mL铁氰化钾和3mL Na2CO3溶液,加水定容至25mL,具塞摇匀,用铝箔封住比色管口,置于沸水浴中30min[12],冷却后以去离子水做基线,用紫外-可见分光光度计在300~800nm波长范围内进行扫描,得到葡萄糖、氨基葡萄糖、乙酰氨基葡萄糖、氨基葡萄糖盐酸盐经褪色反应后的吸收光谱,并与壳寡糖水解液经褪色反应后的吸收光谱进行比较,以选择最适标准品,同时确定最大吸收波长。
1.2.3.2 铁氰化钾溶液添加量的确定 取洁净25mL比色管7支,分别加入壳寡糖水解液各1mL,再依次加入0、1.0、2.0、3.0、4.0、5.0、6.0mL铁氰化钾溶液,然后分别加入Na2CO3溶液5mL,按照1.2.3.1所示方法在最大吸收波长处测定吸光度值,考察铁氰化钾溶液添加量对褪色效果的影响。
1.2.3.3 Na2CO3溶液添加量的确定 取洁净25mL比色管7支,分别加入壳寡糖水解液和铁氰化钾,再依次加入0、1.0、2.0、3.0、4.0、5.0、6.0mL Na2CO3溶液,按照1.2.3.1所示方法在最大吸收波长处测定吸光度值,考察Na2CO3溶液添加量对褪色效果的影响。
1.2.3.4 水浴加热时间的确定 取洁净25mL比色管10支,分别加入壳寡糖水解液、铁氰化钾和Na2CO3溶液,按照1.2.3.1所示方法分别置于沸水浴中加热,每隔10min取出一管在最大吸收波长处测定吸光度值,考察加热时间对褪色效果的影响。
1.2.3.5 水浴加热温度的确定 取洁净25mL比色管6支,分别加入壳寡糖水解液、铁氰化钾和Na2CO3溶液,按照1.2.3.1操作后分别置于50、60、70、80、90、100℃水浴锅中加热,取出冷却后在最大吸收波长处测定吸光度值,考察加热温度对褪色效果的影响。
1.2.3.6 正交实验 依据单因素实验结果,以铁氰化钾添加量、Na2CO3添加量、水浴加热时间、水浴加热温度为考察因素,以吸光度值为考察指标,采用L9(34)正交实验设计,分析各因素对吸光度的影响,以确定最佳比色条件,正交实验平行两次。因素水平见表1。
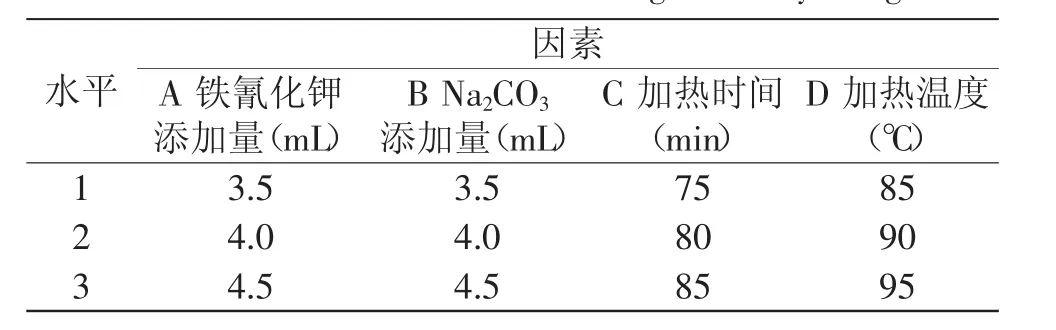
表1 正交试验因素水平表Table 1 Factors and levels in orthogonal array design
1.2.4 标准曲线的绘制 依据1.2.3确定的各最适条件,分别吸取0、0.50、1.00、1.50、2.00、2.50、3.00mL 1.0mg/mL氨基葡萄糖盐酸盐标准溶液于50mL容量瓶中,分别加入铁氰化钾和Na2CO3溶液,混匀,水浴加热后,以去离子水做空白,绘制标准曲线。
1.2.5 回收率实验 为考察方法的准确度,采用加标回收率法,向已知壳聚糖含量的壳寡糖水解液中加入不同量的标准品,分别测定其壳聚糖含量,并计算其回收率和相对标准偏差,以评价该比色方法的准确度和可靠性。
1.2.6 数据处理分析方法 采用北京普析UVWin5 V 5.1.0进行紫外扫描光谱图图绘制,采用Spss Statistics 17.0统计学软件和Excel软件对正交实验结果进行方差分析和极差分析。
2 结果与分析
2.1 比色条件的确定
2.1.1 标准品及波长的选择 Imoto法的原理是黄绿色铁氰酸离子在碱性条件下能被还原糖还原成微黄色的亚铁氰酸离子。若反应中铁氰化钾过量,还原糖含量与生成的亚铁氰化钾的浓度呈正比关系,与反应液的颜色成反比关系[11]。据文献报道,各种还原糖和铁氰化钾反应情况和最大吸收波长有所不同[18],选择合适的标准品和合适的最大吸收波长才能准确测量出壳聚糖的含量。
由图1可知,各标准品和壳寡糖水解液与铁氰化钾反应后在420~450nm范围内有一最大吸收峰。这是因为吸光度主要由残留的铁氰酸和生成的亚铁氰化钾产生,标准品和水解液发生反应后都是以这两种物质为主,但各种标准品最大吸收波长略有不同,这可能是因为各种标准品氧化后的产物有一定的吸光度,从而调高或降低了溶液的吸光度。各标准品中,氨基葡萄糖盐酸盐的最大吸收波长最大(438nm)、葡萄糖和氨基葡萄糖次之(435nm),乙酰氨基葡萄糖最大吸收波长最小(425nm)。氨基葡萄糖盐酸盐和壳寡糖水解液均在438nm处吸收最强,这可能是因为壳寡糖在盐酸作用下水解的产物以氨基葡萄糖盐酸盐为主,与氨基葡萄糖盐酸盐结构最为相似,因此选择以氨基葡萄糖盐酸盐为标准品,以438nm为最大吸收测定波长。
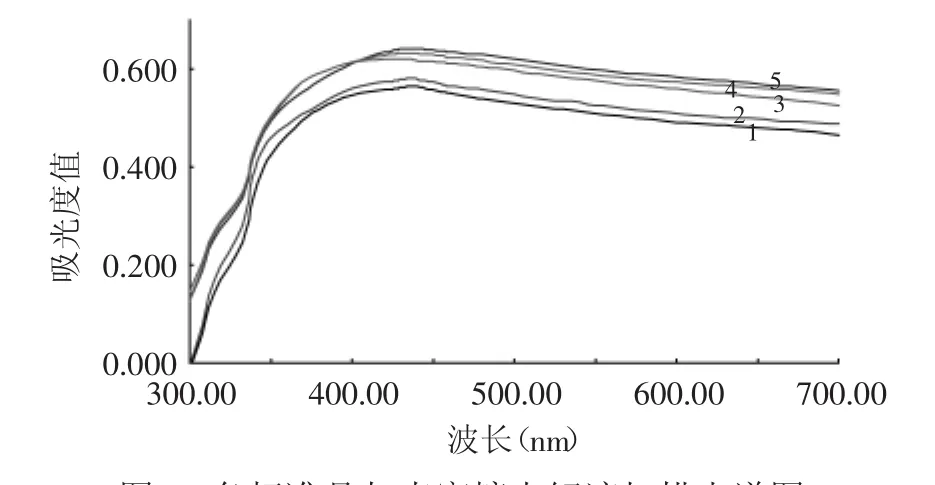
图1 各标准品与壳寡糖水解液扫描光谱图Fig.1 Scanning spectrums of 4 standard samples and hydrolysate
2.1.2 铁氰化钾溶液添加量的确定 通过添加0.0、1.0、2.0、3.0、4.0、5.0、6.0mL铁氰化钾溶液,分别考察对吸光度的影响,结果见图2。
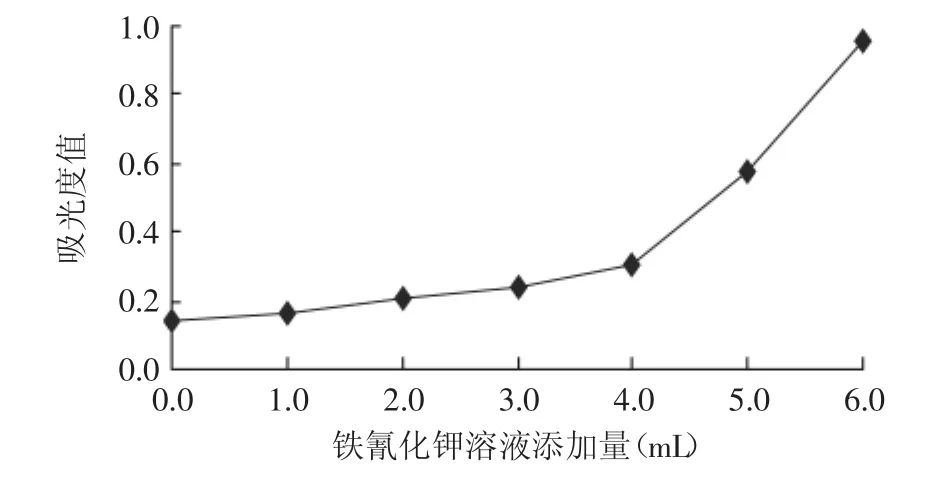
图2 铁氰化钾溶液添加量对吸光度的影响Fig.2 Effect of addition of potassium ferricyanide reagent on absorbency
由图2可知,随着铁氰化钾溶液添加量的增加,溶液的吸光度值先缓慢增加,而当溶液增加到4.0mL后,吸光度值呈线性增加趋势。这主要是因为少量的铁氰化钾加入后立即与溶液中的氨基葡萄糖盐酸盐反应生成吸光度值较小的亚铁氰化钾和几乎没有吸光度值的氨基葡萄糖酸,而颜色较深吸光度值较大的铁氰化钾几乎没有残留,因此吸光度值增加很小;随着铁氰化钾添加量的不断增加,溶液中几乎所有的氨基葡萄糖盐酸盐都转变为氨基葡萄糖酸,且加入的铁氰化钾不与任何物质发生反应,此时溶液的吸光度随着铁氰化钾的浓度增加而线性增加。但从反应灵敏度和经济节约两方面考虑,铁氰化钾溶液添加量以4.0mL较好。
2.1.3 Na2CO3溶液添加量的确定 由图3可知,吸光度值随着Na2CO3溶液添加量的增加先缓慢降低后迅速降低,当达到最低点后又略有增加。这主要是因为铁氰化钾与氨基葡萄糖盐酸盐发生反应需在碱性条件下才能顺利进行,只添加铁氰化钾,不添加Na2CO3溶液基本不会发生反应,因此不添加Na2CO3时,溶液的颜色较深,吸光度值很大;随着Na2CO3溶液添加量不断增大,溶液pH逐渐增加,形成的碱性环境越来越适合铁氰化钾与氨基葡萄糖盐酸盐发生氧化还原反应,溶液颜色褪去速度增加,吸光度值降低加快;但Na2CO3溶液添加量超过4.0mL时,溶液的pH过大,不适合氧化还原反应,溶液颜色褪去较少。因此选择Na2CO3溶液添加量为4.0mL较好。

图3 Na2CO3溶液添加量对吸光度的影响Fig.3 Effect of addition of Na2CO3reagent on absorbency
2.1.4 水浴加热时间的确定 铁氰化钾与氨基葡萄糖盐酸盐发生氧化还原反应需要一个过程。实验发现,加入铁氰化钾和Na2CO3后进行加热,溶液颜色开始缓慢变淡,并随加热时间增加而逐渐褪色。
由图4可知,在80min内吸光度值基本以线性速度递减,褪色反应迅速,反应液颜色逐渐变浅,这反映了铁氰化钾和氨基葡萄糖盐酸盐较容易发生化学反应,而80min后吸光度值基本保持不变,表明褪色反应基本完全。因此,选定水浴加热时间为80min。
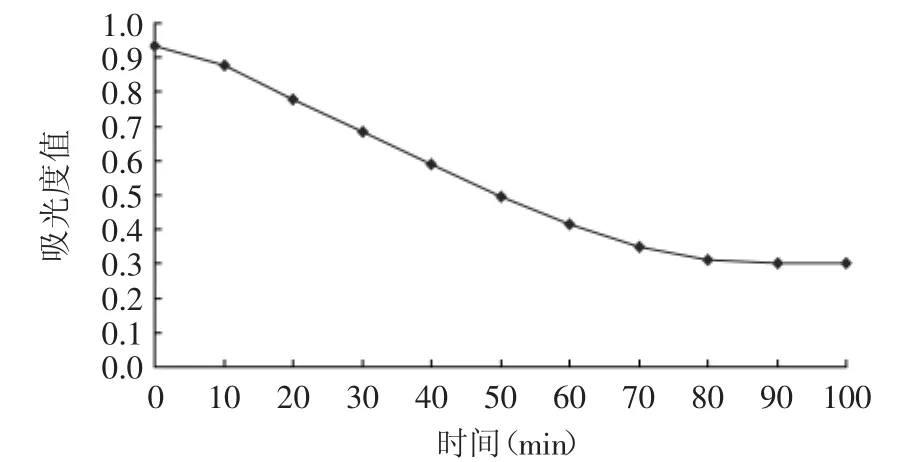
图4 加热时间对吸光度的影响Fig.4 Effect of bath time on absorbency
2.1.5 水浴加热温度的确定 温度对显色反应有很大影响,温度过低不利于氧化还原反应的进行。由图5可知,当水浴温度在60~70℃时,分子能量和运动速度较慢,溶液褪色速度缓慢,吸光度值变化较小。随着温度升高,反应速度加快,吸光度值逐渐变小,至90℃时达到最小值,而后当温度继续升高时,吸光度值略有增加。这可能是因为长时间的高温加热导致水蒸气增加,溶液浓缩后,颜色亦会有所增加。因此为节省能源,提高实验准确度,确定水浴加热温度为90℃。
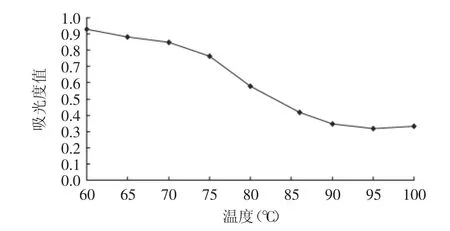
图5 水浴加热温度对吸光度的影响Fig.5 Effect of bath temperature on absorbency
2.1.6 最佳比色条件的确定 在单因素实验的基础上,选择铁氰化钾添加量、Na2CO3添加量、水浴加热时间、水浴加热温度为考察因素,进行L9(34)正交实验,采用Excel 2007对两次平行实验结果的均值进行极差分析,结果见表2。利用Spss Statistics 17.0统计学软件对正交实验两次结果及平均值进行方差分析,方差分析结果见表3。
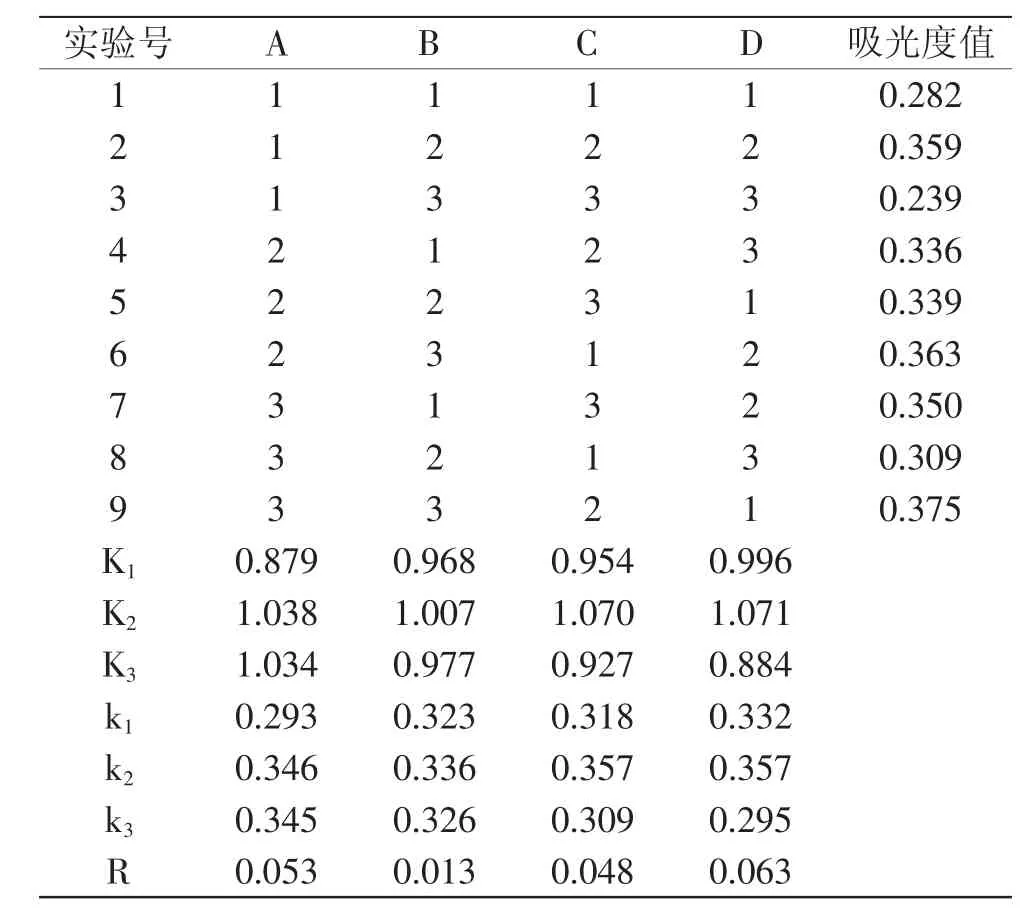
表2 正交实验结果与极差分析Table 2 Orthogonal test results and range analysis
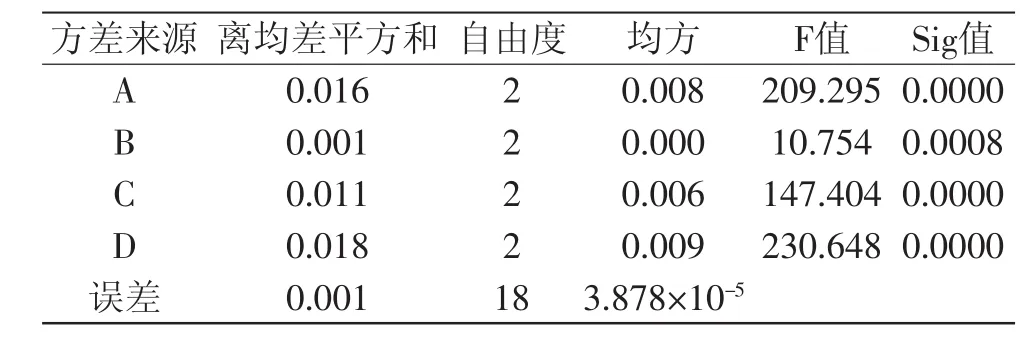
表3 正交实验结果方差分析Table 3 Analysis of variance of orthogonal test
由表2正交实验结果中R值可以看出,各因素的影响次序为:D>A>C>B,即加热温度对吸光度的影响最大,铁氰化钾添加量次之,Na2CO3添加量对吸光度的影响最小。本实验的最佳组合为A1B1C3D3,即最佳比色条件为:10g/L铁氰化钾溶液3.5mL、0.5mol/L Na2CO3溶液3.5mL、水浴加热时间85min、水浴加热温度95℃。
由方差分析结果(表3)可知,误差项的均方值仅为3.878×10-5,不足均方总和的万分之一,且四因素对应的Sig值均小于0.01,这说明误差对吸光度的影响非常小,正交实验因素选择正确。表3中四因素对应的F值大小顺序为FD>FA>FC>FB,说明四因素对吸光度的影响次序依次为D>A>C>B,与正交实验极差分析结果相一致。
2.1.7 验证实验 A1B1C3D3的比色条件不在正交实验表中,因此按此比色条件做3次平行实验进行验证,结果分别为0.223、0.225、0.222,三数值及平均值(0.223)均小于正交实验最小值且稳定,即在该条件下,溶液颜色变化最大,为比色的最优条件。
2.2 标准曲线的绘制
根据最佳比色条件,测定不同浓度氨基葡萄糖盐酸盐标准品与铁氰化钾反应后的吸光度值,并绘制标准曲线(见图6)。
结果表明,在0~60μg/mL范围内,其线性回归方程为y=-0.0137x+0.9288,相关系数R2=0.9990,结果符合朗伯比尔定律,表明线性关系良好。
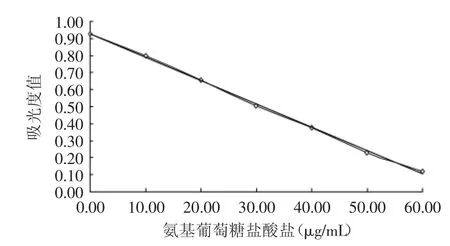
图6 氨基葡萄糖盐酸盐标准曲线Fig.6 Standard curve of glucosamine hydrochloride
2.3 壳寡糖水解液中壳寡糖含量的测定
取壳寡糖水解液进行比色测定(n=7),实验测得壳寡糖水解液中壳寡糖的平均含量为39.77μg/mL,RSD值为2.15%,表明该测定方法精密度较高,重复性好,能满足实验样品分析的需要。
3 结论
以氨基葡萄糖盐酸盐为标准对照品,采用Imoto比色法测定了壳寡糖水解液中壳寡糖的含量,实验结果表明,氨基葡萄糖盐酸盐的最大吸收波长为438nm,且在0~60μg/mL范围内有良好线性关系;最佳比色条件为:10g/L铁氰化钾溶液3.5mL、0.5mol/L Na2CO3溶液3.5mL、水浴加热时间85min、水浴加热温度95℃。
采用Imoto比色法测得壳寡糖水解液中壳寡糖的含量为39.77μg/mL,RSD值为2.15%,表明该方法具有操作简便、重现性好、回收率较高等优点。
[1]韩永萍,林强.壳聚糖降解制备低聚壳聚糖和壳寡糖的研究进展[J].食品科技,2006(7):35-38.
[2]Kurita K.Chitin and chitosan:functional biopolymers from marine crustaceans[J].Mar Biotechnol,2006,8(3):203-226.
[3]Kim S,Rajapakse N.Enzymatic production and biological activities ofchitosan oligosaccharides(COS):A review[J].Carbohydrate Polymers,2005,62(4):357-368.
[4]孙婷.纤维素酶降解壳聚糖的研究[D].无锡:江南大学,2009.
[5]刘琳,张杰,曾凡骏.过氧化氢法制备特定聚合度壳寡糖的工艺研究[J].食品科技,2011,36(3):88-91.
[6]蔡圣宝,邢荣娥,刘松,等.两种方法制备壳寡糖平均分子质量与氨基含量分析[J].海洋科学,2009,33(5):70-73.
[7]乔莹,白雪芳,杜昱光.壳寡糖医药保健功能的研究进展[J].中国生化药物杂志,2008,29(3):210-213.
[8]魏新林,夏文水.甲壳低聚糖的生理活性研究进展[J].中国药理学通报,2003,19(6):614-617.
[9]李辉,贾宏新,卢桂华.分光光度法测定壳聚糖含量的方法研究[J].中国公共卫生,2002,18(10):1248-1249.
[10]Elson L A,Morgan W T J.A colorimetric method for the determination of glucosamine and chondrosamine[J].Biochemical Journal,1933,27(6):1824-1828.
[11]Imoto T,Yagishita K.A simple activity measurement of lysozyme[J].Agricultural and Biological Chemistry,1971,35(7),1154-1156.
[12]刘靖.纤维素酶水解壳聚糖的特性及机理研究[D].无锡:江南大学,2006.
[13]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999:11.
[14]Miller G L.Use of dinitrosalicylic acid reagentfor determination of reducing sugar[J].Analytical Chemistry,1959,31(3):426-428.
[15]李克成,李鹏程,邢荣娥,等.壳寡糖含量的测定方法比较[J].药物分析杂志,2011,31(8):1530-1532.
[16]李雪梅,孟庆军,杨俊慧,等.电化学法测定马铃薯全粉中还原糖的含量[J].食品工业科技,2008,29(11):257-259.
[17]张华珺,陈敏.氨基葡萄糖荧光光度分析法的研究[J].食品研究与开发,2009,30(2):100-104.
[18]苏畅,夏文水,姚惠源.氨基葡萄糖和乙酰氨基葡萄糖的测定方法[J].食品工业科技,2003(6):74-76.
Study on determination of total chitooligosaccharides by Imoto olorimetry
TAN Pei-yi,HUANG Xiu-jin
(Jiangsu Food Science College,Huai’an 223003,China)
A quantitative method for the determination of the total content of chitooligosaccharides was studied by Imoto colorimetry.The method was improved and verified in the aspects of standard sample,wavelength,reagent,colorimetric conditions.The result showed that the chitooligosaccharides content could be well calculated according to their absorption at 438nm by applying 10g/L potassium ferricyanide reagent 3.5mL and 0.5mol/L Na2CO33.5mL at 95℃ for 85min.The linear range of standard curve was 0~60μg/mL with glucosamine hydrochloride as standard.The content of chitooligosaccharides of hydrolysate by the method was 39.77μg/mL(RSD=2.15%).
chitooligosaccharides;Imoto colorimetry;glucosamine hydrochloride
TS254.9
A
1002-0306(2012)22-0071-05
2012-05-10
谭佩毅(1967-),男,硕士,副教授,主要从事应用化学研究。
