应用EST-ILPs分子标记技术快速鉴定菟丝子属种子
2012-09-28郭琼霞黄可辉
郭琼霞, 庄 蓉,2, 黄 振, 黄可辉,2*
(1.福建出入境检验检疫局,福州 350001;2.福建农林大学植物保护学院,福州 350002)
近年来,分子标记已广泛应用于遗传图谱构建、基因克隆、基因定位、遗传多样性分析、基因组比较、标记辅助育种等方面的研究[1-3]。由于EST来源于编码区,内含子位置通常较为保守;而不同种或地理亚种间的内含子长度又存在差异,故用它建立的ILPs分子标记在种间鉴定上具有优越性。采用ILPs(intron length polymorphisms)分子标记在菟丝子属的分类鉴定上国内外均未见报道。因此本研究利用旋花科(Convolvulaceae)番薯属(Ipomoea)的EST(expressed sequence tags,Tags,表达序列标签)序列,通过网站(http:∥ibi.zju.edu.cn/pgl/pip/index.html)查找内含子和外显子,然后根据网站自动设计的引物,再对9个菟丝子的样品进行引物的筛选,寻找种间特异性条带从而达到分类鉴定的目的。
1 材料与方法
1.1 供试材料
本试验选用菟丝子属(Cuscuta)5个近似种(含不同的地理型)的种子作为研究材料。各个种的种子材料来源详见表1。

表1 材料来源
1.2 总DNA的提取与凝胶电泳检测
1.2.1 菟丝子总DNA的提取
选取菟丝子的种子为材料,采用SDS法提取总 DNA[4]。
1.2.2 凝胶电泳检测
采用高必达等[5]设计的一对能检测ITS序列的特异 性 引 物:A1(5′-TCGTAACAAGGTTTCCGTAG-3′)与 A2(5′-AGGAGGCCAGGATCTATT-3′)进行PCR扩增。扩增体系为:25μL(10×PCR buffer,25mmol/L MgCl2,10mmol/L dNTP,5 U/μL Taq DNA 聚合酶,10μmol/L 引物,模板DNA约为100ng/μL)。反应程序为:94℃5min;94℃1min,55℃1min,72℃1min,35个循环;72℃7min。扩增产物经1.5%琼脂糖电泳分离,检测400~500bp左右的扩增片段。从而根据电泳图上此扩增片段的有无判断是否提取出DNA。
1.3 ILPs标记的获得和ILPs-PCR
ILPs标记是由浙江大学汪旭升、赵向前等根据已公布全基因组序列开发的一种内含子长度多态性标记[6]。从网站(http:∥ibi.zju.edu.cn/pgl/pip/index.html)上公布的ILPs标记中选择引物。选取旋花科番薯属已经设计好的引物10对(如表2所示),对菟丝子样品进行PCR扩增,进而选择特异性片段。
ILPs-PCR反应体系总体积为20μL,其中含100ng模 板 DNA;上、下 游 引 物 各 0.5μmol/L;200μmol/L dNTP;1.5mmoL/L MgCl2;1UTaq DNA聚合酶;2μL 10×PCR反应缓冲液。PCR扩增程序:94℃ 5min;94 ℃ 46s,52.5 ℃ 45s,72 ℃1min,35个循环;72℃10min。扩增产物经1.5%琼脂糖电泳分离。对于扩增产物非特异性条带多的引物进一步优化起始退火温度,调整范围为50~58℃。每对引物组合至少重复2次以确保扩增结果的可靠性。扩增产物上样于6%的非变性聚丙烯酰胺凝胶,320V电泳1h45min。参照许绍斌等[7]的方法进行银染。

表2 试验所用的引物
2 结果与分析
2.1 DNA凝胶电泳的检测
试验结果表明,采用SDS法提取菟丝子属5个近似种(含不同的地理型)种子的总DNA,经过凝胶电泳,其显示在400~500bp得到一条明亮的特异条带(如图1所示)。从而证明所提取的菟丝子种子DNA有效,最后将已提取的DNA保存于-20℃备用。

图1 利用引物A1和A2的rDNA-ITS PCR扩增图谱
2.2 聚丙烯酰胺凝胶电泳检测
因为退火温度是影响PCR扩增结果的重要因素,所以对试验条件进行调整与优化,经试验得出结果:退火温度为52.5℃可获得满意的分型效果。因此设定PCR扩增程序为:94℃5min;94℃46s,52.5℃45s,72℃1min,35个循环;72℃10min;于4℃保存。
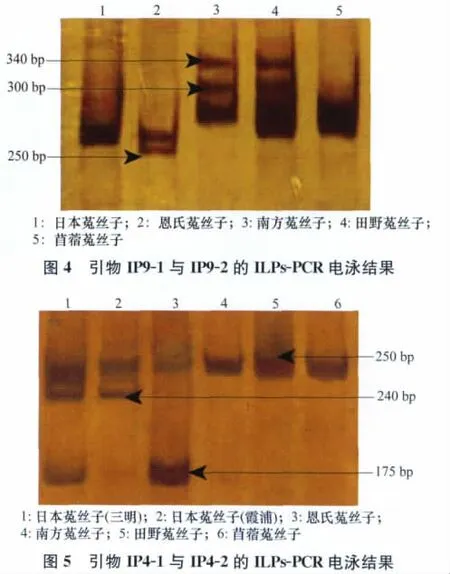
根据引物IP9-1和IP9-2的聚丙烯酰胺凝胶电泳所检测的结果(如图2)所示,不同种的菟丝子呈现多态性的带型。

图2 IP9-1和IP9-2引物在材料1~9中的扩增产物(6%非变性聚丙烯酰胺凝胶电泳)
利用引物IP9-1和IP9-2扩增的试验结果显示:菟丝子属5个近似种(含不同的地理型)9个种子样品之间的内含子长度表现为5种基因型AB、A、ABC、BD、ABD。三明日本菟丝子与苜蓿菟丝子内含子长度的基因型均为AB;霞浦日本菟丝子内含子长度基因型为A;恩氏菟丝子内含子长度的基因型为ABC;南方菟丝子内含子长度基因型为BD;福州马尾、霞浦、福州鼓楼、新疆这4个地理型的田野菟丝子内含子长度的基因型都是ABD。从图2可以看出恩氏菟丝子在250bp左右具有一条特异性条带,使其可以与其他的菟丝子区分开。南方菟丝子与田野菟丝子在内含子长度的基因型上也具有差异;因此可以通过内含子基因型的条带多态性将田野菟丝子与南方菟丝子区分开。
用引物IP4-1和IP4-2扩增的结果(如图3)显示,菟丝子属9个样品之间的内含子表现为4种基因型EFG、EF、EG、E。三明日本菟丝子内含子长度的基因型为EFG;霞浦日本菟丝子内含子长度基因型为EF;恩氏菟丝子内含子长度基因型为EG;南方菟丝子、田野菟丝子、苜蓿菟丝子扩增结果相同,基因型均为E。从图3可以得出以下结果:两种地理型的日本菟丝子在240bp左右具有一条特征条带,使其可以与其他种的菟丝子区分开;苜蓿菟丝子与日本菟丝子在内含子基因型上具有差异,可以通过条带多态性将两者区分开。从图3还可以看出,不同地理型的日本菟丝子在基因型上也有所不同,三明日本菟丝子在175bp处有一条带,但是霞浦日本菟丝子在175bp处却没有此条带。
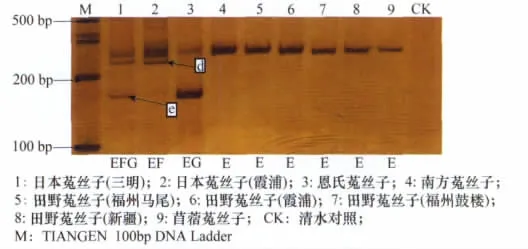
图3 IP4-1和IP4-2引物在材料1~9中的扩增产物(6%非变性聚丙烯酰胺凝胶电泳)
通过图4、图5电泳结果的多态性综合分析可以将本试验所选取的菟丝子5个近似种逐一鉴别开。
2.3 聚类分析以及分子系统树
根据选择的10对引物(如表2)扩增出的稳定条带,利用平均连锁聚类方式(UPGMA)软件进行聚类分析,生成9个供试材料的亲缘关系树状图(如图6)。
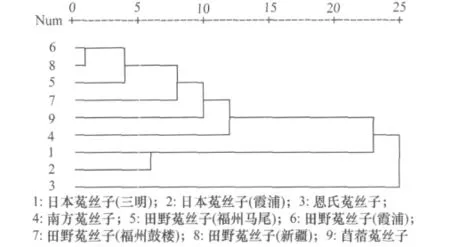
图6 根据菟丝子近似种的ILPs分子标记构建的种间亲缘关系图
从图6可以看出:田野菟丝子、苜蓿菟丝子、南方菟丝子的亲缘关系比较接近;这3种与日本菟丝子、恩氏菟丝子之间的亲缘关系较远。
3 讨论
本研究对菟丝子的5个近似种的内含子长度多态性进行了ILPs-PCR分析。从本试验结果看出,a条带可作为恩氏菟丝子的特异性条带(如图2示);d条带可作为日本菟丝子特异性条带(如图3示)。利用ILPs分子标记检测菟丝子近似种是菟丝子种间鉴定的新途径。随着ILPs分子标记检测的深入研究与发展,该技术将为我国口岸杂草检疫鉴定提供一种快速、准确的检测方法,同时也为杂草检疫科学理论的发展奠定良好的基础。
通过本研究结果可知,不同地理型的日本菟丝子在内含子多态性的基因型上具有差异。因此可对不同地理区域的同种菟丝子进行进一步的比较研究,从而完善菟丝子分类鉴定的依据。还可以进一步从网站(http:∥ibi.zju.edu.cn/pgl/pip/index.html)上公布的ILPs标记中选择引物进行筛选,进而选择菟丝子种间特异性片段,完善并实现菟丝子种间的快速检验检测。
[1] 吴海滨,朱汝财,李迪.一个内含子长度多态性标记与栽培稻F1花粉育性基因座连锁[J].分子植物育种,2006,4(3):323-328.
[2] 曾华宗,郑成木,朱稳,等.甘蔗种质间亲缘关系及特异标记的RAPD分析[J].植物遗传资源学报,2003,4(2):99-100.
[3] 卢泳全,汪旭升,黄伟素,等.基于水稻内含子长度多态性开发禾本科扩增共有序列遗传标记[J].中国农业科学,2006,39(3):433-439.
[4] 王得元,邓义才,李乃坚.RAPD标记检测蔬菜种子纯度中DNA提取方法研究[J].广东农业科学,1999(3):13-14.
[5] 高必达,程毅,朱水芳,等.基于ITS序列的菟丝子PCR鉴定[J].湖南农业大学学报(自然科学版),2006,32(4):368-370.
[6] 汪旭升,赵向前,卢泳全,等.一种新型的分子标记:内含子长度多态性[C]∥2005植物分子育种国际学术研讨会论文集,2005.
[7] 许绍斌,陶玉芬,杨昭庆,等.简单快速的DNA银染和胶保存方法[J].遗传,2002,24(3):335-336.
