葫芦素B对肝癌细胞内阿霉素浓度的影响
2012-08-28周雪莹朱晓琳牛哲峰张玉玺李士峰张美侠
杨 姣,周雪莹,历 文,朱晓琳,牛哲峰,张玉玺,李士峰,张美侠*
原发性肝癌是严重危害人类健康的重大疾病,是临床常见的消化系统恶性肿瘤之一[1],其治疗仍然主要依赖于全身化疗和相关治疗如介入栓塞化疗等。肝癌对化疗药物的敏感性较差,不论是单药还是多药联合化疗,其有效率均为10% ~20%。阿霉素(Doxorubicin,Dox)是临床治疗肝癌的常用药物,但其反应率仅为15% ~20%。影响其疗效的主要原因是肿瘤细胞产生多药耐药(Multi-drug resistance,MDR),使细胞内抗癌药物积聚程度降低。
葫芦素类(Cucurbitacins)成分是从植物中提取的一类高度氧化的四环三萜类化合物,主要成分为葫芦素B、E、I等,具有抗肿瘤、抗炎、提高机体免疫力等多种生物活性[2-3]。Sadzuka 等[4-5]报道,葫芦素E通过促进阿霉素的细胞内泵入和降低其外排而提高阿霉素在肿瘤细胞中的浓度。因此,笔者推测,葫芦素B可能通过相同的机制提高肝癌细胞内阿霉素的浓度,进而提高阿霉素的抗肿瘤效果。本研究以人源性肝癌细胞HepG2和鼠源性肝癌细胞H22为对象,利用反相高效液相-荧光测定法测定肿瘤细胞内阿霉素浓度,用于HepG2和H22细胞内阿霉素浓度的动态研究。
1 材料与方法
1.1 主要试剂和仪器 注射用盐酸表阿霉素(浙江海正药业股份有限公司),葫芦素B、阿霉素(沈阳药科大学提供)。甲醇色谱纯(天津四友生物医学技术有限公司),醋酸分析纯(天津四友生物医学技术有限公司)。高效液相色谱仪(Waters Model 1525,美国),包括在线真空脱气机、高压二元梯度泵、自动进样器、柱温箱,Agilent 1100色谱工作站;荧光检测器(Waters 2475,美国);色谱柱(150 ~4.6 mm,C18,Sunfine,Waters,美国)。
1.2 色谱条件 色谱柱:Waters Sunfine C18柱,4.6 mm ×150 mm,5 μm;流动相:甲醇-0.01% 醋酸(40∶60,V/V);流速:1.0 mL/min;柱温:30 ℃;荧光检测激发波长:495 nm,发射波长:560 nm;进样量:10 μL。
1.3 标准储备液的制备 准确称取盐酸阿霉素适量,加水溶解,定容于容量瓶,配制成浓度为5 μg/mL的阿霉素标准储备液,4℃保存。
1.4 HepG2细胞样品的制备
1.4.1 HepG2流入细胞阿霉素样品的预处理取对数生长期HepG2细胞,按每孔5×106个/mL接种于6孔板培养,过夜贴壁后,弃上清,每孔加1 mL不含胎牛血清的RPMI-1640培养液。将细胞分为3组,第1组(Dox组)加阿霉素(5 μg/mL);第2组(Dox+CuB 1 μM 组)先加葫芦素B 1 μM,30 min后加入阿霉素(5 μg/mL);第3组(Dox+CuB 10 μM 组)先加葫芦素 B 10 μM,30 min 后加入阿霉素(5 μg/mL)。于37℃、饱和湿度、5%CO2培养箱中分别培养 0、30、60、120、180、240 min。弃上清,加0.25%胰酶消化,用含10%血清的RPMI-1640培养液终止消化。2 000 r/min离心5 min,弃上清,加入表阿霉素(5 μg/mL)做内标,再加入1 mL含0.3 mol/L盐酸的50%乙醇萃取,充分混匀后,涡旋2 min,超声波震荡10 min。将样品放置37℃、饱和湿度、5%CO2的培养箱中孵育 18 h,最后 10 000 r/min离心 10 min,取10 μL上清液进样测定。
1.4.2 HepG2细胞阿霉素泵出样品的预处理取对数生长期HepG2细胞,接种于贴壁培养瓶中培养。贴壁后弃上清,加入阿霉素(5 μg/mL),在37℃、饱和湿度、5% CO2的培养箱中培养30 min。弃上清,加PBS洗3遍,加0.25%胰酶消化,用含10%血清的RPMI-1640培养液终止消化。2 000 r/min离心5 min,弃上清,用不含血清的RPMI-1640培养液混匀。分成3组,第1组不加任何药品;第2组加入葫芦素B 1 μM,第3组加入葫芦素B 10 μM。将样品放入37℃、饱和湿度、5%CO2培养箱分别培养 0、30、60、90、120 min。收集细胞,2 000 r/min离心5 min,弃上清,加入表阿霉素(5 μg/mL)做内标,加入1 mL含0.3 mol/L盐酸的50%乙醇萃取,充分混匀后,涡旋2 min,超声波震荡10 min。将样品放置37℃、饱和湿度、5%CO2的培养箱中孵育18 h,最后10 000 r/min离心10 min,取10 μL上清液进样测定。
1.5 H22细胞样品的制备 取H22悬浮细胞(1×107个/mL),加PBS洗3遍,加入不含胎牛血清的RPMI-1640培养液。其余同HepG2细胞。
1.6 统计方法 SPSS 16.0软件进行单因素方差分析、LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 标准曲线的绘制 取阿霉素标准液适量,配制浓 度 分 别 为 0.1、0.2、0.4、0.8、1.6、3.2、6.4 μg/mL的 HepG2 细胞液样品,取 10 μL 进行HPLC分析,以待测物阿霉素浓度为横坐标,待测物与内标物表阿霉素的峰面积比值为纵坐标,用加权(W=1/x2)最小二乘法进行回归运算,求得直线回归方程,即为标准曲线。结果表明,HepG2细胞液样品中阿霉素在0.1~6.4 μg/mL范围内呈良好线性关系,标准曲线:Y=1.649 2 X+0.221(R2=0.993 4)。同法显示,H22细胞液样品中,阿霉素在0.625~20 μg/mL范围内呈良好线性关系,标准曲线:Y=0.13 X+0.067 4(R2=0.996)。
2.2 专属性实验 分别取空白HepG2细胞和H22细胞,不加任何药物,其余按其样品预处理项下流入细胞样品预处理操作。将一定浓度的阿霉素标准溶液和内标溶液加入空白HepG2细胞和H22细胞中,依“1.4.1”项下和“H22细胞阿霉素流入样品的预处理”项下方法操作。结果表明,空白HepG2细胞和H22细胞中的内源性物质不干扰阿霉素和内标的测定,表明专属性良好。
2.3 精密度实验 取阿霉素标准液适量,按“2.1”项操作,制备低、中、高(浓度为 0.25、1.00、4.00 μg/mL)3个浓度细胞液样品,每个浓度5个样本,按日内和日间精密度测定要求分别进行测定。计算日内及日间精密度,结果显示,HepG2细胞液日内精密度RSD分别为2.952%、0.883%、0.982%(n=5),日间精密度 RSD分别为1.256%、1.826%、3.589%(n=5),表明精密度良好。H22细胞日内精密度RSD分别为2.418%、2.797%、2.459%(n=5),日间精密度RSD分别为1.826%、3.589%、2.759%(n=5),表明精密度良好。
2.4 稳定性实验 取阿霉素标准液适量,按“2.1”项下操作,制备浓度4.00 μg/mL的细胞液样品,在 0、1、5、10、18、24、36、48 h 测定,结果HepG2细胞液RSD=3.13%(n=8),表明在测定时间内溶液稳定性良好。H22细胞RSD=3.45%(n=8),表明在测定的时间内溶液稳定性良好。
2.5 回收率实验 取空白HepG2和H22细胞液适量,按其“1.4”项下方法,取阿霉素标准液适量,加入制得的上清液中,制备低、中、高(0.25、1.00、4.00 μg/mL)3个浓度的细胞液样品,涡流混合,取10 μL进行HPLC分析,按照标准曲线计算提取回收率,HepG2细胞液平均回收率为107.4%,表明回收率良好(见表1);同法测得H22细胞液平均回收率为105.93%,表明回收率良好(见表2)。
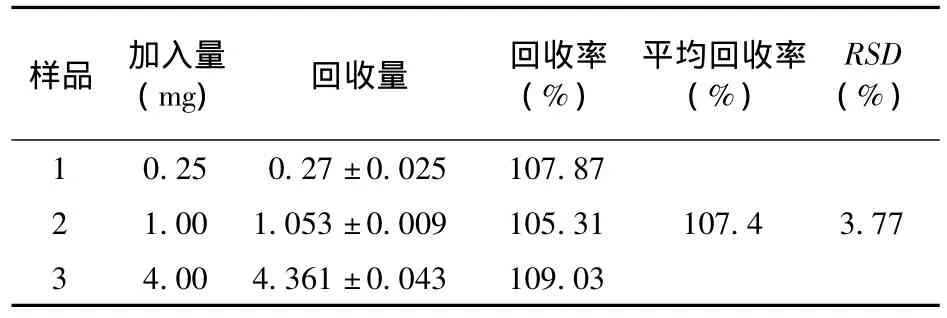
表1 HPLC法测定HepG2细胞液回收率(n=5)

表2 HPLC法测定H22细胞液回收率(n=5)
2.6 葫芦素B对阿霉素在肝癌细胞中浓度的影响 由于阿霉素能自发荧光,而葫芦素B不能自发荧光,所以用荧光检测器测得的图谱为阿霉素和内标物质表阿霉素的色谱图。以时间为横坐标、阿霉素和表阿霉素的峰面积比值为纵坐标,做线性回归图,并分析葫芦素B对肝癌细胞中阿霉素浓度的影响。
2.6.1 葫芦素B对阿霉素在HepG2细胞内流入的影响 阿霉素与葫芦素B联合应用后在细胞内的浓度升高,呈时间、浓度依赖性。在240 min时间点,Dox+CuB 10 μM组与 Dox组比较,差异有统计学意义(P<0.05),见图1。

图1 葫芦素B对阿霉素在HepG2细胞内流入的影响
2.6.2 葫芦素B对阿霉素在HepG2细胞内泵出的影响 阿霉素与葫芦素B联合应用后,从细胞内泵出的药量减少。Dox+CuB 1 μM组在120 min时间点、Dox+CuB 10 μM 组在90 min及120 min时间点与Dox组之间比较,差异均有统计学意义(P <0.05),见图2。
2.6.3 葫芦素B对阿霉素在H22细胞内流入的影响 阿霉素与葫芦素B联合应用后在细胞内浓度增加,且呈时间和浓度依赖性。Dox+CuB 1 μM组、Dox+CuB 1 μM 组与 Dox 组在60、120、180 min和/或240 min时间点比较,差异有统计学意义(P<0.05或 P<0.01),见图3。

图2 葫芦素B对阿霉素在HepG2细胞内泵出的影响

图3 葫芦素B对阿霉素在H22细胞内流入的影响
2.6.4 葫芦素B对阿霉素在H22细胞内泵出的影响 阿霉素与葫芦素B联合应用后,从细胞内泵出的药量减少。Dox+CuB 10 μM组与Dox组在90 min与120 min时间点比较,差异有统计学意义(P <0.05),见图4。

图4 葫芦素B对阿霉素在H22细胞内泵出的影响
3 讨论
近年来,肿瘤增殖抑制作用逐步成为一个研究热点。葫芦素B可以抑制多种肿瘤细胞如乳腺癌、鼻咽癌、喉癌、口腔鳞癌、肺癌、宫颈癌、肝癌、结肠癌、恶性黑色素瘤和中枢神经系统肿瘤等的增殖[6-12]。肿瘤细胞MDR原因之一是肿瘤细胞过表达ABC转运蛋白,如P-gp、多药耐药相关蛋白(MRP)、乳腺癌耐药蛋白(BCRP)和肺癌耐药蛋白(LRP)等[13]。P-gp等能将细胞内的药物“泵”出细胞外,这与天然来源和疏水性药物(如阿霉素)耐药有关。本研究结果表明,葫芦素B与阿霉素联合应用,明显抑制人肝癌细胞系HepG2和鼠源性肝癌细胞系H22生长。葫芦素B可以浓度、时间依赖性地促进阿霉素在肝癌细胞HepG2及H22中的内流,抑制阿霉素从细胞内外排。因此,提高阿霉素在肝癌细胞中的浓度,可增强其抗肿瘤活性。
抗癌药物的作用机制错综复杂,葫芦素B与阿霉素共同抑制肝癌的详细机制(如:葫芦素B是否抑制P-gp的过度表达),还有待进一步深入研究。本文方法简便、准确,检测限低,线性范围宽,可分析测定肿瘤细胞内阿霉素浓度,并可拓展用于研究化疗药物在肿瘤细胞内外动态变化规律,探索肿瘤细胞MDR机制,进而用于寻找发现肿瘤细胞MDR逆转药物。
:
[1]Yang JD,Roberts LR.Hepatocellular carcinoma:A global view[J].Nat Rev Gastroenterol Hepatol,2010,7(8):448-458.
[2]Lee DH,Iwanski GB,Thoennissen NH.Cucurbitacin:ancient compound shedding new light on cancer treatment[J].Scientific World Journal,2010,5(10):413-418.
[3]Lee DH,Thoennissen NH,Goff C,et al.Synergistic effect of low-dose cucurbitacin B and low-dose methotrexate for treatment of human osteosarcoma[J].Cancer Lett,2011,306(2):161-170.
[4]Sadzuka Y,Hatakeyama H,Sonobe T.Enhancement of doxorubicin concentration in the M5076 ovarian sarcoma cells by cucurbitacin E co-treatment[J].Int J Pharm,2009,383:186-191.
[5]Sadzuka Y,Hatakeyama H,Daimon T,et al.Screening of biochemical modulator by tumor cell permeability of doxorubicin[J].International Journal of Pharmaceutics,2008,354:63-69.
[6]Zhang Y,Ouyang D,Xu L,et al.Cucurbitacin B induces rapid depletion of the G-actin pool through reactive oxygen speciesdependent actin aggregation in melanoma cells[J].Acta Biochim Biophys Sin,2011,43(7):556-567.
[7]Chen W,Leiter A,Yin D,et al.Cucurbitacin B inhibits growth,arrests the cell cycle,and potentiates antiproliferative efficacy of cisplatin in cutaneous squamous cell carcinoma cell lines[J].Int J Oncol,2010,37:737-743.
[8]Yasuda S,Yogosawa S,Izutani Y,et al.Cucurbitacin B induces G2 arrest and apoptosis via a reactive oxygen species-dependent mechanism in human colon adenocarcinoma SW480 cells[J].Mol Nutr Food Res,2010,54:559-565.
[9]Chan KT,Li K,Liu SL,et al.Cucurbitacin B inhibits STAT3 and the Raf/MEK/ERK pathway in leukemia cell line K562[J].Cancer Lett,2010,289:46-52.
[10]Zhang M,Zhang H,Sun C,et al.Targeted constitutive activation of signal transducer and activator of transcription 3 in human hepatocellular carcinoma cells by cucurbitacin B[J].Cancer Chemoth and Pharm,2009,63:635-642.
[11]Wakimoto N,Yin D,O'Kelly J,et al.Cucurbitacin B has a potent antiproliferative effect on breast cancer cells in vitro and in vivo[J].Cancer Sci,2008,99:1793-1797.
[12]Yin D,Wakimoto N,Xing H,et al.Cucurbitacin B markedly inhibits growth and rapidly affects the cytoskeleton in glioblastoma multiforme[J].Int J Cancer,2008,123:1364-1375.
[13]Bao Zhai ZS,Chun Zhao,Kai Hu,et al.Development and characterization of multidrug resistant.human hepatocarcinoma cell line in nude mice[J].World J Gastroenterol,2006,12(41):6614-6619.
