农杆菌介导的苜蓿次级体细胞胚的遗传转化
2012-02-09刘文婷段琦梅刘景玲孙延芳
刘文婷,段琦梅,刘景玲,孙延芳
1 西北农林科技大学生命科学学院,陕西 杨凌 712100
2 辽宁工程技术大学理学院,辽宁 阜新 123000
苜蓿Medicago sativa L. 是世界上分布最广泛的一种豆科多年生牧草,素有“牧草之王”的美誉,是目前国内外最重要的豆科牧草[1]。苜蓿在土壤保持和固氮方面也有重要的作用[2]。在过去几年中,许多研究已经探讨了使用农杆菌的苜蓿遗传转化[3-9]。但是,转化方法仍有很大的局限性,比如转化效率低、基因型依赖性、转化程序复杂和转化时间长、玻璃化植株比例高[3,5-7,9-11]。因此,优化转化方法有助于苜蓿转基因的广泛应用。
先前的研究已经探索了不同类型外植体能提供苜蓿转化优化的可能性,也提供了多基因转化到苜蓿植株的可行性。在裸子植物和一些谷类作物中已经使用了体细胞胚的遗传转化方法[12-14],结果表明,使用体细胞胚的转化方法具有很大的优势,转化效率高、减少逃逸和转化程序快[13,15-16]。苜蓿在体细胞胚再生研究中是模式植物[17-19]。但是,很少有研究使用苜蓿体细胞胚作为外植体进行遗传转化。Ninkovic等[20]做了使用体细胞胚的苜蓿转化研究,但是,在研究中没有提供Southern杂交数据,不能从分子水平证实使用体细胞胚进行苜蓿转化方法的可行性。
本研究中,我们使用农杆菌介导的次级体细胞胚的遗传转化方法,试验证明此方法速度快、且简单易行,为多基因在同一受体的共转化实现苜蓿优良性状改良提供理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料
按照Tian等[21]的方法,使用叶柄外植体诱导初级体细胞胚:选取生长60~90 d的野生型苜蓿无菌苗的叶柄作为外植体,用解剖刀切成8 mm长的小段,置于SH2K愈伤诱导培养基上,20 d继代1次,形成的愈伤组织转到胚形成培养基BOi2Y中21 d后,体细胞胚形成,选取子叶期的初级体细胞胚用作外植体来诱导次级体细胞胚。典型的初级体细胞胚如图 1A所示。
1.1.2 培养基
SH2K培养基:用于诱导愈伤组织。主要成分见文献[22-23]:1 mg/L 2,4-D、0.2 mg/L Kinetin生长调节剂,4.35 g/L硫酸钾,288 mg/L脯氨酸,53 mg/L硫代脯氨酸,200 mg/L肌醇,30 g/L蔗糖,2.5 g/L植物胶 (pH 5.8)。
BOi2Y培养基:用于诱导体细胞胚形成。主要成分见文献[24]:0.2%酵母提取物,100 mg/L肌醇,30 g/L蔗糖,2.5 g/L的植物胶(pH 5.9)。
MSO培养基:用于诱导体细胞胚的萌发。主要成分见文献[25]:4.3 g/L MS盐,1 mg/L氨基乙酸,40 g/L蔗糖,8 g/L的琼脂 (pH 5.8)。

图1 初级体细胞胚的诱导和次级体细胞胚的形成Fig. 1 Induction of primary somatic embryos (SE) and development of secondary SE. (A) Primary mid-cotyledonary stage SE used for explants. (B) Calli formed at the cut surface of the explants after 3 weeks of culture in SH2K medium. (C) Secondary SE formed after 4 weeks of culture in BOi2Y medium. (D) Globular embryos were observed in BOi2Y medium. (E) Heart embryos were observed in BOi2Y medium. (F) Torpedo embryos were observed in BOi2Ymedium. (G) Pre-cotyledon embryos were observed in MSO medium. (H) Embryos germination, root and leaf development.
1/2 MSO培养基:用于诱导植株的形成。主要成分见文献[25]:2.65 g/L MS盐,1 mg /L氨基乙酸,20 g/L蔗糖,8 g/L琼脂 (pH 5.8)。
1.1.3 农杆菌菌株和质粒
试验用农杆菌菌株为GV3101[26],表达载体为pCambia2301 (图2),pCambia2301质粒由加拿大南方作物与食品保护中心田立宁实验室提供。其包含β-葡萄糖苷酶报告基因 (gus) 和抗性筛选标记新霉素磷酸转移酶基因 (nptⅡ),这 2个基因均受CaMV 35s启动子调控,其中gus基因包含一个内含子,其可消除残余菌液中的 gus基因表达行为。pCambia2301载体通过电转化的方法导入到农杆菌 GV3101菌株[27]。该载体T-DNA区域的结构见图2。
1.2 试验方法
1.2.1 不同培养基对N4.4.2苜蓿次级体细胞胚形成的影响
SH2K[22-23]和 B5h[28]用于诱导来自初级体细胞胚的胚性愈伤。初级体细胞胚放在愈伤诱导培养基中,胚性愈伤组织形成,21 d后在新的诱导培养基中继代,形成好的愈伤组织转到胚形成培养基BOi2Y中,14 d后体细胞胚形成。
1.2.2 不同苜蓿基因型对次级体细胞胚的影响
N4.4.2、XAK-6A-10、F1-1和XAK-6A-7四个苜蓿基因型用于研究不同基因型对次级体细胞胚的影响。
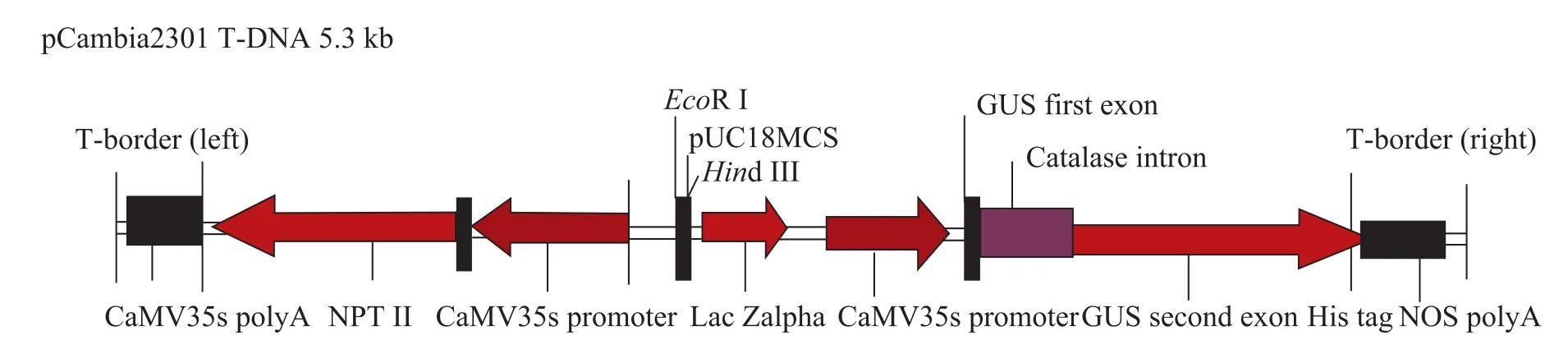
图2 表达载体pCambia2301的T-DNA结构Fig. 2 Schematic representation of the T-DNA (5.3 kb) of pCambia2301.
1.2.3 体细胞胚的遗传转化和植株的恢复
选取子叶期的体细胞胚作为外植体,用解剖刀切开,置于SH2K培养基上预培养2 d。将−20 ℃下保存的农杆菌在LB培养基上活化培养1~2 d,达到对数生长期后,测定农杆菌菌液OD600为0.5~1.0时,用农杆菌侵染预培养的外植体4 min,用无菌滤纸吸去多余菌液,转移外植体至含20 μmol/L乙酰丁香酮的SH2K培养基上,共培养2 d,预培养和乙酰丁香酮用于提高转化效率[29]。随后,在含75 mg/L卡那霉素的SH2K愈伤形成培养基中培养,筛选抗性愈伤。继代培养2~3次后,将生长旺盛、外观黄绿色、疏松的抗性愈伤组织转移到含 75 mg/L卡那霉素的BOi2Y胚形成培养基上,14 d后,新鲜的胚状愈伤组织上出现绿色芽点,30 d后体细胞胚形成。将再生的绿色体细胞胚转移到含75 mg/L卡那霉素的MSO[25]胚萌发培养基上进行培养,28 d后体细胞胚生根萌芽,根和叶形成。将形成的植株再转到含有75 mg/L卡那霉素的1/2 MSO植株形成培养基中培养,然后选择根系生长健壮、株高约10 cm的植株移栽于温室中或用于转基因体细胞胚的诱导。所有的培养均在25 ℃、24 h光周期、3 000 lx光照条件下进行。每一步的转化培养都是在75 mg/L的卡那霉素筛选压下进行。
1.2.4 GUS组织化学定位和荧光检测
转化植株形成后,取苜蓿植株各组织,用于GUS组织定位分析和荧光定量检测分析[30],通过组织化学分析确定 GUS表达的稳定性。将植物组织浸没在含有5-溴-4-氯-3-吲哚β-D-葡萄糖苷 (X-Gluc) 溶液的 2 mL Eppendorf管中,X-Gluc 溶液中含:0.5 mmol/L铁氰化钾、0.5 mmol/L亚铁氰化钾、体积分数0.3% Triton X-100、1 g/L X-Gluc和50 mmol/L磷酸盐缓冲液(pH 7.0),37 ℃保温过夜。第2天将植物组织用不同梯度的酒精脱色,在显微镜下观察组织染色情况。
1.2.5 转化植株的PCR检测
从转化植株中,随机选择11个转基因株系,按照Lodhi等[31]的方法,分别取幼嫩的植物叶片0.5 g提取基因组DNA。
采用 PCR 扩增检测目的片段,以pCAMBIA2301载体上的gus和npⅡ基因序列为参考,设计二者的上、下游引物,其中gus正向引物为5¢-CGTCCTGTAGAAACCCCAAC-3¢,gus反向引物为5¢-ATTGACCCACATTTGCCGT-3¢,npⅡ正 向 引 物 为 5¢-GAGGCTATTCGGC TATGACTG-3¢,nptⅡ反向引物为 5¢-ATCGG GAGCGGCGATACCGTA-3¢。gus和nptⅡ基因的预期片段长度分别为300 bp和700 bp,引物由Invitrogen公司合成。PCR反应体系共50 μL,包括100 ng DNA,200 μmol/L dNTPs,1 μmol/L的上、下引物,1 U Taq DNA聚合酶,1.5 mmol/L MgCl2,5 μL 10×Taq DNA聚合酶缓冲液。反应程序为:95 ℃变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃延伸5 min。取5 μL扩增产物于1%琼脂糖凝胶中进行电泳检测。
Southern blotting检测中,提取转基因苜蓿的基因组 DNA,采用紫外分光光度法结合琼脂糖凝胶电泳法测定DNA纯度和浓度。将10 μg DNA样品以T-DNA中边界具有单切点的限制性内切酶EcoRⅠ进行酶切过夜,在40 V电压下,电泳8~10 h,凝胶经变性与中和后,转膜和紫外交联固定DNA之后与地高辛标记的nptⅡ探针杂交,杂交操作参照《分子克隆实验指南》[32]并稍加改进。
1.2.6 数据的统计分析
试验数据处理采用Excel 2003软件,并使用SAS 8.0专业统计软件进行最小显著性检验(LSD,P≤0.05),数据用“平均值±平均标准误差”表示,各组均数比较采用单因素方差分析 (One way Anova)。所有的试验数据至少重复3次。
2 结果与分析
2.1 不同培养基对苜蓿次级体细胞胚的影响
图1C是诱导的愈伤组织转移到无生长调节剂的 BOi2Y培养基后,形成的次级体细胞胚。在愈伤诱导SH2K培养基中,次级体细胞胚的响应率是 89.29%,而在 B5h培养基的响应率是63.32% (表1)。数据统计分析表明,体细胞胚在不同培养基中存在显著差异,次级体细胞胚的响应率在SH2K培养基中明显高于在B5h培养基中。另外,对于响应的体细胞胚来说,在SH2K培养基中,每个初级体细胞胚诱导的次级体细胞胚数目7.00±0.94,而在B5h培养基中,每个初级体细胞胚诱导的次级体细胞胚数目是3.27±0.75,方差分析表明,在不同培养基中每个初级体细胞胚诱导的次级体细胞胚存在显著差异 (P<0.05) (表1)。
2.2 不同苜蓿基因型对次级体细胞胚的影响
从2.1中得出SH2K培养基是苜蓿次级体细胞培养最优化的培养基,因此,将 4个苜蓿基因型N4.4.2、XAK-6A-10、F1-1和 XAK-6A-7的初级体细胞胚置于 SH2K培养基中诱导次级体细胞胚。100 mg的胚性愈伤组织产生的体细胞胚的数目,在 N4.4.2、XAK-6A-10、F1-1中没有差异,而XAK-6A-7最低。4个基因型中,初级体细胞胚产生的次级体细胞胚存在明显的差异,基因型N4.4.2初级体细胞胚产生次级体细胞胚的响应率为89.29%,而AK-6A-10、F1-1、XAK-6A-7三个基因型分别为54.55%、38.18%、38.10%,N4.4.2与其余3个基因型之间有明显的差异。不同基因型次级体细胞胚转化成植株的转化效率也有显著性差异 (P<0.05),N4.4.2的转化效率为 (7.84±1.62) %,显著高于其他3个基因型 (表2)。

表1 不同培养基对苜蓿基因型N4.4.2次级体细胞胚形成的影响Table 1 Effect of different media on the development of alfalfa N4.4.2 genetype secondary somatic embryos
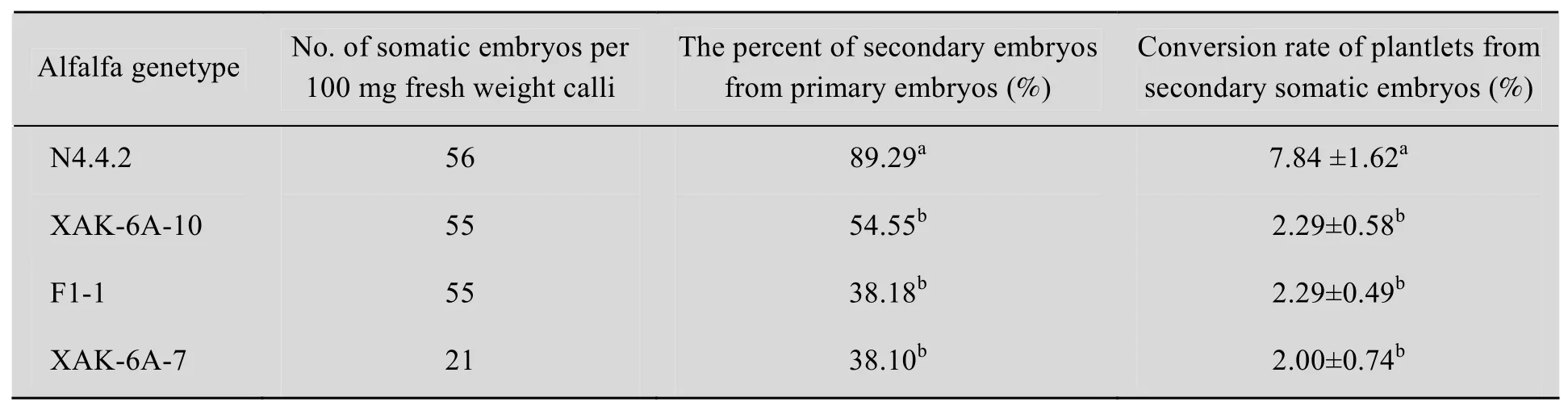
表2 不同苜蓿基因型对次级体细胞的的影响Table 2 Effect of different alfalfa genetype on the development of secondary somatic embryos
2.3 N4.4.2次级体细胞胚的遗传转化和转化植株的组织化学定位分析
从2.1和2.2得出,SH2K培养基是次级体细胞胚优化培养基,N4.4.2苜蓿基因型是最佳基因型。因此,SH2K培养基和N4.4.2苜蓿的初级体细胞胚用于苜蓿的遗传转化。用农杆菌侵染N4.4.2苜蓿的初级体细胞胚,在含有卡那霉素筛选的SH2K培养基中连续继代2~3次后,在外植体表面形成愈伤组织 (图 1B)。随后愈伤组织转到胚形成培养基BOi2Y中,14 d后次级体细胞胚形成,不同时期的体细胞胚包括球形胚 (图1D)、心形胚 (图1E)、水雷胚 (图1F)、子叶胚 (图1G)。形成的体细胞胚转到植株形成培养基MSO中,20 d后,次级体细胞胚萌发,胚轴、叶和根延伸生长,转化苜蓿植株形成。随后,转化植株移栽至温室 (图 3C)。通过组织化学定位分析不同组织的GUS表达,愈伤组织 (图3A)、体细胞胚 (图3B)、叶 (图3D)、根 (图3E)、花 (图3F)不同组织中均有GUS表达。在转化试验中,从供试的237个来自不同初级体细胞胚中,获得了36个转基因株系,共156个转基因苜蓿植株。转化效率是65.82% (表3)。
2.4 转化植株的PCR分析和Southern杂交分析
用 PCR方法检测转化和未转化苜蓿植株,以转化植株和未转化植株叶片的DNA为模板,使用gus和nptII基因的特异引物进行PCR扩增,
PCR产物经1%琼脂糖凝胶电泳检测可知,转化苜蓿植株中分别可以检测到300 bp和700 bp的 DNA扩增片段,而未转化的野生型苜蓿植株中没有DNA扩增片段 (图4)。
同时,提取转化植株叶片中的基因组DNA,用EcoR Ⅰ酶酶切基因组DNA。由于EcoR Ⅰ酶在T-DNA区有单一酶切位点,因此,用EcoR Ⅰ酶酶切、nptⅡ基因作为探针杂交,每一个杂交带可以看作独立整合位点[33],转基因植株表现出不同整合情况,整合 nptⅡ基因的不同拷贝数 1~4 (图5),Southern杂交证实了nptⅡ基因已经整合到植物基因组。

图3 转基因苜蓿的形成和GUS在不同转基因植物中的组织化学定位分析Fig. 3 Development of transgenic alfalfa plants and GUS expression in different tissue by histochemical analysis. (A) GUS expression in calli from primary somatic embryos infected by Agrobacterium strain GV3101. (B) GUS expression in secondary somatic embryos. (C) Transgenic alfalfa plant in greenhouse. (D) GUS expression in leaf from recovered transgenic alfalfa plants. (E) GUS expression in root from recovered transgenic alfalfa plants. (F) GUS expression in inflorescence from recovered transgenic alfalfa plants.

表3 N4.4.2基因型苜蓿次级体细胞胚的遗传转化Table 3 Genetic transformation of alfalfa N4.4.2 genetype secondary somatic embryos
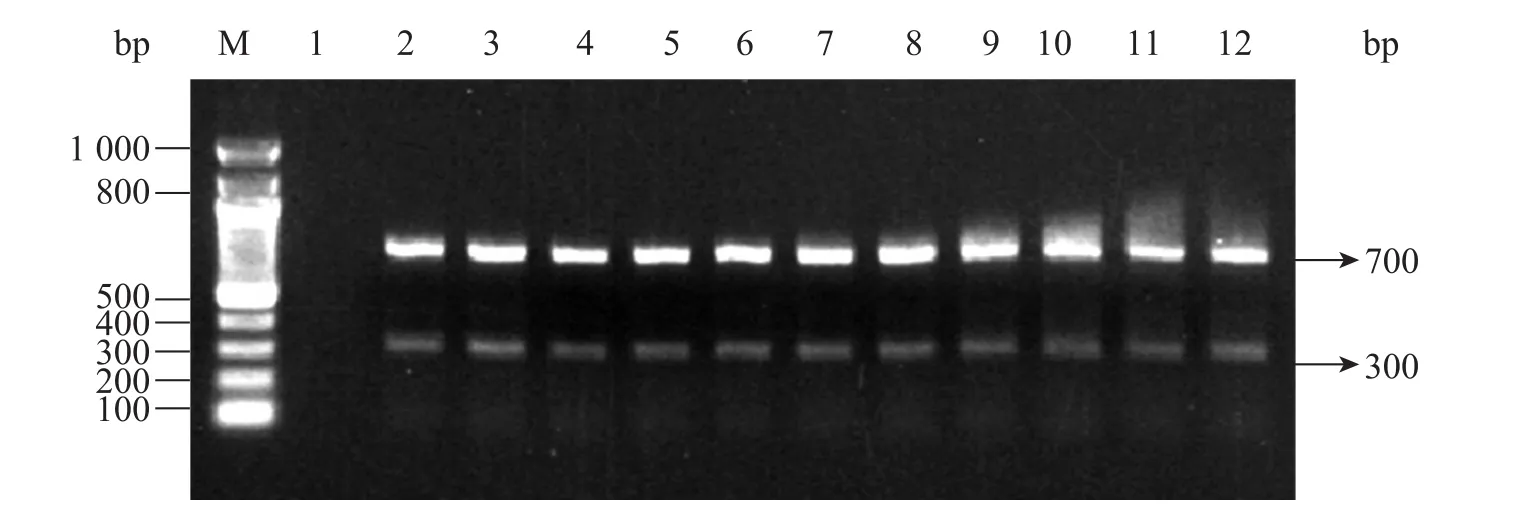
图4 转化和未转化的苜蓿植株中GUS和nptII基因的PCR检测Fig. 4 PCR analysis of GUS and nptII gene in transformed and non-transformed alfalfa. M: Marker DNA; 1: non-transformed control plant; 2−12: transformed plants.
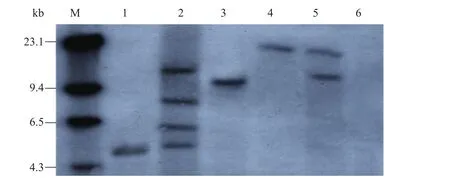
图5 Southern杂交分析转基因植株nptⅡ基因的拷贝数Fig. 5 Southern blotting analysis of transgenic plants to detect the copy number of npt Ⅱgene. M: molecular weight marker; 1–5: transgenic plants; 6: non-transgenic control plant.
3 讨论
优良品种选育是苜蓿优质饲草高产的基础,随着基因工程技术的发展,转基因技术为苜蓿优良品种选育开辟了一条新的途径。苜蓿的遗传转化再生体系又是其转基因的重要前提与基础,它的再生体系主要是通过体细胞胚的发生途径来实现。该途径有很多优点,诸如体细胞胚具有在实验室条件下容易获得,并且转化率较高;容易得到大量的转化植株,便于后代的筛选。
本研究参照 Tian等[21]的方法,选择不同苜蓿基因型和培养基,利用苜蓿初级体细胞胚为外植体进行农杆菌介导的遗传转化,建立并优化了农杆菌介导的紫花苜蓿遗传转化系统。研究表明,从胚性愈伤组织到体细胞胚的形成通常需要不同的培养基[34-35]。在本试验中,首先在含有生长调节剂的SH2K和B5h培养基中诱导胚性愈伤组织,然后,转移愈伤组织到无生长调节剂的胚形成培养基 BOi2Y中,诱导形成体细胞胚。在这2种培养基中,我们观察到来自初级体细胞胚形成的愈伤组织是非常快速的,大量的愈伤组织的形成仅需要7 d时间。而来自叶柄、茎、叶外植体和别的类型的外植体愈伤组织的形成需要20 d[21]。同时,在这2种培养基中,初级体细胞胚在SH2K培养基中愈伤组织响应率是89.29%,诱导的体细胞胚的数目是 (7.00±0.94) 个,明显优于B5h培养基。也就是说,单个初级体细胞胚通过SH2K培养基诱导次级体细胞胚数目达到了7个,在B5h培养基中诱导的次级体细胞胚的数目只达到了3个。而且,在实验中还发现,来自畸形的初级体细胞胚诱导形成的次级体细胞胚是正常的。这说明初级体细胞胚作为外植体在SH2K培养基中大大提高了次级体细胞胚的诱导频率。
植物的基因型也是影响苜蓿遗传转化成功与否的重要因素。在本试验中,4个苜蓿基因型N4.4.2、XAK-6A-10、F1-1和XAK-6A-7置于优化的SH2K培养基中诱导次级体细胞胚,结果表明,N4.4.2与其他3个苜蓿基因型诱导的次级体细胞胚的响应率和次级体细胞胚转化成植株的转化率存在显著差异,N4.4.2是4个基因型中最优化的基因型。因此,苜蓿农杆菌介导的遗传转化应注意选择合适的基因型。这与先前的研究是一致的[3,6,9-10]。
N4.4.2基因型和SH2K培养基是本研究的优化基因型和培养基,用于农杆菌介导的遗传转化。组织化学定位、PCR和Southern杂交检测表明,gus基因已经整合入苜蓿基因组中并得到正确的转录。从供试的237不同初级体细胞胚中,共获得36个转基因株系,156个转基因植株。转化效率是 65.82%。次级体细胞胚的遗传转化方法提高了苜蓿遗传转化效率。
目前,大多数转化技术只是将单个目的基因的转化用于植物的改良。但是,在植物体内,代谢途径或数量性状的遗传修饰常常需要多个相关基因协同表达,因此,将相关多基因转化到同一植株中,就显得很有必要。本研究首次报道了苜蓿次级体细胞胚的遗传转化。在今后的试验中,我们试图转入抗旱基因获得转基因苜蓿植株,随后诱导转基因苜蓿次级体细胞胚,将获得的抗旱转基因苜蓿植株次级体细胞胚作为外植体,转入抗寒基因,最终实现多基因的共转化苜蓿植株,为苜蓿多基因共转化开辟途径。
总之,在不同苜蓿品种中,初级体细胞胚能有效诱导次级体细胞胚,并能通过次级体细胞胚的遗传介导再生为转基因苜蓿植株。比较苜蓿植株其他的器官做外植体的常规转化方法,这种新的转化体系能缩短培养周期、提高诱导率。而且,提供了一个快速导入多基因到苜蓿植株中的方法。为苜蓿品质改进、分子生物学和基因组学的研究提供理论依据,这种方法也适用于别的转化方法效率低的一些苜蓿品种,拓宽了苜蓿遗传转化方法。
REFERENCES
[1] Huang SX, LV DY, Shao JH, et al. Regeneration of transgenic plants through protoplasm of alfalfa (Medicago sativa L). Chin Sci Bull, 1991, 36(17): 1345−1347.黄绍兴, 吕德扬, 邵嘉红, 等. 紫花苜蓿原生质体转基因植株再生. 科学通报, 1991, 36(17): 1345−1347.
[2] Huang WH, Liu ZX. Introduction of the Distribution and Development of Alfalfa. Beijing: Agricultural Press, 1995: 2−7.黄文惠, 刘自学. 概论苜蓿的分布和发展. 北京:中国农业出版社, 1995: 2−7.
[3] Desgagnés R, Laberge S, Allard G, et al. Genetic transformation of commercial breeding lines of alfalfa (Medicago sativa). Plant Cell Tissue Organ Cult, 1995, 42(2): 129−140.
[4] Austin S, Bingham ET, Mathews DE, et al. Production and field performance of transgenic alfalfa (Medicago sativa L.) expressing alpha-amylase and manganese-dependent lignin peroxidase. Euphytica, 1995, 85(1/3): 381−393.
[5] Samac DA. Strain specificity in transformation of alfalfa by Agrobacterium tumefaciens. Plant Cell Tissue Organ Cult, 1995, 43(3): 271−277.
[6] Xie XX, Lu Y, Liang J, et al. Establishment of an efficient Agrobacterium-mediated transformation system for genetic improvement of Alfalfa (Medicago sativa L.). J Agric Sci Technol, 2010, 12(1): 128−134.谢鑫星, 路扬, 梁晶, 等. 高效农杆菌介导的紫花苜蓿遗传转化体系的建立. 中国农业科技导报, 2010, 12(1): 128−134.
[7] Ziauddin A, Lee RWH, Lo R, et al. Transformation of alfalfa with a bacterial fusion gene, Mannheimia haemolytica A1 leukotoxin50-gfp: response with Agrobacterium tumefaciens strains LBA4404 and C58. Plant Cell Tiss Organ Cult, 2004, 79(3): 271−278.
[8] Montague A, Ziauddin A, Lee R, et al. High-efficiency phosphinothricin-based selection for alfalfa transformation. Plant Cell Tiss Organ Cult, 2007, 91(1): 29−36.
[9] De Marchis F, Bellucci M, Arcioni S. Handbook of New Technologies for Genetic Improvement of Legumes. Whitney: CRC Press, 2008: 29−43.
[10] Zare N, Valizadeh M, Tohidfar M, et al. Selection of regenerative genotypes from Iranian alfalfa cultivars. Int J Food Agri Environ, 2009, 7: 567−572.
[11] Zhang H, Huang QM, Su J. Development of alfalfa (Medicago sativa L.) regeneration system and Agrobacterium-mediated genetic transformation. Agri Sci China, 2010, 9(2): 170−178.
[12] Levée V, Garin E, Klimaszewska K, et al. Stable genetic transformation of white pine (Pinus strobus L.) after cocultivation of embryogenic tissues with Agrobacterium tumefaciens. Mol Breed, 1999, 5(5): 429−440.
[13] Leelavathi S, Sunnichan VG, Kumria R, et al. A simple and rapid Agrobacterium-mediated transformation protocol for cotton (Gossypium hirsutum L.): embryogenic calli as a source to generate large numbers of transgenic plants. Plant Cell Rep, 2004, 22(7): 465−470.
[14] Taniguchi T, Ohmiya Y, Kurita M, et al. Regeneration of transgenic Cryptomeria japonica D. Don after Agrobacterium tumefaciens-mediated transformation of embryogenic tissue. Plant Cell Rep, 2008, 27(9): 1461−1466.
[15] Fiore MC, Trabace T, Sunseri F. High frequency of plant regeneration in sunflower from cotyledons via somatic embryogenesis. Plant Cell Rep, 1996, 16(5): 295−298.
[16] Sun JY, Li WM, Zhang HS, et al. Somatic embryogenesis and plant regeneration in glandless upland cotton (Gossypium hirsutum L.). Front Agric China, 2009, 3(3): 279−283.
[17] Saunders JW, Bingham ET. Production of alfalfa plants from callus tissue. Crop Sci, 1972, 12(6): 804−808.
[18] McKersie BD, Brown DCW. Biotechnology and the Improvement of Forage Legumes. Wallingford: CABI, 1997: 111−143.
[19] McKersie BD, Senaratna T, Bowley SR, et al. Application of artificial seed technology in the production of hybrid alfalfa (Medicago sativa L.). In Vitro Cell Dev Biol, 1989, 25(12): 1183−1188.
[20] Ninković S, Miljuš-Dukić J, Vinterhalter B, et al. Improved transformation of alfalfa somatic embryos using a superbinary vector. Acta Biol Cracoviensia Ser Bot, 2004, 46: 139−143.
[21] Tian LN, Brown DCW, Watson E. Continuous long-term somatic embryogenesis in alfalfa. In Vitro Cell Dev Biol, 2002, 38(3): 279−284.
[22] Schenk RV, Hildebrandt AC. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Can J Bot, 1972, 50(1): 199−204.
[23] Shetty K, McKersie BD. Proline, thioproline and potassium mediated stimulation of somatic embryogenesis in alfalfa (Medicago sativa L.). Plant Sci, 1993, 88(2): 185−193.
[24] Blaydes DF. Interaction of kinetin and various inhibitors in the growth of soybean tissue. Physio Planta, 1966, 19(3): 748−753.
[25] Murashige T, Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physio Planta, 1962, 15(3): 473−497.
[26] Koncz C, Schell J. The promoter of TL-DNA gene 5 controls the tissue-specific expression of chimaeric genes carried by a novel type of Agrobacterium binary vector. Mol Gen Genet, 1986, 204(3): 383−396.
[27] Hood EE, Gelvin SB, Melchers LS, et al. New Agrobacterium helper plasmids for gene transfer to plants. Transgenic Res, 1993, 2(4): 208−218.
[28] Gamborg OL, Miller RA, Ojima K. Nutrient requirements of suspension cultures of soybean root cells. Exp Cell Res, 1968, 50(1): 151−158.
[29] Lopez SJ, Kumar RR, Pius RK, et al. Agrobacterium tumefaciens-mediated genetic transformation in tea (Camellia sinensis [L.] O. Kuntze). Plant Mol Biol Rep, 2004, 22(2): 201−202.
[30] Jefferson RA. Assaying chimeric genes in plants: the gus gene fusion system. Plant Mol Bio Rep, 1987, 5(4): 387−405.
[31] Lodhi MA, Ye GN, Weeden NF, et al. A simple and efficient method for DNA extraction from grapevine cultivars and Vitis species. Plant Mol Biol Rep, 1994, 12(1): 6−13.
[32] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3rd ed. Beijing: Science Press, 2002: 156−163.
[33] Trine JM, Kamfjord D, Håkelien AM, et al. The frequency of silencing in Arabidopsis thaliana varies highly between progeny of siblings and can be influenced by environmental factors. Transgenic Res, 2001, 10(1): 53−67.
[34] Duval Y, Engelmann F, Durand GT. Somatic Embryogenesis and Synthetic Seed I: Biotechnology in Agriculture and Forestry. Berlin: Springer Verlag, 1995: 335−352.
[35] Akhtar N, Kumari N, Pandey S, et al. Somatic Embryogenesis in Tropical Fruit Trees. Dordrecht: Kluwer, 2000: 93−144.
