甲醇/山梨醇共混流加诱导改变毕赤酵母生产猪α干扰素过程的代谢产能途径强化发酵性能
2012-02-09汪汇慧金虎高敏杰戴科科董世娟于瑞嵩李震史仲平
汪汇慧,金虎,高敏杰,戴科科,董世娟,于瑞嵩,李震,史仲平
1 江南大学生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122
2 上海市农业科学院畜牧兽医所,上海 201106
猪α干扰素 (Porcine interferon α,pIFN-α)是一种重要的抗口蹄疫、抗猪生殖和呼吸综合症的兽药,具有非常广阔的应用前景[1]。合作单位上海市农业科学院畜牧兽医所成功地在毕赤酵母中克隆表达了pIFN-α,摇瓶条件下的最高抗病毒活性达到2.1×104IU/mL[2]。毕赤酵母生产表达外源蛋白是高耗氧高耗能的过程,探讨研究罐规模下毕赤酵母高密度流加培养发酵生产 pIFN-α过程的能量代谢规律及其对发酵性能的影响,可为构建高效和批量化的 pIFN-α发酵生产体系、以及pIFN-α的商业化生产提供借鉴和参考。
毕赤酵母高密度流加培养生产表达外源蛋白过程一般由前期细胞培养和后期诱导表达两个阶段构成。在获取了大量、具有蛋白分泌表达功能的细胞以后,诱导阶段通过合理的甲醇诱导来提高单位体积培养液中的目标蛋白表达水平(活性、效价等),这是实现大规模、商业化药物蛋白生产的另一个最关键因素。外源蛋白的高效诱导至少与大量获取功能性生物体同等重要、甚至更加重要。毕赤酵母诱导外源蛋白一般在30 ℃下进行。这时,甲醇充当了碳源、能源和诱导剂三重角色,因此,诱导阶段的代谢过程以及相应的蛋白诱导表达的控制也更为复杂。国内外有关诱导阶段重组毕赤酵母发酵控制的研究报道主要集中在甲醇浓度和pH的最适控制水平[3-4]、低温诱导的作用[5-6]以及非限制性碳源与甲醇共混流加进行诱导[7]等几个方面。其中,低温诱导和山梨醇/甲醇共混流加诱导的公认作用就是抑制蛋白酶的分泌、减少目标蛋白的降解、缓解细胞衰亡[8]。毕赤酵母以甲醇作为唯一碳源表达外源蛋白时,一般认为通过甲醛异化途径为提供功能性细胞和目标蛋白的合成提供能量[9-10],该途径在为蛋白合成提供能量的同时,中间代谢产物甲醛等脱离过氧化物酶体(Peroxisome) 进入到液胞内,会对细胞产生毒害作用[11],导致目标蛋白的浓度或活性低、高效表达难以长时间地持续下去。我们前期的研究结果[12-14]表明,低温 (20 ℃) 诱导可以改变甲醇代谢中的代谢流分布、加大蛋白合成支路的碳代谢通量、提高能量 (ATP) 再生效率和目标蛋白的浓度。但是,由于此时ATP的供给需求大幅增加、耗氧量激增,导致规模发酵 (10~100 L) 下的操作成本 (冷却和供氧能耗) 急剧上升。山梨醇/甲醇共混流加诱导可缓解甲醇作为唯一能源对细胞工作运转的供能压力和目标蛋白的降解,同时还对醇氧化酶AOX具有一定程度的可逆性抑制作用[7]、可以对甲醇代谢速率进行适度调控。理论上,这可以缓解低温诱导条件下 O2需求过高、温度和溶解氧浓度 (DO) 难以控制的问题。本研究以提高猪α干扰素抗病毒活性、降低发酵成本为目标,重点探讨了10 L罐下,山梨醇/甲醇共混流加诱导对毕赤酵母生产猪α干扰素产能途径改变和发酵性能改善的影响,为猪α干扰素的产业化生产提供参考和借鉴。
1 材料与方法
1.1 菌种
重组巴斯德毕赤酵母 Pichia psatoris KM71H (IFNα-pPICZαA) 菌株,由上海市农业科学院畜牧兽医研究所重点实验室构建。
1.2 培养基
平板活化培养基 (g/L):葡萄糖20,蛋白胨20,酵母粉10,琼脂20,pH自然。
种子培养基 (g/L):葡萄糖20,蛋白胨20,酵母抽提物10,pH自然。
10 L罐初始培养基、甘油流加以及甲醇诱导培养基 (g/L):参见参考文献[12]。
山梨醇流加培养基 (g/L):山梨醇500。
1.3 分析方法
1.3.1 细胞浓度、甲醇浓度和 pIFN-α抗病毒活性测定
方法参见文献[12]。
1.3.2 发酵液中山梨醇浓度和胞内甲醛、甲酸含量测定
采用高效液相色谱法测定。测定胞内甲醛、甲酸时,首先按Suye等[15]所报道的方法进行细胞破壁、离心后得到上清。粗样品均先用0.22 μm的PVDF膜进行过滤处理。山梨醇测定条件是,柱型号:Aglient氨基柱;检测器:示差折光检测器 (RID);柱温:30 ℃;流动相组成:乙腈/超纯水=7∶3 (V/V);流动相流速:1 mL/min;进样量:20 μL。甲醛和甲酸测定条件是,柱型号:Agilent ZORBAX SB C18柱;检测器:紫外检测器 (UV),检测波长254 nm;流动相组成:20 mmol/L Na2PO4溶液/乙腈=99∶1;柱温:28 ℃,流动相流速:1 mL/min;进样量:10 mL。
1.3.3 醇氧化酶、甲醛脱氢酶和甲酸脱氢酶活性测定
AOX酶活性按Suye等[15]所报道的方法进行测定。甲醛脱氢酶 (FDH) 和甲酸脱氢酶 (FLD)活性按文献[16]所报道方法进行测定。
1.3.4 异柠檬酸脱氢酶和α-酮戊二酸脱氢酶活性测定
异柠檬酸脱氢酶 (Isocitrate dehydrogenase,IDH) 和 α-酮戊二酸脱氢酶活性 (α-ketoglutarte dehydrogenase,α-KGDHC) 分别按文献[17-18]所报道的方法进行测定。
1.4 发酵罐条件下的流加培养和诱导方法
毕赤酵母流加培养过程在10 L发酵罐中进行,初始装液量为5 L。30 ℃ (常温) 和20 ℃ (低温) 下的甲醇单独诱导操作条件和底物/诱导剂流加控制方法同文献[12]。根据前期优化结果,各实验条件下诱导期的甲醇浓度均控制在10 g/L。甲醇/山梨醇共混流加方法:细胞浓度达到 120~130 g DCW/L后甘油流加培养结束(30~32 h),饥饿培养约30 min耗尽残留甘油,30 ℃下同时添加甲醇和山梨醇培养基。通过甲醇在线测量和控制装置将甲醇浓度控制在10 g/L左右,使用蠕动泵以不同的设定转速恒速流加山梨醇,控制其残留浓度低于0.5 g/L。利用电子天平在线记录甲醇和山梨醇流加瓶的质量损失,并通过A/D-D/A多通道数据采集卡将数据传递给工控机,据此计算甲醇和山梨醇的实际添加量,以及甲醇和山梨醇平均消耗 (代谢) 速率。利用尾气分析仪测定发酵尾气中的O2和CO2分压,并借助RS232通信接口将数据记录于工控机中,按公式[19]计算耗氧速率OUR和CO2释放速率CER。
1.5 仪器设备生产厂家及型号
10 L发酵罐:镇江东方生物工程设备公司产,GUJS-10;甲醇在线测量和控制装置:上海苏泊公司产,FC2002;蠕动泵:保定兰格公司产,BT00-50M;电子天平:上海海康公司产,JA1102;尾气分析仪:韩国LOKAS公司产,LKM2000A;A/D-D/A多通道数据采集卡:台湾研华公司产,PCL-812PG。
2 结果与分析
2.1 30 ℃/20 ℃甲醇单独诱导和 30 ℃甲醇/山梨醇共混流加策略下的 pIFN-α发酵生产性能
前期研究结果表明,控制诱导阶段的甲醇浓度在10 g/L左右是实现pIFN-α高效表达的前提条件[14]。在该最优甲醇浓度 (10 g/L) 下,比较了30 ℃ (常温)/20 ℃ (低温) 甲醇单独诱导和30 ℃甲醇/山梨醇共混流加诱导条件对 pIFN-α发酵生产性能 (抗病毒活性、总蛋白) 的影响。图1的结果表明,降低诱导温度 (30 ℃→20 ℃)和采用甲醇/山梨醇共混流加策略 (30 ℃) 都能提高 pIFN-α的表达水平,但甲醇/山梨醇共混流加诱导对总蛋白浓度和 pIFN-α抗病毒活性水平的提高幅度更为显著。低温20 ℃诱导下的最高pIFN-α抗病毒活性达1.4×106IU/mL,是传统 30 ℃诱导下最高 pIFN-α抗病毒活性(1.35×105IU/mL) 的近10倍 (图1B)。而采用甲醇/山梨醇共混流加策略,两种山梨醇流加速率下的最高pIFN-α抗病毒活性都在1×106IU/mL以上。特别是较低山梨醇流加速率0.785 g/(L·h) 下的最高抗病毒活性更是达到 1.8×107IU/mL,是传统30 ℃甲醇单独诱导下最高pIFN-α抗病毒活性的近100倍 (图1B)。甲醇/山梨醇共混流加条件下,总蛋白浓度在整个诱导期持续增长 (图1A),说明该条件提高了细胞合成蛋白的能力、特别是提高了表达生产目标蛋白的能力。
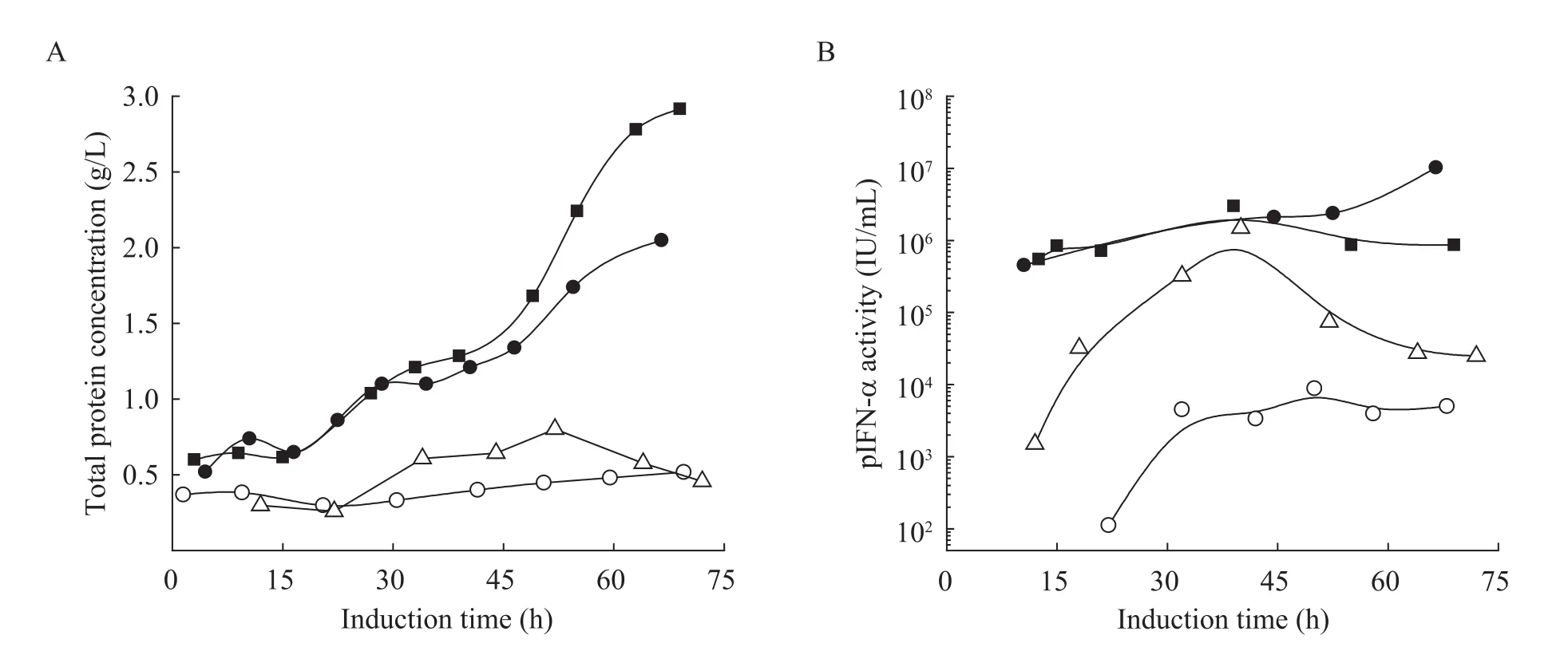
图1 不同诱导条件下的总蛋白浓度和pIFN-α抗病毒活性变化曲线Fig. 1 Total protein concentrations and pIFN-α antiviral activities under different induction strategies. Open symbols: pure methanol induction at 30 °C (○) and 20 °C (△); filled symbols: methanol/sorbitol co-feeding at 30 °C with sorbitol feeding rate of 0.785 g/(L·h) (●) and 1.437 g/(L·h) (■), respectively.
2.2 不同诱导条件对甲醇代谢关键酶 AOX、FLD和FDH活性的影响
醇氧化酶 (AOX) 是催化甲醇代谢的第一个关键酶,AOX活性的高低直接决定了甲醇的代谢速率,并间接影响到 pIFN-α的发酵生产水平。由于不同诱导策略下,进入到诱导期后的细胞浓度基本相同 (120~130 g DCW/L),图2中的AOX比活性实际体现了不同诱导条件下细胞代谢甲醇的能力。与30 ℃常温诱导相比,20 ℃低温诱导条件下的AOX比活性最高,是常温30 ℃诱导下相应活性的4~5倍。低温诱导条件下,甲醇代谢 (消耗) 速率明显加快 (表 1),甲醇代谢主路 (甲醇→甲醛) 的总代谢碳流大大增加。毕赤酵母表达系统的甲醇代谢主要依赖两条途径:甲醛异化产能途径和目标蛋白合成途径。其中产能途径在释放大量CO2的同时产生辅酶NADH,而 NADH又要通过耗氧的氧化磷酸化反应生成ATP,为功能性细胞的代谢和目标蛋白的合成提供能量。因此,低温甲醇单独诱导条件下的高甲醇消耗导致了发酵过程极高的耗氧需求,其结果是该条件下的溶解氧DO控制不住,一直在极低水平下徘徊 (表1)。30 ℃甲醇/山梨醇共混流加策略下的AOX比活性与30 ℃甲醇单独诱导下的水平基本相当,没有提高,但是,此条件下的pIFN-α抗病毒活性却提高了近百倍,表明该诱导条件下的碳代谢特别是能量供应途径可能发生了改变。另外,与文献报道[20]不同,本研究使用的KM71型毕赤酵母属于甲醇利用慢型菌,AOX活性在诱导15~30 h后甚至更长时间才能达到最大。其原因在于,该菌AOX1启动子的缺失使其代谢甲醇的能力下降、对甲醇诱导环境的适应时间更长;高浓度甲醇环境下,细胞易产生“甲醇中毒”现象,故在诱导初期采用逐级提升的方式使甲醇浓度缓慢地接近其控制水平。

图2 不同诱导条件对AOX活性的影响Fig. 2 Time course of specific AOX activities under different induction strategies. Open symbols: pure methanol induction at 30 °C (○) and 20 °C (△); filled symbols: methanol/sorbitol co-feeding at 30 °C with sorbitol feeding rate of 0.785 g/(L·h) (●) and 1.437 g/(L·h) (■), respectively.

表1 甲醇单独诱导和甲醇/山梨醇共混流加诱导时毕赤酵母的碳和能量代谢以及发酵性能的比较Table 1 Comparison of carbon and energy metabolism, as well as fermentation performance under different induction strategies
为了验证上述能量供应途径发生改变的推测,对不同诱导条件下的甲醛异化产能途径的两个关键酶,甲醛脱氢酶 (FLD) 和甲酸脱氢酶(FDH) 的比活性进行了测定,结果如图3所示。以常温30 ℃甲醇单独诱导时的数据作为基准进行对比发现,低温20 ℃甲醇单独诱导下的FLD和FDH最高,几乎达到基准值10倍左右的水平,表明此条件下甲醛异化产能途径的代谢极其活跃。但是,与基准值相比,30 ℃甲醇/山梨醇共混流加下的 FLD和 FDH的比活性不但没有提高,反而有所降低,尤其是FLD的活性非常低,几乎接近于0 (图3A)。由于甲醛异化产能途径中的化学反应是连续序列式的反应,共混流加下很低的FLD活性水平表明,甲醇/山梨醇共混流加条件下,甲醛异化产能途径的代谢活性明显弱化,无法为pIFN-α蛋白的合成提供足够的能量。但是,此条件下的发酵液总蛋白浓度和 pIFN-α蛋白抗病毒活性反而更高 (图1),该事实进一步显示甲醇/山梨醇共混流加条件下的细胞供能途径确实发生了改变。
2.3 甲醇/山梨醇共混流加改变 pIFN-α发酵生产的供能途径
TCA循环是许多耗氧微生物生长以及代谢产物合成过程的主要供能途径,毕赤酵母在利用甘油增殖生长时,其能量供应也来自于 TCA循环。进入到诱导期时,毕赤酵母以甲醇为唯一碳源表达外源蛋白,一般公认甲醛异化途径是唯一的供能途径[9-10],但也有少数文献报道认为有一部分ATP和NADH来自于TCA循环[21-22]。在甲醇/山梨醇共混流加条件下,由于两种碳源、山梨醇和甲醇可以同时被利用,因此可能存在其他的供能途径,为细胞合成目标蛋白提供能量,但目前尚无相关的研究报道。为考证甲醇/山梨醇共混流加条件下可能出现的供能途径改变,对pIFN-α诱导阶段 TCA循环中的两个关键酶,α-酮戊二酸脱氢酶 (α-KGDHC) 和异柠檬酸脱氢酶(IDH) 的活性水平进行了分析测试。
图4的结果表明,甲醇单独诱导时 (30 ℃/ 20 ℃),这两个酶的活性均处于较低水平,特别是异柠檬酸脱氢酶 (IDH) 活性的实测值在多个时间点均接近于零。由于 TCA循环途径也是连续序列式反应,以NAD+为辅因子的限速酶IDH的活性大小直接决定了整个 TCA循环的代谢活性和通量。极低的IDH活性表明甲醇单独诱导下TCA循环被弱化甚至关闭,能量物质NADH无法生成,进而为 pIFN-α蛋白的合成提供能量(ATP)。上述结果也支持了甲醇单独诱导情况下,TCA循环不是供能途径的文献结论[9-10]。但是,在甲醇/山梨醇共混流加条件下,上述两个酶的活性均明显高于甲醇单独诱导下的活性水平,其中尤以IDH酶活性的提高最为明显。其原因可能是共混加入的辅助碳源-山梨醇可转化为 6-磷酸果糖而直接进入糖酵解途径,然后再继续进入到TCA循环,产生供能物质NADH。甲醇/山梨醇共混流加条件下IDE和α-KGDHC活性的大幅提高直接验证了细胞供能途径发生改变的推测。
2.4 甲醇单独诱导和甲醇/山梨醇共混流加诱导时毕赤酵母的碳和能量代谢以及发酵性能的比较分析
图5是不同诱导条件下,毕赤酵母发酵生产pIFN-α时的碳和能量代谢的示意图。当甲醇作为唯一碳源/能源诱导生产pIFN-α时,甲醇在图5所示的细胞同化 (A) 和甲醛异化产能 (B) 两个途径上进行碳流分配。我们前期的研究结果[12]表明,途径A和途径B的碳流占总甲醇代谢碳流的比例随诱导温度的变化而变化。当诱导温度从30 ℃降低到20 ℃时,由于AOX被激活,绝对甲醇代谢速率增加 1倍以上;与此同时,途径A的碳流分配比从43%升至65%,而途径B的碳流分配比则从57%降低到35%,能量物质NADH的利用率大大提高。根据上述的先知结果和实测的甲醇消耗速率,利用式4可计算得到30 ℃/20 ℃甲醇单独诱导下的途径A (同化) 和途径 B (异化产能) 的各速率参数以及能量利用效率h,以上计算参数归纳总结于表1和图5中。这时,NADH生成量与消耗于途径B中的甲醇量存在以下计量系数关系,即每消耗1摩尔C (甲醇) 分子产生2摩尔NADH。

图3 不同诱导条件对甲醛异化途径中的关键酶FLD和FDH活性的影响Fig. 3 Time course of specific FLD and FDH activities under different induction strategies. Open symbols: methanol induction at 30 °C (○) and 20 °C (△); filled symbols: methanol/sorbitol co-feeding at 30 °C with sorbitol feeding rate of 0.785 g/(L·h) (●) and 1.437 g/(L·h) (■), respectively.

图4 不同诱导条件对TCA循环途径中的关键酶IDH和α-KGDHC活性的影响Fig. 4 Time course of specific IDH and α-KGDHC activities under different induction strategies. Open symbols: methanol induction at 30 °C (○) and 20 °C (△); filled symbols: methanol/sorbitol co-feeding at 30 °C with sorbitol feeding rate of 0.785 g/(L·h) (●) and 1.437 g/(L·h) (■), respectively.
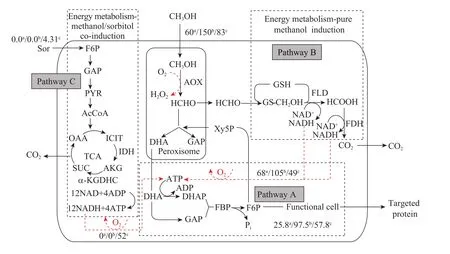
图5 不同诱导条件下毕赤酵母的代谢途径和碳/能量代谢模型Fig. 5 Major metabolic pathways and simplified metabolic/energy regeneration model of P. pastoris under different induction strategies. Numerical values represents the absolute/stable rates of methanol consumption, sorbitol consumption, carbon flow in protein synthesis route, and NADH production (broken lines), respectively, in mmol/L/h base. a: pure methanol induction at 30 °C (run #1 in Table 1); b: pure methanol induction at 20 °C (run #3 in Table 1); c: methanol/sorbotol co-feeding (run #5 in Table 1).

前面的代谢酶学分析结果表明,30 ℃甲醇/山梨醇 (Sor) 共混流加时,TCA循环 (途径 C)被打通、而甲醛异化供能途径 (途径 B) 则被弱化。这里,按照公认的甲醇代谢利用模式[9-10],假定甲醇无法进入 TCA循环参与能量物质NADH的生成,NADH主要依靠代谢山梨醇、由TCA循环 (途径C) 产生。同时,尽管此诱导条件下的甲醛异化供能途径被大大弱化,但是该途径并不可能被完全切断,仍有少量甲醇 (假定碳流分配比为e) 将继续进入途径B生成NADH,而大部分甲醇 (1−e) 则用于细胞和pIFN-α的合成。此时,来自于途径C的NADH生成量与山梨醇代谢 (消耗) 量之间存在着式2所示的计量系数关系:每消耗1摩尔C分子也同样产生2摩尔NADH,并附加有2/3摩尔的ATP直接生成;而来自于途径B的NADH生成量与消耗于该途径中的甲醇量依旧存在着式1所示的计量系数关系。另外,如图5和式3所示,不同诱导条件、不同供能途径下所产生的 NADH都必须经过氧化磷酸化反应再生得到ATP (假定P/O比一定,P/O=2~3),为功能性细胞和pIFN-α的合成提供能量。如果忽略每摩尔单C附加产生的2/3摩尔ATP的能量贡献,根据上述的有关假定、实测的甲醇/山梨醇代谢速率、实测耗氧速率 OUR、再结合使用物质平衡关系式4~5,则甲醇/山梨醇共混流加条件下的 (途径A/B/C中) 各主要速率参数和能量利用效率h就可以得到计算。此条件下的各计算参数也归纳总结于表1和图5中。

这里,rNADH、rA、rMeOH和rSor分别代表NADH生成速率、细胞同化途径A的碳代谢速率、甲醇代谢速率和山梨醇代谢速率。由于山梨醇(0.5 g/L) 和甲醇浓度 (10 g/L) 的浓度基本控制稳定,可假定代谢速率与各自的添加速率基本相等。h代表消耗单位摩尔能量物质NADH所能催化的用于目标蛋白合成的甲醇量,实际上,它反映了细胞的能量利用效率。h越大,能量利用效率就越高。
O2理论消耗速率可按照式5来进行计算。这里,甲醛异化供能途径 (途径 B) 中的耗氧反应有两步:第一步是甲醇在 AOX酶的催化和 O2的参与之下,氧化生成甲醛;第2步则发生在氧化磷酸化反应过程中。根据式1和式3的计量系数关系,并利用实测的甲醇/山梨醇代谢速率和耗氧速率OUR,最后可由式5推算出甲醇/山梨醇共混流加条件下途径B的碳流分配比e,进而确定此时的能量利用效率h。这里,根据相关的稳态数据推算得到共混流加条件下途径 B的碳流分配比e约为 0.30。与 30 ℃甲醇单独诱导(b=0.57) 相比,共混流加条件下甲醛异化供能途径的碳流分配比降低到前者的 50%左右,而用于目标蛋白合成途径的碳流分配比则增加了约63%。

图6显示了不同诱导条件下,主要中间代谢毒副产物甲醛以及甲酸的胞内积累情况。甲醇代谢时 (图5),甲醇首先进入到细胞的过氧化物酶体 (Peroxisome) 中,在醇氧化酶AOX的催化作用下与O2发生反应,生成甲醛 (HCHO)。这时,一部分甲醛在二羟基丙酮合成酶 (DHAS) 的催化下生成二羟基丙酮 (DHA) 和 3-磷酸甘油醛(GAP),并分泌到过氧化物酶体外,形成目标蛋白的主要构成成分。另一部分甲醛则直接脱离过氧化物酶体进入到液胞内,在FLD和FDH的顺序作用下,最终氧化生成CO2,同时生成NADH、为目标蛋白的合成提供能量,这部分甲醛将对细胞产生毒害作用。由于甲醇/山梨醇共混流加条件下的AOX活性低,甲醇总代谢速率相对小且走蛋白合成途径的碳流分配比大,脱离过氧化物酶体而直接进入到甲醛异化产能途径的甲醛量少。尽管此时FLD和FDH的活性低,但由于途径B的代谢被弱化 (e»0.3),少量脱离过氧化物酶体的甲醛依旧可以被完全氧化而没有积累。此时胞内甲醛和甲酸的浓度最低,对细胞的毒害最小。而低温20 ℃、甲醇单独诱导条件下,AOX活性最高,甲醇代谢速率最大。虽然此时FLD和FDH活性高,转化甲醛的“解毒”能力强,但仍无法完全氧化脱离过氧化物酶体的甲醛。此时,胞内甲醛和甲酸的浓度最高,甲醛对细胞的毒害作用最为严重。这可能也是相比于甲醇/山梨醇共混流加,低温甲醇单独诱导下 pINF-a抗病毒活性低的一个重要原因。

图6 不同诱导条件下甲醛、甲酸物质含量时间变化曲线Fig. 6 Time course of intercellular formaldehyde and formate concentration under different induction strategies. Open symbols: pure methanol induction at 30 °C (○, run #1) and 20 °C (△ , run #3); filled sy mbol: methanol/ sorbitol co-feeding at 30 °C with sorbitol feeding rate of 0.785 g/(L·h) (●, run #5).
图5、图6和表1的结果可以得到以下不同诱导条件下有关碳和能量代谢的结论:1) 20 ℃低温甲醇单独诱导下的甲醇代谢速率和细胞同化途径A的碳代谢速率最大。常温 (30 ℃) 甲醇/山梨醇共混流加条件下,由于AOX活性受到限制,甲醇代谢速率基本没有提高。但由于此时山梨醇完全用来为毕赤酵母的代谢供能,解除了细胞利用甲醇的供能压力,同化途径A的碳代谢速率为常温甲醇单独诱导时的1.5~2.2倍,达到低温诱导时的43%~59%的水平。2) 与30 ℃常温甲醇单独诱导相比较,甲醇/山梨醇共混流加时的能量物质NADH生成速率的提升幅度可达48%~91%,且低速山梨醇流加时的能量利用效率h也有很大提高 (0.38®0.57),有利于 pINF-a的持续积累。3) 甲醇/山梨醇共混流加条件下,山梨醇通过TCA循环大量产生能量物质NADH,而甲醛异化供能途径则被弱化 (弱化程度约50%)。此时,甲醇代谢过程中公认的毒副产物甲醛的生成得到抑制,这也为 pINF-a的持续积累创造了良好的环境。4) 与20 ℃低温甲醇单独诱导相比,甲醇/山梨醇共混流加下的理论耗O2速率小、只有前者的70%左右。低温甲醇单独诱导条件下,高耗氧速率导致溶解氧浓度过低,在不使用富氧空气的情况下,DO只能长期处于极低的水平 (表1)。而由于毕赤酵母的高好氧特性,过低的DO会对外源基因的表达产生负面影响[10]。另外,目标蛋白的正确表达依赖于二硫键的形成,而二硫键的形成则需要蛋白分泌机构处于较高的氧化状态[23]。因此,通过使用共混流加策略降低供氧需求、使 DO始终保持在适中 (10%~20%) 水平,还可以避免因供氧不足所引起的蛋白表达效率低下的问题。5) 低温甲醇单独诱导虽然也可以提高pINF-a的表达水平和抗病毒活性,但是,它的操作成本高,特别是夏季生产、存在低温冷却水大量需求等问题。甲醇/山梨醇共混流加策略可在常温、使用空气的条件下进行,与低温甲醇单独诱导相比,发酵成本低,整体发酵性能显著提高。
3 结论
通过对不同诱导条件下毕赤酵母发酵生产pINF-a过程的AOX酶活、甲醛异化产能途径关键酶和TCA循环关键酶的对比分析发现,30 ℃、甲醇/山梨醇共混流加诱导下,主要供能途径由甲醇单独诱导时的甲醛异化途径转向TCA循环,在缓解细胞供能压力的同时,还大幅提高了进入目标蛋白合成途径的甲醇分配比例。此时,最高抗病毒活性达到1.8×107IU/mL,是30 ℃甲醇单独诱导下最高活性的100倍以上。
甲醇/山梨醇共混流加条件下:与30 ℃甲醇单独诱导相比,NADH生成速率的提升幅度可达48%~91%,且低速山梨醇流加时的能量利用效率h也有很大提高,有利于pINF-a的持续积累;甲醛异化供能途径被弱化,毒副产物甲醛的生成积累得到抑制,为 pINF-a蛋白的持续积累创造了良好的环境;理论耗O2速率较低,只有20 ℃低温甲醇单独诱导条件下的72%~75%,使发酵可以在常温、使用空气供氧的条件下进行,发酵成本明显下降。
REFERENCES
[1] Chinsangaram J, Koster M, Grubman MJ. Inhibition of L-deleted foot-and-mouth disease virus replication by alpha/beta interferon involves double-stranded RNA-dependent protein kinase. J Virol, 2001, 75(12): 5498−5503.
[2] Ge L, Li Z, Yu RS, et al. Secretive expression of porcine IFN-α in yeast Pichia pastoris. Chin J Vet Sci, 2005, 25(3): 289−292.葛丽, 李震, 于瑞嵩, 等. 猪α干扰素基因在毕赤酵母中的分泌表达, 中国兽医学报, 2005, 25(3): 289−292.
[3] Chiruvolu V, Cregg JM, Meagher MM. Recombinant protein production in an alcohol oxidase-defective strain of Pichia pastoris in fedbatch fermentations. Enzyme Microb Technol, 1997, 21(4): 277−283.
[4] Kobayashi K, Kuwae S, Ohya T, et al. Addition of oleic acid increases expression of recombinant human serum albumin by the AOX2 promoter in Pichia pastoris. J Biosci Bioeng, 2000, 89(5): 479−484.
[5] Jahic M, Wållberg F, Bollok M, et al. Temperature limited fed-batch technique for control of proteolysis in Pichia pastoris bioreactor cultures. Microb Cell Fact, 2003, 2: 1−11.
[6] Wang Y, Wang ZH, Xu QL, et al. Lowering induction temperature for enhanced production of polygalacturonate lyase in recombinant Pichia pastoris. Process Biochem, 2009, 44(9): 949−954.
[7] Celik E, Calik P, Oliver SG. Fed-batch methanol feeding strategy for recombinant protein production by Pichia pastoris in the presence of co-substrate sorbitol. Yeast, 2009, 26(9): 473−484.
[8] Ramón R, Ferrer P, Valero F. Sorbitol co-feeding reduces metabolic burden caused by the overexpression of a Rhizopus oryzae lipase in Pichia pastoris. J Biotechnol, 2007, 130(1): 39−46.
[9] Tani Y. Microbiology and biochemistry of methylotrophic yeasts// Hou CT, Ed. Methylotrophs: Microbiology, Biochemistry, and Genetics. Florida: CRC Press, 1984: 55−85.
[10] Cereghino JL, Cregg JM. Heterologous protein expression in the methylotrophic yeast Pichia pastoris. FEMS Microbiol Rev, 2000, 24(1): 45−66.
[11] Lee B, Yurimoto H, Sakai Y, et al. Physiological role of the glutathione-dependent formaldehyde dehydrogenase in the methylotrophic yeast Candida boidinii. Microbiology, 2002, 148(9): 2697−2704.
[12] Gao MJ, Dong SJ, Yu RS, et al. Improvement of ATP regeneration efficiency and operation stability in porcine interferon-α production by Pichia pastoris under lower induction temperature. Korean J Chem Eng, 2011, 28(6): 1412−1419.
[13] Liu GQ, Jin H, Gao MJ, et al. Improvement of porcine interferon-α production and ATP regeneration efficiency by reducing induction temperature. J Chem Ind Engin, 2011, 6(2): 444−451.刘国强, 金虎, 高敏杰, 等. 降低诱导温度对改善猪 α-干扰素发酵生产性能和 ATP再生效率的作用. 化工学报, 2011, 6(2): 444−451.
[14] Jin H, Liu GQ, Ye XF, et al. Enhanced porcine interferon-α production by recombinant Pichia pastoris with a combinational control strategy of low induction temperature and high dissolved oxygen concentration. Biochem Eng J, 2010, 52(1): 91−98.
[15] Suye S, Ogawa A, Yokoyama S, et al. Screening and identification of Candida methanosorbosa as alcohol oxidase-producing methanol using yeast. Agric Biol Chem, 1990, 54(5): 1297−1298.
[16] Schütte H, Flossdorf J, Sahm H, et al. Purification and properties of formaldehyde dehydrogenase and formate dehydrogenase from Candida boidinii. Eur J Biochem, 1976, 62(1): 151−160.
[17] McCarthy JL, Gauthier J. NADP-isocitric dehydrogenase of gerbil adrenal mitochondria: support of steroid hydroxylation. Cell Mol Life Sci, 1984, 41(4): 484−485.
[18] Hong SY, Bak C II, Ryu JH, et al. Interaction of α-Ketoglutarate dehydrogenase complex with allosteric regulators detected by a fluorescence probe, 1, 1’-bi (4-aniline) naphthalene-5, 5’-disulfonic acid, an inhibitor of catalytic activity. J Biochem Mol Biol, 1996, 29(3): 230−235.
[19] Shi H, Shimizu K. On-line metabolic pathway analysis based on metabolic signal flow diagram. Biotechnol Bioeng, 1998, 58(2/3): 139−148.
[20] Guo MJ, Chu J, Zhuang YP, et al. Parameters-based association analysis for recombinant phytase expression in genetically engineered Pichia pastoris at transition phase. Chin J Biotech, 2004, 20(6): 932−936.郭美锦, 储炬, 庄英萍, 等. 重组毕赤酵母表达工程植酸酶发酵过渡相参数相关分析. 生物工程学报, 2004, 20(6): 932−936.
[21] Ren HT, Yuan JQ, Bellgardt KH. Macrokinetic model for methylotrophic Pichia pastoris based on stoichiometric balance. J Biotechnol, 2003, 106(1): 53−68.
[22] Sibirny AA, Ubiyvovk VM, Gonchar MV, et al. Reactions of direct formaldehyde oxidation to CO2are non-essential for energy supply of yeast methylotrophic growth. Arch Microbiol, 1990, 154(6): 566−575.
[23] Tu BP, Weissman JS. Oxidative protein folding in eukaryotes: mechanisms and consequences. J Cell Biol, 2004, 164(3):341−346.
