乌苏里蝮蛇毒一种C-型凝集素相关蛋白的分离、纯化及活性测定
2012-01-06孙德军
刘 立,田 刚,宋 艳,孙德军
(1.白求恩医科大学制药厂,2.吉林大学再生医学科学研究所 生物技术药物教研室,吉林 长春 130021)
乌苏里蝮蛇毒一种C-型凝集素相关蛋白的分离、纯化及活性测定
刘 立1,田 刚1,宋 艳2,孙德军2
(1.白求恩医科大学制药厂,2.吉林大学再生医学科学研究所 生物技术药物教研室,吉林 长春 130021)
目的 从乌苏里蝮蛇蛇毒中分离纯化得到具有促凝血活性的C-型凝集素相关蛋白。方法 利用IDASepharose FF亲和色谱作为独立的蛋白分离纯化手段,并且结合Sephadex G-100,Sephadex G-50凝胶过滤色谱从乌苏里蝮蛇蛇毒中分离得到一个新的蛋白组分。结果 该组分经还原和非还原SDS-PAGE电泳鉴定结果显示为均一的单一条带,即C-型凝集素相关蛋白,相对分子质量约为15.7 kD。结论 经过一系列的分离和纯化,能够从乌苏里蝮蛇蛇毒中提取到C-型凝集素相关蛋白组分。
乌苏里蝮蛇蛇毒;C-型凝集素相关蛋白(CLRPs);分离纯化;活性测定
长白山乌苏里蝮蛇(Gloydius ussuriensis)主要分布于我国东北部,以及朝鲜、俄罗斯的部分地区。蛇毒中组分复杂,包括蛋白质多肽、氨基酸、中性脂、游离单糖、磷酸、生物胺和核苷及微量金属离子,其中蛋白质和多肽是蛇毒的主要成分,占蛇毒干重的85% ~90%。
C-型凝集素相关蛋白(C-type lectin-related proteins,CLRPs)是蛇毒来源的C-型凝集素的重要组成部分。CLRPs家族中既含有α和β亚基以共价键形成的异源二聚体,也包括由多个异源二聚体(αβ)组成的相对分子质量(Mr)较大的异源二聚体寡聚体,其中,α和β亚基结构相似,由123~135个氨基酸组成,有40%的同源性,因而Mr极为相近,约为15 kD[1]。由于蛇毒来源的CLRPs,在空间结构和生物功能上具有较为突出的特性,已成为近几年蛇毒研究的热点。国内外相关研究已发现了多种不同蛇毒来源的 CLRPs[2],而长白山乌苏里蝮蛇来源的CLRPs尚未见报道。
本实验利用IDA-Sepharose FF亲和色谱作为独立的蛋白分离纯化手段,并且结合Sephadex G-100,Sephadex G-50凝胶过滤色谱从乌苏里蝮蛇蛇毒中分离得到一种新的CLRPs,为后续的研究工作和开发与利用奠定实验基础。
1 材料
长白山乌苏里蝮蛇蛇毒(Gloydius ussuriensis snake venom)购于吉林磐石养蛇场,冷冻真空干燥后为黄色粉末。
IDA-Sepharose FF,Sephadex G-100,Sephadex G-50,Amersham Pharmacia公司;标准 Mr(14.3 ~97.2 kD)蛋白marker、标准牛血清蛋白、考马斯亮蓝G-250,美国Sigma公司。
HD-95-1核酸蛋白检测仪,上海金达生化仪器厂;DYY-6C电泳仪,北京六一仪器厂;UV-802H紫外可见分光光度计,尤尼柯上海仪器有限公司。
2 方法
2.1 乌苏里蝮蛇毒CLRPs的分离纯化及鉴定
称取乌苏里蝮蛇毒粗毒1 g溶于pH 8.0,0.05 mol/L的Tris-HCl缓冲液5 mL中,4℃透析除盐,过夜。取透析过夜后的样品,此时样品应为澄清淡黄色液体,上样到用同样的缓冲液平衡的IDA-Sepharose FF(2.5 cm×50 cm)亲和色谱交换柱上,然后先用含0.02 mol/L 咪唑的 0.05 mol/L Tris-HCl缓冲液(pH 8.0)洗脱,再用 0.3,1.0 mol/L 咪唑-0.05 mol/L Tris-HCl缓冲液(pH为8.0)分级梯度洗脱,得到4个峰,SDS-PAGE电泳对各个峰所含蛋白进行检测,将峰Ⅳ收集并用30 kD截留量的超滤管超滤浓缩,浓缩样品上样到Sephadex G-100色谱柱(2.5 cm ×100 cm),并用0.01 mol/L Tris-HCl缓冲液(pH 8.0)洗脱,得到2个峰,SDS-PAGE电泳对各个峰所含蛋白进行检测,将峰2收集,并用离心超滤管(30 kD)浓缩至5 mL,上样到Sephadex G-50色谱柱(2.5 cm ×50 cm),用 0.01 mol/L Tris-HCl缓冲液(pH 8.0)洗脱,得到1个蛋白主峰,利用 SDSPAGE电泳进行鉴定。
2.2 乌苏里蝮蛇毒CLRPs的Mr测定[3]
利用SDS-PAGE电泳测定Mr。根据各不同Mr蛋白质Marker(14.3~97.2 kD)的Rf值推导出直线回归方程,根据样品的Rf值估算出样品的Mr。
2.3 乌苏里蝮蛇毒CLRPs的浓度测定[4]
利用考马斯亮兰染色法测定蛋白浓度。将考马斯亮兰G-250染液5 mL,分别加入到标准蛋白溶液0.1 mL中,于595 nm波长处测吸光度值,求出直线回归方程。取样品溶液0.1 mL按1∶10稀释后,测定吸光度值,计算出浓度。
2.4 乌苏里蝮蛇毒CLRPs的纤维蛋白原凝固活性测定
取0.2%纤维蛋白原溶液200 μL,37℃水浴 2 min后,加入不同浓度的乌苏里蝮蛇毒CLRPs(0.05~0.5 mg/mL)40 μL,记录凝固所需时间。
2.5 乌苏里蝮蛇毒CLRPs对不同浓度纤维蛋白原凝固活性测定
将正常的新鲜血浆加热到60℃,5 min后取出,3 000 r/min离心10 min,得到上层血清,其中基本不含有纤维蛋白原,用此血清将已知浓度的纤维蛋白原按一定比例稀释,得到不同浓度的纤维蛋白原血浆。取不同浓度的纤维蛋白原血浆200 μL,分别加入0.5 mg/mL 乌苏里蝮蛇毒 CLRPs 40 μL,观察并记录各组血浆凝固所需要的时间。
2.6 乌苏里蝮蛇毒CLRPs的纤维蛋白原水解活性测定[5]
取0.5 mg/mL乌苏里蝮蛇毒CLRPs溶液 120 μL,加入0.2%纤维蛋白原溶液600 μL,混匀,37 ℃水浴 2 min,于第 0,5,15,30 min 和 1,2,5,12,24 h分别取出80 μL,终止反应,用不加样品的0.2%纤维蛋白原溶液作为阴性对照。将上述各时间点取出的样品进行SDS-PAGE电泳鉴定纤维蛋白原降解情况,T 为12.5%。
3 结果
3.1 乌苏里蝮蛇毒CLRPs的分离纯化及鉴定
乌苏里蝮蛇毒粗提物经IDA-Sepharose FF亲和色谱,分离得到4个蛋白峰,标记为PeakⅠ~Ⅳ(图1),采用SDS-PAGE电泳对各个蛋白峰进行检测,发现峰Ⅳ中含有乌苏里蝮蛇毒CLRPs。将峰Ⅳ进行Sephadex G-100凝胶过滤色谱后分离得到2个蛋白峰,分别记作Peak 1和2(图2),同样方法检测,发现Peak 2中含有乌苏里蝮蛇毒CLRPs。将Peak 2进行Sephadex G-50凝胶过滤色谱后,得到蛋白主峰,同样方法进行检测,乌苏里蝮蛇毒CLRPs呈单一条带。

图1 乌苏里蝮蛇粗毒IDA-Sepharose FF亲和色谱分离图谱Fig.1 Affinity chromatography of Gloydius ussuriensis venom on IDA-Sepharose FF
3.2 乌苏里蝮蛇毒CLRPs的电泳图谱
将Sephadex G-50凝胶过滤色谱分离后的含有乌苏里蝮蛇毒CLRPs的组分,经还原和非还原条件SDSPAGE鉴定,电泳图谱显示,均呈单一条带(图4)。
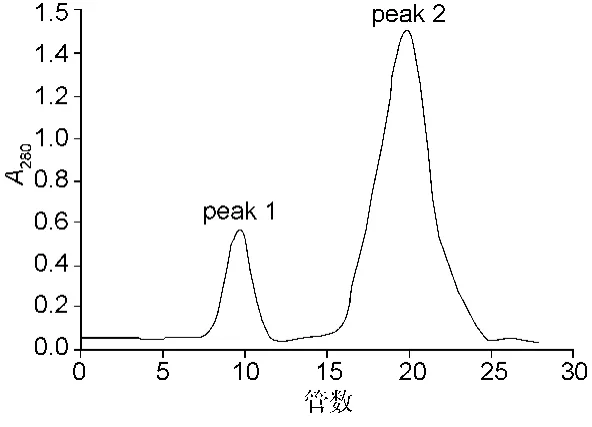
图2 PeakⅣ组分的Sephadex G-100凝胶过滤色谱分离图谱Fig.2 Gel filtration of PeakⅣ on Sephadex G-100

图3 Peak 2组分的Sephadex G-50凝胶过滤色谱分离图谱Fig.3 Gel filtration of Peak 2 on Sephadex G-50

图4 非还原和还原SDS-PAGE分析乌苏里蝮蛇毒CLRPs(T=15%)Fig.4 Non-reducing and reducing SDS-PAGE analysis of Gloydius ussuriensis venom C-type lectin-related protein by 15%SDS-PAGE
3.3 乌苏里蝮蛇毒CLRPs的Mr
根据蛋白质Marker的相对位置,计算出Rf值,进行线性回归,得回归方程:Y=2.108 -1.165 X,其中X 为Rf值,Y为 Mr的对数,r=0.797 4。根据样品Rf值由回归方程计算出乌苏里蝮蛇毒CLRPs的Mr约为15.7 kD。
3.4 乌苏里蝮蛇毒CLRPs的浓度
利用考马斯亮兰法,测得标准蛋白溶液的浓度(C)与595 nm处的吸光度(A)值的关系,求出回归方程为:C=0.415 7 A+0.017 1,r=0.998。将乌苏里蝮蛇毒CLRPs溶液A值导入回归方程,并计算出样品浓度为1.025 mg/mL。
3.5 乌苏里蝮蛇毒CLRPs的纤维蛋白原凝固活性
结果见表1。随着乌苏里蝮蛇毒CLRPs浓度的增加,纤维蛋白原凝固所需要的时间明显减少。说明乌苏里蝮蛇毒CLRPs可以促进纤维蛋白原凝固。
3.6 乌苏里蝮蛇毒CLRPs对不同浓度纤维蛋白原凝固活性
结果见表2。随着纤维蛋白原浓度的下降,凝固所需要的时间将延长。
3.7 时间对乌苏里蝮蛇毒CLRPs的纤维蛋白原水解活性影响
乌苏里蝮蛇毒CLRPs与纤维蛋白原经过不同时间反应后,通过电泳图谱检测可见该蛋白优先降解纤维蛋白原的α链,5 h后开始降解β链,而未能降解γ链(图5)。分。通过SDS-PAGE和纤维蛋白原凝固活性测定、促凝血活性测定等多种生物活性测定方法对该组分的结构特征和生物功能进行检测和评价,根据实验结果,将其初步归属于CLRPs。
4 讨论
本实验利用IDA-Sepharose FF亲和色谱和Sephadex G-100,Sephadex G-50凝胶过滤色谱等方法从长白山乌苏里蝮蛇毒中得到了一种新的蛋白组

表1 乌苏里蝮蛇毒CLRPs对纤维蛋白原凝固活性的影响(x ± s,n=7)Tab.1 Coagulant activity of Gloydius ussuriensis venom C-type lectin-related protein on fibrinogen(x ± s,n=7)

表2 乌苏里蝮蛇毒CLRPs对不同浓度纤维蛋白原凝固活性的影响(x ± s,n=7)Tab.2 Coagulant activity of Gloydius ussuriensis venom C-type lectin-related protein on different concentrations of fibrinogen(x ± s,n=7)
在分离纯化过程中,本实验选用了IDA-Sepharose FF亲和色谱对乌苏里蝮蛇粗毒进行初步的分离。IDA-Sepharose是一种以亚氨基二乙酸作为配基,与金属离子形成金属离子亲和色谱,用以分离对重金属有较强亲和力的蛋白。由于IDA-Sepharose FF亲和色谱可以与金属离子结合,且大多数的CLRPs的结构中含有金属离子结合位点,因而CLRPs可以与IDA配基结合。实验结果发现,利用IDA-Sepharose FF亲和色谱能够去除大多数非目的蛋白,而且蛋白得率较为理想。采用均一浓度和不同浓度的咪唑梯度洗脱,发现使用分级梯度洗脱不仅可以最大程度减少非特异性吸附,提高分离效果,而且可以使目的蛋白集中地与IDA-Sepharose FF分离,增加洗脱效率。

图5 乌苏里蝮蛇毒CLRPs的纤维蛋白原水解电泳图(T=12.5%)Fig.5 Fibrinogen degradation course anlysis of Gloydius ussuriensis venom C-type lectin-related protein by 12.5% SDSPAGE
[1] Morita T.Structures and functions of snake venom CLPs(C-type lectin-like proteins)with anticoagulant-,procoagulant-,and platelet-modulating activities[J].Toxicon,2005,45(8):1099-1114.
[2] 李文辉,张 云.蛇毒C-型凝集素研究进展[J].动物学研究,2003,24(2):151-160.
[3] 郭尧君.蛋白质电泳实验技术[M].2版.北京:科学出版社,2001:123-157.
[4] Bradford M M.A rapid and sensitive method for quantitation of microgram quantities of protein utilizing the principle of protein-dyebinding[J].Anal Biochem,1976,72(2):248-254.
[5] Ouyang C,Teng C M.Fibrinogenolytic enzymes of trimeresurus mucrosquamatus venom[J].Biochim Biophys Acta,1976,420(2):298-308.
Separation,purification and vital determination of a C-type agglutinin coherent protein in Gloydius ussuriensis toxin
LIU Li1,TIAN Gang1,SONG Yan2,SUN De-jun2
(1.Pharmaceutical Factory of Norman Bethune University of Medical Sciences,2.Department of Biomedicine,Institute of Frontier Medical Sciences,Jilin University,Changchun 130021,China)
Purpose To purify a C-type agglutinin coherent protein in Gloudius ussuriensis toxin.Methods Firstly by using IDA-sepharose FF affinity chromatography and sephadex G-100,sephadex G-50 filtration chromatography a new protein from Gloydius ussuriensis toxin has been separated.Results The new protein was idientified by reduction and non-reduction SDS-PAGE electrophovesis.It showed a singular zone and its molecular was 15.7 kD.In the protein biological activity determination,the results found that the protein had procoagulant activity directly and the activity had relevance to promoting its fibrinogen solidfy.They should belong to C-type agglutinin.Conclusion By the separation and purification,a C-type agglutinin coherent protein in Gloudius ussuriensis toxin could be obtained.
Gloydius ussuriensis;C-type agglutinin;separation and purification;vital determination
TQ464.9
A
1005-1678(2012)06-0805-04
2012-07-03
刘 立,男,硕士研究生,高级工程师,研究方向:生物技术药物研究;孙德军,通信作者,E-mail:sundjjl@yahoo.com.cn。
