西红花酸对大鼠脑缺血-再灌注氧自由基及一氧化氮的影响*
2011-12-08谭安雄朱耀斌王玉银
谭安雄,朱耀斌,王玉银
(1.邵阳医学高等专科学校药学系,湖南邵阳 422000;2.湖南交通医院药剂科,长沙 410006;3.中南大学湘雅二医院,长沙 410011)
西红花酸(crocetin)是西红花的主要有效成分之一,具有多不饱和共轭烯酸结构,属类胡萝卜素物质。国内外文献[1-3]报道西红花酸具有抗动脉粥样硬化、改善糖尿病血管病变、抗凝血和抗血栓等作用,对心肌缺血损伤有保护作用。西红花酸对心肌缺血损伤有保护作用,笔者推测其对缺血性脑血管疾病也有一定作用,观察西红花酸对脑缺血-再灌注损伤的保护作用,并探讨其作用机制。
1 资料与方法
1.1 实验动物 清洁级健康雄性SD大鼠120只,体质量260~320 g,购自中科院上海实验动物中心,动物合格证:SCXK(沪)200920056。
1.2 药物及试剂 西红花酸(广州佳科生物科技有限公司产品,批号:09031210,规格:每支10 mg);尼莫地平(山东潍坊制药有限公司产品,批号:090218,规格:每支5 mg)。丙二醛(malonaldehyde,MDA)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、一氧化氮(nitrogen monoxidum,NO)测定试剂盒均由南京建成生物工程研究所提供。氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC),北京化学试剂公司生产。
1.3 动物分组与给药 120只SD大鼠适应性喂养5 d后随机分成6组,即假手术组、模型组、阳性对照组(分别给予尼莫地平溶液5 mg·kg-1)及低、中、高剂量药物组(给予西红花酸10,20,40 mg·kg-1),每组20只。假手术组、模型组给予等容量0.9%氯化钠溶液。各组大鼠均于每日上午灌胃给予0.9%氯化钠溶液或相应药物,每天给药1次,连续给药7次。
1.4 大鼠局灶性脑缺血-再灌注模型的制备 末次给药1 h后,参照文献[4],制备大鼠大脑中动脉阻断再灌注模型。用10%水合氯醛350 mg·kg-1腹腔注射麻醉大鼠,仰卧固定,消毒皮肤,颈部正中切开,钝性分离右侧颈总动脉、颈外动脉和颈内动脉。沿颈内动脉向下分离出翼腭动脉,并结扎。用动脉夹夹闭颈总动脉,于颈外动脉上距其始端约2 mm处剪一切口,将一端烫圆的鱼线沿颈外动脉缓慢插入至大脑中动脉起始端,略感阻力时停止,插入长度18~22 mm。阻断中动脉2 h,轻轻拔出鱼线至颈外动脉处,使大脑中动脉恢复供血,再灌注22 h。假手术组大鼠分离右侧颈总动脉、颈外动脉、颈内动脉及翼腭动脉,结扎翼腭动脉,但不插鱼线阻断大脑中动脉。
1.5 神经损伤症状评分 再灌注22 h,每组取10只大鼠。采用ZeaLonga评分法进行神经功能缺陷评分。0分:未观察到神经功能缺陷症状,活动正常;1分:不能完全伸展手术对侧前肢;2分:爬行时出现向手术对侧转圈;3分:行走时身体向手术对侧倾倒;4分:不能自发行走,昏迷;5分:死亡。
1.6 脑梗死体积比例测定 神经功能行为缺陷评分后将大鼠断头取出全脑,取缺血侧大脑,去除小脑、低位脑干和嗅球,将右脑沿冠状面切成厚度基本相同的5片,脑片置于2%TTC溶液2mL中避光孵育30 min。再将脑片置10%甲醛中固定。数码相机摄相后,应用图像分析仪,测量脑梗死体积比例。
1.7 缺血脑组织中MDA和NO的含量、SOD活性测定 再灌注22 h后,每组取大鼠10只,断头处死,取缺血侧皮质组织,用0.9%氯化钠溶液制备10%脑组织匀浆。按照南京建成生物工程研究所提供的试剂盒说明书测定大脑组织中MDA、NO的含量及SOD活性。
1.8 统计学方法 计量资料以均数±标准差(x±s)表示,多组间均数比较采用单因素方差分析(one-way ANOVA),组间比较采用 LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 西红花酸对大鼠神经症状的影响 假手术组无神经症状,模型组有明显神经症状,西红花酸和尼莫地平能明显降低大鼠神经缺陷评分,与模型组比较差异有统计学意义(P<0.05或 P<0.01),见表1。
2.2 西红花酸对缺血-再灌注大鼠脑梗死体积的影响 与假手术组比较模型组大鼠脑梗死范围明显(P<0.01)。西红花酸和尼莫地平明显降低大鼠脑梗死范围,与模型组比较差异有统计学意义(P<0.05或P<0.01),见表1。
表1 6组大鼠神经功能缺陷评分和脑梗死体积比例Tab.1 The nerve functional defect score and rate of cerebral infarction volume of rats in six groups± s,n=10
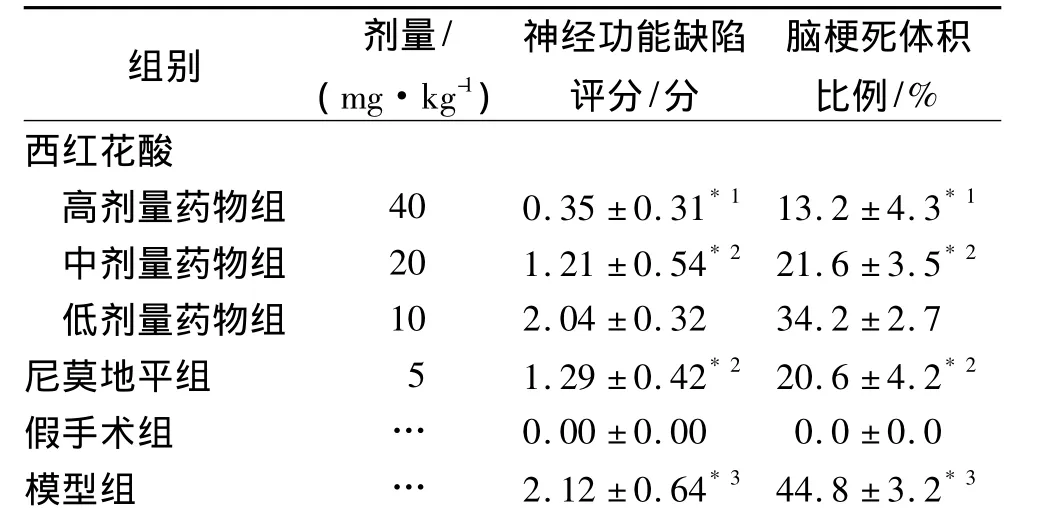
表1 6组大鼠神经功能缺陷评分和脑梗死体积比例Tab.1 The nerve functional defect score and rate of cerebral infarction volume of rats in six groups± s,n=10
与模型组比较,*1 P<0.01,*2 P<0.05;与假手术组比较,*3 P<0.01Compared with the model group,*1 P < 0.01,*2 P < 0.05;Compared with sham operation group,*3 P <0.01
组别 剂量/(mg·kg-1)神经功能缺陷评分/分脑梗死体积比例/%西红花酸高剂量药物组 40 0.35±0.31*1 13.2±4.3*1中剂量药物组 20 1.21±0.54*2 21.6±3.5*2低剂量药物组 10 2.04±0.32 34.2±2.7尼莫地平组 5 1.29±0.42*2 20.6±4.2*2假手术组 … 0.00±0.00 0.0±0.0模型组 … 2.12±0.64*3 44.8±3.2*3
2.3 西红花酸对大鼠缺血脑组织MDA、NO含量的影响 模型组大鼠脑内MDA、NO明显增多,与假手术组比较差异有统计学意义(P<0.01)。西红花酸和尼莫地平能明显降低大鼠脑内MDA、NO含量,与模型组比较差异有统计学意义(P<0.05或P<0.01),见表2。
2.4 西红花酸对大鼠缺血脑组织SOD活性的影响模型组大鼠脑组织SOD活性与假手术组比较明显降低(P<0.01)。西红花酸和尼莫地平能明显增加大鼠脑内SOD活性,与模型组比较差异有统计学意义(P<0.05或P<0.01),见表2。
表2 6组大鼠缺血脑组织MDA、NO含量及SOD活性Tab.2 The content of MDA,NO and the activity of SOD in ischem ic brain tissues of rats in six groups ±s
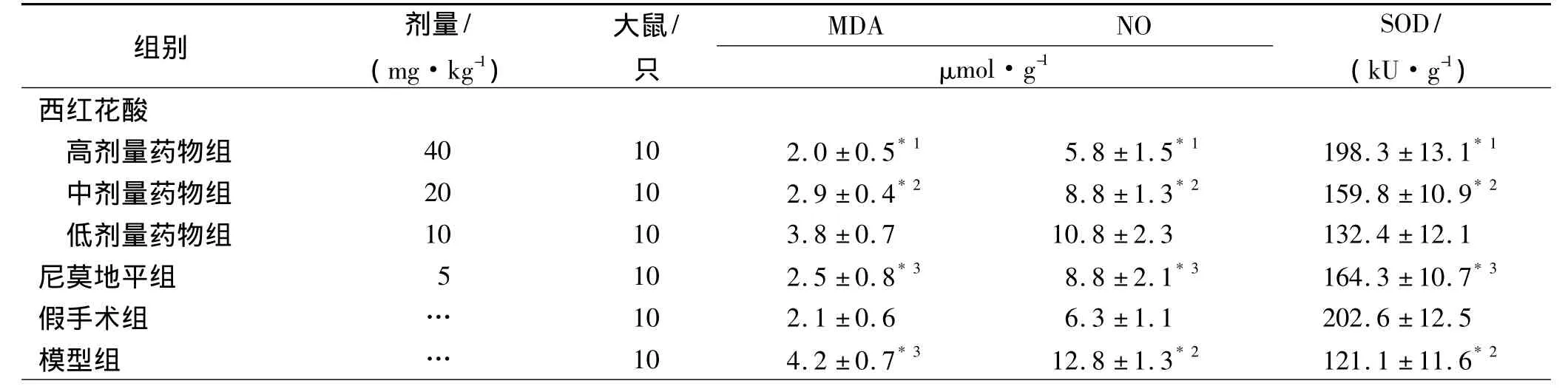
表2 6组大鼠缺血脑组织MDA、NO含量及SOD活性Tab.2 The content of MDA,NO and the activity of SOD in ischem ic brain tissues of rats in six groups ±s
与模型组比较,*1 P<0.01,*2 P<0.05;与假手术组比较,*3 P<0.01Compared with themodel group,*1 P <0.01,*2 P <0.05;Compared with sham operation group,*3 P <0.01
组别 剂量/(mg·kg-1)大鼠/只MDA NO μmol·g-1 SOD/(kU·g-1)西红花酸高剂量药物组 40 10 2.0±0.5*1 5.8±1.5*1 198.3±13.1*1中剂量药物组 20 10 2.9±0.4*2 8.8±1.3*2 159.8±10.9*2低剂量药物组 10 10 3.8±0.7 10.8±2.3 132.4±12.1尼莫地平组 5 10 2.5±0.8*3 8.8±2.1*3 164.3±10.7*3假手术组 … 10 2.1±0.6 6.3±1.1 202.6±12.5模型组 … 10 4.2±0.7*3 12.8±1.3*2 121.1±11.6*2
3 讨论
脑缺血-再灌注损伤的机制十分复杂,目前的研究表明其涉及兴奋性氨基酸毒性、细胞内钙超载、氧自由基毒性、炎性损伤及凋亡的表达等,其中氧自由基在脑缺血-再灌注损伤中占有重要地位。脑缺血-再灌注所产生氧自由基通过作用于细胞膜上不饱和脂肪酸,使细胞膜发生脂质过氧化反应,使质膜破坏和功能障碍;氧自由基可使蛋白质的巯基氧化,形成二硫键,直接损伤蛋白质的结构,抑制蛋白质的功能;氧自由基还可使DNA断裂,破坏核酸及染色体的结构和功能。
脑缺血-再灌注后,大量的氧分子为黄嘌呤氧化酶的核苷酸代谢提供了底物,导致过氧化氢和超氧化物过量产生,自由基清除酶活性降低,消除自由基的功能减弱,使自由基与清除自由基酶之间的平衡失调。MDA是脂质过氧化物中的主要产物,测定MDA可反映机体内脂质过氧化的程度。SOD为抗氧化酶,是体内主要的自由基清除剂,能催化超氧自由基发生歧化反应,保护细胞免受损伤。SOD活力的高低反应机体清除氧自由基的能力,常作为清除氧自由基能力的主要指标。因此,通过测定SOD、MDA可反映脑缺血-再灌注后自由基对脑组织的损伤情况[5]。
NO在脑缺血发病过程中有双重作用[6]。缺血早期血管内皮细胞中的结构型一氧化氮合酶(cNOS)介导产生少量的NO,可扩张血管和抑制血小板聚集,改善脑组织灌流,对缺血脑组织有保护作用。再灌注时,神经胶质细胞中的诱导型一氧化氮合酶(iNOS)介导产生大量的NO则具有神经毒性,可直接或者通过其衍生物导致能量耗竭,损害DNA,抑制DNA合成,诱导细胞调亡。NO可与氧自由基协同作用,导致细胞内钙超载、兴奋性氨基酸细胞毒性作用和酸中毒等一系列变化,导致神经细胞损伤。
本实验显示,模型组大鼠脑缺血-再灌注后出现明显的神经功能障碍、脑梗死范围大,MDA、NO含量增加,SOD活性降低。西红花酸治疗组与模型组比较,神经功能明显改善、脑梗死范围明显减小,MDA、NO含量降低,SOD活性增加。表明西红花酸对脑缺血-再灌注损伤有保护作用,其作用机制可能与提高脑内SOD的活性和降低脑内MDA、NO含量有关。
[1] 寇鑫晖,钱之玉.西红花酸对大鼠心肌缺血-再灌注损伤的保护作用[J].中草药,2008,39(7):1049-1053.
[2] 彭飞城,皋聪,钱之玉.西红花酸对小鼠低氧损伤的保护作用[J].中国新药杂志,2007,16(21):1772-1775.
[3] 向敏,钱之玉,周成华.西红花酸对糖尿病大鼠体内晚期糖基化终产物的形成及其受体表达的影响[J].中国临床药理学与治疗学,2006,11(4):448-452.
[4] LONGA E Z,WEINSTEIN P R,CARLSON S,et al.Reversiblemiddle cerebral artery occlusin without craniect omy in rats[J].Stroke,1989,20:84-91.
[5] 王培源,王海萍,李光武.葛根黄酮对大鼠脑缺血-再灌注损伤的保护作用[J].中国中药杂志,2006,31(7):577-579.
[6] 张丽娟,孔军伶.山茱萸多糖的提取工艺优化及对大鼠局灶性脑缺血-再灌注损伤的保护作用[J].中药材,2007,30(11):1466-1468.
