体外受精-胚胎移植足月妊娠胎盘形态学变化
2011-11-11焦蕊丽徐素欣郝桂敏王振海张杰英
焦蕊丽 徐素欣 郝桂敏 王振海 张杰英
孕妇、胎盘、胎儿三方面间功能有着复杂的关系,导致胎儿发育异常的母体或胎儿因素常可反映在胎盘的形态、胎盘组织光镜与电镜的体视学上。本研究通过对胎盘绒毛在光镜下进行定量分析,在透射电镜下观察比较超微结构,以了解体外受精-胚胎移植(IVF-ET)足月妊娠胎盘与相同孕周自然妊娠胎盘的区别,为IVF-ET围产结局的研究提供理论依据。
1 资料与方法
1.1 一般资料 IVF-ET组:2001年9月至2010年9月经本生殖医学中心行IVF-ET术后足月妊娠孕妇30例,其中原因不明性不孕13例,双侧输卵管梗阻11例,男方少、弱精6例;年龄27~35岁,平均年龄31.8岁;分娩孕周38~41周,平均38.7周(有妊娠高血压综合征、妊娠合并贫血、双胎、三胎及其他慢性疾病者均除外)。对照组:同期在我院产科自然足月妊娠孕妇30例。2组一般资料具有可比性。
1.2 标本采集与处理
1.2.1 胎盘娩出后,立即在胎盘母体面底板区的中间带和中央带不同部位随机取3块组织,在4%戊二醛固定液中切成1 mm3的组织块,经处理后,在日立H-7500型透射电镜下观察及拍照。
1.2.2 同时在胎盘母体面垂直取下约1 cm3的组织,立即投入4%中性甲醛溶液中固定24~48 h,常规处理后待HE染色。
1.2.3 胎盘取材后,自胎盘脐带根部剪除脐带称取胎盘重量,记录新生儿体重。计算胎盘系数(Placental coefficient)。
1.3 结果判定
1.3.1 电镜观察:电镜下观测2组胎盘绒毛合体滋养细胞、微绒毛、细胞滋养细胞、毛细血管等情况。
1.3.2 病理图像分析:请病理科医师用北京航空航天大学图像中心研制的真彩色病理图像分析系统(版本4.0)对切片进行单盲分析,在光镜100×视野下观测绒毛面密度(绒毛面积与总场面积比值);在光镜200×视野下观测单个末梢绒毛横切面内血管直径d及绒毛直径D,血管数n,(D、d测量时选择较短径线,并保持二者测量方向一致);并记算血管与绒毛横切面积之比=d2·n·D-2,每张切片随机选择不同视野观测10个绒毛后取均值。
1.4统计学分析应用SPSS 10.0统计软件,计量资料以±s表示,采用t检验,另外对胎盘重量和新生儿体重进行线性相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 胎盘绒毛组织定量分析 IVF-ET组与对照组比较,不仅胎盘末梢绒毛血管数减少,血管占绒毛横切面积比减小(P<0.05),而且IVF-ET组胎盘绒毛面密度降低(P <0.01)。见表1。
表12组胎般绒毛组织定量分析n=30,±s

表12组胎般绒毛组织定量分析n=30,±s
注:与 IVF-ET 组比较,*P <0.05
组别 末梢绒毛血管数(个)血管占绒毛面积比(横切面)绒毛面密度(绒毛面积与总面积比)IVF-ET组3.4 ±1.5 0.29 ±0.16 0.37 ±0.05对照组 4.5 ±2.4* 0.34 ±0.16*0.47 ±0.06
2.2 超微结构观察
2.2.1 对照组胎盘绒毛的超微结构:绒毛各层结构清晰,合体滋养层细胞位于绒毛浅层。具有多核,核的异染色质粗大,胞质中有很多大小不等大空泡,呈泡沫状。可见较丰富的粗面内质网、游离核糖体。合体细胞的游离面有排列整齐的微绒毛,尖端为球形膨大,并有分支。在微绒毛之间有胞膜内陷形成的小凹,合体细胞与细胞滋养细胞之间有桥粒连接(图1)。细胞滋养细胞呈立方形或多边形,位于绒毛深层,胞质内线粒体大而多,核内异染色质少而分散,电子密度低(图2),绒毛间质可见丰富的毛细血管,壁薄,腔内可见胎儿红细胞(图3、4)。
2.2.2 IVF-ET组胎盘绒毛的超微结构:合体滋养细胞游离面微绒毛疏密不均,排列紊乱,融合、变形甚至缺失(图5)。细胞滋养细胞胞质内线粒体减少,体积小,游离核糖体减少(图6)。毛细血管壁增厚,腔窄(图7、8),绒毛间质纤维化,甚至发生玻璃样变(图9)血管内皮细胞胞质内线粒体肿胀,嵴排列紊乱,部分或全部嵴消失,吞饮小泡数量减少。间质内可见胶原纤维增生,成纤维细胞内粗面内质网减少,高尔基复合体不发达,线粒体小而少。

图1 对照组合体细胞的游离面有排列整齐的微绒毛(TEM×3 500)

图5 IVF-ET组合体滋养细胞游离面微绒毛排列缺失(TEM×6 000)

图2 对照组细胞滋养细胞胞质内线粒体大而多(TEM×2 500)

图6 IVF-ET组细胞滋养细胞线粒体少(TEN×6 000)

图3 对照组绒毛间质可见丰富的毛细血管,壁薄,腔内可见胎儿红细胞(TEM×3 500)

图7 IVF-ET组绒毛间质毛细血管壁增厚,腔窄(TEM×3 000)
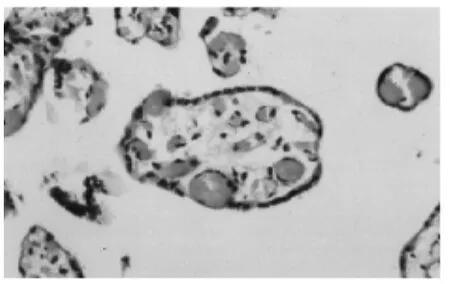
图4 对照组绒毛间质可见丰富的毛细血管,壁薄,腔内可见胎儿红细胞(HE×400)

图8 IVF-ET组绒毛间质毛细血管壁增厚,腔窄(HE×400)

图9 IVF-ET组胎盘绒毛毛细血管壁发生玻璃样变(HE×200)
2.3 2组新生儿体重及胎盘重量结果 IVF-ET组胎盘重量和新生儿体重与对照组比较差异无统计学意义(P>0.05),新生儿出生体重与胎盘重量呈高度相关性(r=0.709,P <0.01)。见表2。过程中研究发现在促超排卵药物作用后,血清EGFs(所有能与EGFR结合的物质含量的总和,主要包括EGF和TGF-α)水平显著升高(P<0.01),其在卵泡液内的水平明显高于同期血清水平(P<0.05),表明促性腺激素可能存在刺激EGFs分泌的作用。
研究表明,IUGR胎盘上EGFR的表达较正常对照组明显增加,IUGR胎盘末梢绒毛血管数及血管与绒毛横面积之比均明显减少,提示IUGR胎盘上EGFR的表达增加可能与其胎盘绒毛发育不良有关[7,8]。
焦蕊丽等[9]曾报道EGFR在IVF-ET后足月妊娠组胎盘中表达高于对照组(P<0.05)。故而我们推测:可能由于COH药物作用或黄体支持中母体体内超生理剂量孕酮的作用使IVF-ET组孕妇体内激素或细胞因子的平衡紊乱,导致EGFR在IVF-ET后足月妊娠组胎盘中表达高于对照组。
表22组新生儿体重及胎盘重量比较n=30,±s
组别 胎盘重量(g) 新生儿体重(g) 胎盘系数(F/P)IVF-ET组542 ±152 3 265 ±519 6.3 ±1.3对照组477 ±69 3 133 ±295 6.6 ±0.7
3 讨论
3.1 正常胎盘结构与功能 胎盘是母体和胎儿之间进行物质交换的重要器官,它的功能包括气体交换、营养物质供应、排除胎儿代谢产物、合成防御等。众所周知,胎盘的物质交换主要部位在胎盘的血管合体膜(vasn/osyncycial mcmberane,VSM),即由合体细胞、合体细胞基底膜、绒毛间质、毛细血管基底膜及毛细血管内皮细胞五层组织所构成薄膜,厚度不到2 μm,此膜总交换面积的大小及其功能正常与否,对胎儿在宫内生长发育十分重要[1]。正常足月胎盘中约88%的绒毛合体滋养细胞表面,均有发育良好的微绒毛覆盖[2]。微绒毛的出现,增加了滋养细胞与母血接触的表面积,促进了母儿间的物质交换。正常妊娠时,随着孕周进展,子宫胎盘发生一系列的生理性改变,胎盘绒毛直径明显变小,这样明显增加了母-胎间血氧交换的绒毛总面积,绒毛内血管充血扩张,细胞滋养细胞稀少甚至缺如,合体滋养细胞成为晚孕绒毛的主要结构和功能细胞,聚集形成多细胞结节,这种结构有利于母-胎间的气体交换。
3.2 IVF-ET胎盘形态学变化及意义 本研究中病理真彩色图像分析:与对照组比较,IVF-ET组胎盘末梢绒毛内不仅毛细血管数少,血管占绒毛横切面积减少,而且绒毛面密度也减小;此外,可见IVF-ET组胎盘绒毛毛细血管壁增厚,腔窄,绒毛间质纤维化,甚至发生玻璃样变。提示IVF-ET组胎盘绒毛较正常组胎盘绒毛存在某种程度增生的表现。
我们在电镜下发现:与对照组相比较,IVF-ET组胎盘合体滋养细胞表面游离微绒毛疏密不均、变形,甚至缺失。细胞滋养细胞线粒体及游离核糖体减少,毛细血管壁发生不同程度增厚,绒毛间质发生纤维化。以上绒毛结构的变化可造成VSM厚度增加,母-儿间有效交换面积减少,影响营养物质的摄取和转运[3-5]。
研究发现在黄体期孕激素可促进表皮生长因子受体(EGFR)mRNA的过度表达,魏志新等[6]在控制性超促排卵(COH)
本研究IVF-ET组胎盘重量与新生儿体重与对照组比较均稍重,但差异无统计学意义(P >0.05),这与钟依平等[10]报道结果一致。故而我们推测:(1)该研究可能由于样本小,差异无统计学意义(P>0.05);(2)由于新生儿体重受多种因素影响,如:孕妇营养、胎盘功能、病毒感染等,IVF-ET妊娠胎儿为珍贵儿,被归为高危妊娠,受到产科医师及家人的高度重视,孕妇受到的围产保健及营养可能较自然妊娠的胎儿更好,所以尽管2组胎盘绒毛结构有差异,但胎盘重量与新生儿体重比较差异无统计学意义(P>0.05)。以上结论为IVF-ET围产结局的研究提供了理论依据和新的思路。
1 Stallmach T,Mumenthaler C,Hebisch G,et al.Fetomaternal interface of human placentainhibitsangiogenesisin the chick chorioallantoic membrane(CAM)assay.Angiogenesis,2001,4:79-84.
2 Mochizuki M,Maruo T,Matsuo H,et al.Biology of human trophoblast.Int J Gynaecol Obstet,1998,60:21-28.
3 Bonkobara M,Thongsong B,Ohmori T,et al.Effects of epidermal growth factor on placental amino acids uptake in pregnant rats.J Vet Med Sci,2002,64:689-692.
4 李芳,赵三存,杨少毅.妊高症胎盘组织超微结构病理变化与胎儿宫内发育关系探讨.山西医学杂志,2000,29:424-425.
5 李贵瑜,孙长学.胎盘表皮生长因子受体的表达改变与胎儿宫内生长迟缓的关系研究.中国实用妇科与产科杂志,2000,18:29-31.
6 魏志新,张丽珠,李美芝,等.促超排卵周期表皮生长因子对人卵泡发育的调节.中华妇产科杂志,1997,32:87-89.
7 刘锡梅,尉红.IUGR的胎盘病理改变及胎盘EGFR免疫组化分析.中国优生与遗传杂志,2005,13:37-38.
8 赵惠.IUGR的胎盘病理改变及胎盘EGFR免疫组化分析.山东医学高等专科学校学报,2010,32:81-84.
9 焦蕊丽,徐素欣,郝桂敏.体外受精-胚胎移植足月妊娠胎盘中表皮生长因子受体的表达.河北煤炭医学院学报,2008,10:3-4.
10 钟依平,周灿权,庄广伦.体外受精与胚胎移植术后妊娠的围生情况.中山医科大学学报,2000,21:229-232.
