多倍体黄精中多糖和皂苷的提取及含量测定△
2011-11-07喻祖文张旺凡
喻祖文,张旺凡
(湖南中医药高等专科学校,湖南 株洲 412012)
多倍体黄精中多糖和皂苷的提取及含量测定△
喻祖文,张旺凡*
(湖南中医药高等专科学校,湖南 株洲 412012)
目的:比较1年生人工栽培多倍体(四倍体)黄精与1年生人工栽培二倍体黄精、4年生野生二倍体黄精中多糖以及皂苷的含量。方法:多糖采用索氏抽提法提取,蒽酮硫酸比色法测定含量;总皂苷采用超声波提取法提取,香草醛高氯酸比色法测定含量。结果:以葡萄糖计,4年生野生二倍体黄精、1年生人工栽培多倍体黄精以及1年生人工栽培二倍体黄精中多糖含量分别为17.7%、18.6%和17.0%;以人参皂苷Rb1计,4年生野生二倍体黄精、1年生人工栽培多倍体黄精以及1年生人工栽培二倍体黄精中总皂苷含量分别为7.5%、7.5%和3.6%。结论:1年生人工栽培多倍体黄精主要活性成分(多糖和皂苷)的含量接近或略高于4年生野生二倍体黄精,皂苷含量明显高于1年生人工栽培二倍体黄精。
多倍体黄精;多糖;皂苷;含量测定
多花黄精Polygonatum cyrtonemaHua系百合科黄精属植物,是 《中国药典》2010年版收载的3种作药用的黄精品种之一。主要含多糖、低聚糖、黄酮、蒽醌、皂苷、木脂素、生物碱和氨基酸等物质。有补气养阴,健脾,润肺,益肾功能。多花黄精是一种药食兼用植物[1],随着应用的拓宽,野生资源将供不应求,人工栽培因生产周期长,产量较低尚未形成规模。采用人工诱变染色体加倍的方法改良黄精种质,是高产栽培的一条有效途径。2006年起,在湖南省科技厅、教育厅的资助下,作者用多花黄精作材料,采用离体培养愈伤组织,秋水仙素处理加倍方法进行多倍体诱导,已经获得四倍体株系[2]。
为评价多倍体黄精的品质,为开发利用提供理论依据,对其主要活性成分——黄精总多糖和总皂苷含量进行了测定,并与1年生栽培二倍体、4年生野生二倍体进行比较,1年生多倍体黄精总多糖含量达到18.6%,略高于4年生野生黄精,总皂苷含量为7.5%,与野生品接近,但明显高于1年生二倍体栽培品。
1 材料与方法
1.1 材料及预处理
多花黄精,其中人工栽培多倍体(四倍体)与人工栽培二倍体均为1年生,野生二倍体为4年生,采自湖南平江县海拔300 m左右的山丘。所有测试材料处理方式相同:取新鲜的地下茎洗净,切片,于55~60℃烘干至恒重,粉碎,过80目筛,备用。
1.2 仪器与试剂
仪器:UV756CRT紫外可见分光光度计(上海佑科仪器仪表有限公司),KQ-250B型超声波发生器(昆山市超声仪器有限公司),万分之一电子分析天平(梅特勒),索氏提取器,恒温水浴锅,容量瓶,抽滤装置,移液管。
试剂:葡萄糖标准品和人参皂苷Rb1对照品(购于上海鼎瑞生化试剂公司),蒽酮、香草醛、高氯酸、冰醋酸、浓硫酸、无水乙醇、无水甲醇等试剂均为国产分析纯。
2 方法
2.1 多糖的提取与含量测定[3-5]
2.1.1 多糖的提取 准确称取3种黄精样品干粉各2.0 g,分别置于索氏提取器中,用200 mL无水乙醇抽提2 h除去脂溶性成分,挥干乙醇后再用200mL蒸馏水索氏提取3 h,抽滤,滤液在容量瓶中定容至250mL,再吸取上述溶液2.5mL稀释至25mL,备用。2.1.2标准曲线 准确称取干燥至恒重的葡萄糖标准品0.100 0 g于一个干净的小烧杯中,用蒸馏水溶解并定量转移至100 mL的容量瓶中,稀释至刻度,摇匀。此溶液浓度为1.0 mg·mL-1。分别吸取1.0 mg·mL-1的葡萄糖标准溶液1.0,2.0,3.0,4.0,5.0,6.0 mL于6个50 mL的容量瓶中,用蒸馏水定容,摇匀。再分别吸取上述溶液各2 mL于6支具塞刻度试管中,另准备1支试管加2 mL蒸馏水作为空白管,往以上7支试管中再各加蒽酮硫酸试剂6 mL,摇匀后置于沸水浴中加热15 min,冷却后于625 nm波长处用1 cm吸收池测定吸光度。
2.1.3 样品测定 分别吸取稀释后的样品溶液1 mL于具塞刻度试管中,各加1 mL水,再各加蒽酮硫酸试剂6 mL,摇匀后置于沸水浴中加热15 min,冷却后于625 nm波长处用1 cm吸收池测定吸光度,样品均平行测定3次,按照回归方程计算出多糖含量。
2.2 皂苷的提取与含量测定[6-7]
2.2.1 皂苷的提取 准确称取3种黄精样品干粉各1.0 g,分别置于3只具塞锥形瓶中,加入80%乙醇溶液30 mL,置于60℃恒温下超声波提取3 h,抽滤,滤液在容量瓶中定容至50 mL,备用。
2.2.2 标准曲线 准确称取10.0 mg人参皂苷Rb1对照品于一个干净的小烧杯中,用无水甲醇溶解并定量转移至10 mL的容量瓶中,稀释至刻度,摇匀。此溶液浓度为1.0mg·mL-1。分别吸取1.0mg·mL-1的人参皂苷 Rb1对照品溶液 0,0.1,0.2,0.3,0.4,0.5 mL于6支具塞刻度试管中,挥尽溶剂,各加入0.2 mL 5%香草醛冰醋酸溶液和0.8 mL纯高氯酸,摇匀,置于60℃水浴中加热15 min,冷却后再各加冰醋酸5 mL,摇匀,放置10 min后于568 nm波长处用1cm吸收池测定吸光度。
2.2.3 样品测定 分别吸取各样品溶液0.1 mL于具塞刻度试管中,挥尽溶剂,各加入0.2 mL 5%香草醛冰醋酸溶液和0.8 mL纯高氯酸,摇匀,置于60℃水浴中加热15 min,冷却后再各加冰醋酸5 mL,摇匀,放置10 min后于568 nm波长处用1 cm吸收池测定吸光度,样品均平行测定3次,按照回归方程计算出总皂苷含量。
3 结果与分析
3.1 多糖的含量测定
3.1.1 葡萄糖标准曲线的绘制 不同浓度葡萄糖标准溶液的吸光度测定结果见表1。

表1 不同浓度葡萄糖标准溶液的吸光度
根据表1中的测定结果绘制出葡萄糖标准溶液浓度与吸光度的标准曲线,如图1所示。由图1得出吸光度A对浓度c的回归方程为:A=4.506 3c-0.003 5,r=0.999 7。
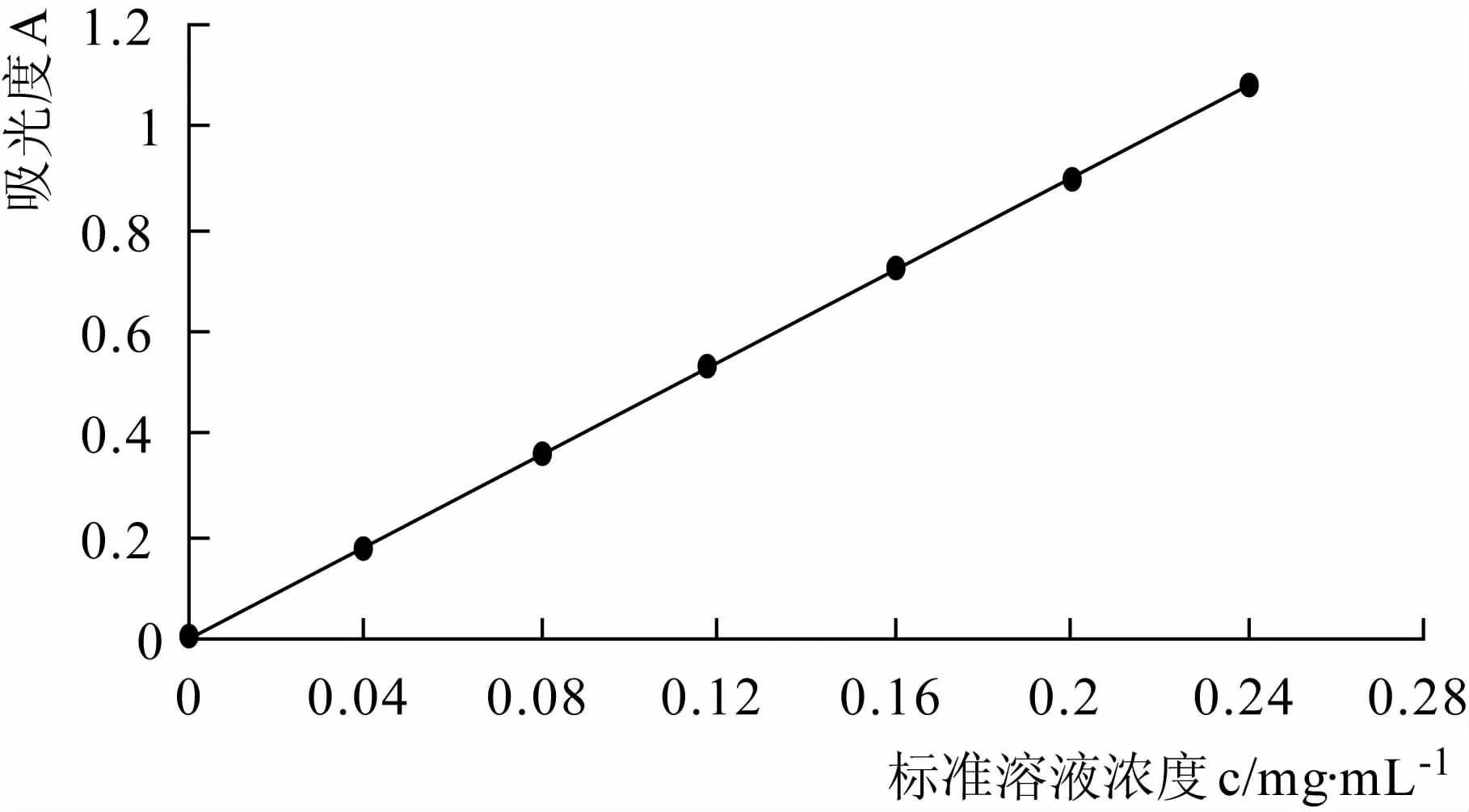
图1 葡萄糖标准溶液浓度与吸光度的标准曲线
3.1.2 多糖的含量 各样品吸光度以及按照回归方程计算出的多糖含量结果见表2。从表2可以看出,以葡萄糖计,4年生野生二倍体黄精、1年生人工培植多倍体(四倍体)黄精以及1年生人工培植二倍体黄精中黄精多糖含量分别为17.7%、18.6%和17.0%,多倍体(四倍体)黄精多糖含量略高于另两者,经采用统计学t检验法检验无显著性差异。另外,所测定的吸光值有所偏高,这可能是材料烘干时温度偏高而引起提取液颜色加深所致。

表2 3种样品黄精多糖含量测定结果
3.2 皂苷的含量测定
3.2.1 人参皂苷Rb1标准曲线的绘制 不同浓度人参皂苷Rb1对照品溶液的吸光度测定结果见表3。

表3 不同浓度人参皂苷Rb1对照品溶液的吸光度
根据表3中的测定结果绘制出人参皂苷Rb1对照品溶液浓度与吸光度的标准曲线,如图2所示。由图2得出吸光度A对浓度c的回归方程为:A=3.213 1c-0.002 3,r=0.999 8。

图2 人参皂苷Rb1对照品溶液浓度与吸光度的标准曲线
3.2.2 皂苷的含量 各样品吸光度以及按照回归方程计算出的总皂苷含量结果见表4。

表4 3种样品黄精皂苷含量测定结果
从表4可以看出,以人参皂苷Rb1计,4年生野生二倍体黄精、1年生人工栽培多倍体(四倍体)黄精以及1年生人工栽培二倍体黄精中总皂苷含量分别为7.5%、7.5%和3.6%,1年生多倍体(四倍体)黄精总皂苷含量与4年生野生二倍体黄精相近,比1年生人工栽培二倍体黄精高出一倍多,经采用统计学t检验法检验存在显著性差异。
4 结论
1年生人工栽培多倍体黄精主要活性成分(多糖和总皂苷)的含量接近或略高于4年生野生二倍体黄精,皂苷含量明显高于1年生人工栽培二倍体黄精。人工诱导的多倍体黄精的品质符合药用质量要求。多倍体黄精中其他成分如黄酮、蒽醌、木质素、氨基酸、微量元素等含量,特别是多糖中各种成分的比例以及皂苷中各种皂苷成分的含量有待进一步深入研究。
[1]石林,蒙义文,李伟,等.黄精及黄精多糖的药理研究[J].天然产物研究与开发,1999,11(3):69-73.
[2]张旺凡,冯务群,晁志,等.黄精多倍体诱导初报[J].中国种业,2011,(1):48-49.
[3]陈兴荣,何正春,张玲玉.滇黄精多糖的提取分离及含量测定[J].中国民族民间医药,2009,18(23):14.
[4]候双菊,林超群,鲁坚,等.黄精多糖提取工艺的试验研究[J].安徽化工,2006,(4):20-22.
[5]王冬梅,宋旭辉,李娟丽,等.卷叶黄精多糖提取分离工艺研究[J].西北林学院学报,2005,21(6):158-161.
[6]范书珍,陈存武,王林.多花黄精总皂甙的提取研究[J].皖西学院学报,2005,10(5):39-41.
[7]王冬梅,朱玮,张存莉等.卷叶黄精总皂苷含量测定方法及提取工艺研究[J].西北林学院学报,2006,21(3):107-110.
The Extraction and Eeterm ination of Polyp loid Main Active Ingredients of Polygonatum
YU Zu-wen,ZHANGWang-fan
(Hunan College of Traditional Chinese Medicine,Zhuzhou 412012,China)
Objective:To compare the polyploid(tetraploid)and the age of Polygonatum Polygonatum cultivated and wild diploid contentof polysaccharides and saponins.Methods:The polysaccharide extracted by Soxhletextraction method.Determination of anthrone sulfuric acid content;total saponins extracted by ultrasonic extractionmethod,Determination of vanillin content in perchloric acid.Results:The glucose of4 years old wild diploid Huang Jing,1 year old and cultivated polyploid Polygonatum Polygonatum age of cultivated diploid content of polysaccharides was 17.7%,18.6%and 17.0%;the total ginsenoside Rb1,4 years Polygonatum wild diploid,cultivated polyploid 1 year old and the age of Polygonatum Polygonatum cultivated diploid content of total saponins were 7.5%,7.5%and 3.6%.Conclusion:The artificial cultivation of themain active ingredients of polyploid Polygonatum(polysaccharides and saponins)were close to or slightly higher than thewild diploid Huang Jing,saponin contentwas significantly higher than that of cultivated diploid Polygonatum.
Determination of polyploid Huang Jing;Polysaccharides;Saponins
湖南省科技厅科技基金项目(06sk3089),湖南省教育厅科技基金项目(06c065)
*张旺凡,Email:zwf555@21cn.com
2011-01-30)
