逆流色谱和超滤分级法分离海带多糖的研究
2011-10-09宋广磊杜琪珍
宋广磊,杜琪珍
(浙江工商大学食品与生物工程学院,浙江杭州310035)
逆流色谱和超滤分级法分离海带多糖的研究
宋广磊,杜琪珍
(浙江工商大学食品与生物工程学院,浙江杭州310035)
研究了逆流色谱分离海带多糖,超滤法对分离的多糖进行纯化的方法,取得了较好效果。采用中心组合实验设计的方法筛选出了逆流色谱分离海带多糖的溶剂系统为:12%PEG1000,8%KH2PO4和8%K2HPO4,转速为400r/min。利用此参数条件从海带多糖中分离得到两种多糖KPS-1和KPS-2,纯度分别为87.5%和89.6%。对分离后的海带多糖组分KPS-1和KPS-2进行超滤纯化分级,从KPS-1中获得了KPS-1-1和KPS-1-2两种多糖;从KPS-2中获得了KPS-2-1和KPS-2-2两种多糖。HPLC分析结果表明,超滤分级可使海带多糖组分KPS-1和KPS-2达到纯化目的,效果较好。
逆流色谱,溶剂系统,超滤,多糖
逆流色谱(Countercurrent chromatography,CCC)技术是一种无固体载体的连续液-液分配色谱技术,其固定相通过重力场和离心力场作用被保留在分离柱内,流动相与固定相在色谱仪内进行分配,而达到物质的分离[1-3]。逆流色谱与传统色谱相比具有无死吸附、进样量大、分离纯度高等显著的优势,在食品、生物化工、制药等领域具有广阔的应用前景。多糖是生命物质的组成成分之一,大量药理及临床研究证实:多糖有调节免疫[4-5]、抗癌[6-7]、抗炎[8]、提高上皮细胞活性[9]以及促进伤口愈合[10]等生理功能,可广泛应用于医药、保健品及功能食品。海带多糖具有抗肿瘤、抗高血脂、降血糖等各种生物活性。利用逆流色谱分离和超滤分级的方法分离纯化海带多糖的研究还未见文献报道。
1 材料与方法
1.1 材料与仪器
海带多糖 购于陕西西安小草植物有限公司;PEG1000、K2HPO4、KH2PO4、钼酸钠、浓硫酸、浓硝酸、甲醇、乙醇、丙酮、氯仿、氨水、葡萄糖、柠檬酸、喹啉、苯酚、三氯乙酸等 均为分析纯,购自杭州华东化学试剂有限公司;液相色谱所用水 娃哈哈纯净水;TLC板 20×20cm Sillca gel 60 F254,德国Merck;滤膜 0.45!m,Automatic Science Instrument Co.,LTD.。
3K3 0台式高速冷冻离心机 美国 SIGMA;VIS-723G型可见分光光度计 北京瑞利分析仪器公司;LC-10A液相色谱仪 日本 SHIMADZU;SEDEX75蒸发光检测器 法国 SEDEX;ZJGSUD400X制备型高速逆流色谱仪 浙江工商大学食品与生物工程研究所研制;Preparative HPLC Pump K-1800恒流泵 德国KNAUER;B-684自动部分收集器 瑞士 BüCHI;minifilter-200超滤仪 美国PALL;RE52CS旋转蒸发仪、B-220恒温水浴锅 上海亚荣生化仪器厂;SHZ-D-!循环水式真空泵 河南巩义市英峪豫华仪器厂;DLSB低温冷却液循环泵郑州长城科工贸有限公司;FD-1冷冻干燥机 北京博医康技术公司;KQ5200E超声仪 昆山市超声仪器有限公司;GZX-9240MBE鼓风干燥箱 上海博讯实业有限公司医疗设备厂。
1.2 实验方法
1.2.1 海带多糖的精制 海带多糖,加入10倍60℃
热蒸馏水溶解。冷却后4000r/min离心10min除去不溶物。所得溶液用70℃减压浓缩至体积的1/5,放冷,5000r/min离心10min,上清液继续浓缩至呈稠膏状,加入4倍体积无水乙醇,边加边搅拌,静置过夜后4000r/min离心10min,倾去上清液,余下部分加5倍量的2%三氯乙酸除蛋白,4000r/min离心10min,取上清液进行紫外扫描(200~400nm),若无紫外吸收说明无蛋白,若有紫外吸收则继续脱蛋白,直至无紫外吸收,然后溶液用5倍量无水乙醇沉淀,沉淀冷冻干燥,得精制海带多糖[11-13]。
1.2.2 多糖含量的测定 采用苯酚-硫酸法测定多糖含量[14-15]。其原理是糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物,在一定范围内其颜色深浅与糖的含量成正比,
且在485nm波长下有最大吸收峰。苯酚法可用于甲基化的糖、戊糖和多聚糖的测定,灵敏度高,实验时基本不受蛋白质存在的影响。
1.2.3 逆流色谱溶剂系统的选择 逆流色谱(CCC)的组成见图1。
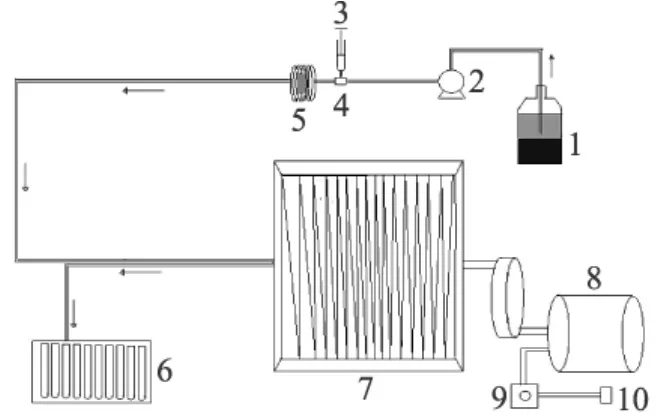
图1 逆流色谱仪系统
溶剂系统是实现逆流色谱分离的关键。溶剂系统配制后充分混合均匀,静止分层。以上层为固定相,下层为流动相。用泵把固定相从进口注入HSCCC分离柱中,待固定相充满后,开动主机,调节转速达到预定转速并稳定后,用20mL固定相溶解0.15g精制多糖,用恒流泵将样品溶液以一定流速注入HSCCC,部分收集器收集。分离完成后,停止转动。用气泵使HSCCC中的液体流出。苯酚-硫酸法测定多糖在上下相中的浓度,计算固定相分配系数(K),根据上下相的体积计算保留率(SF)[16-17]。采用中心组合实验设计方法(因素水平编码表见表1),设计了36种不同的分离条件(见表2),根据分离情况筛选最佳条件作为实验分离的条件。

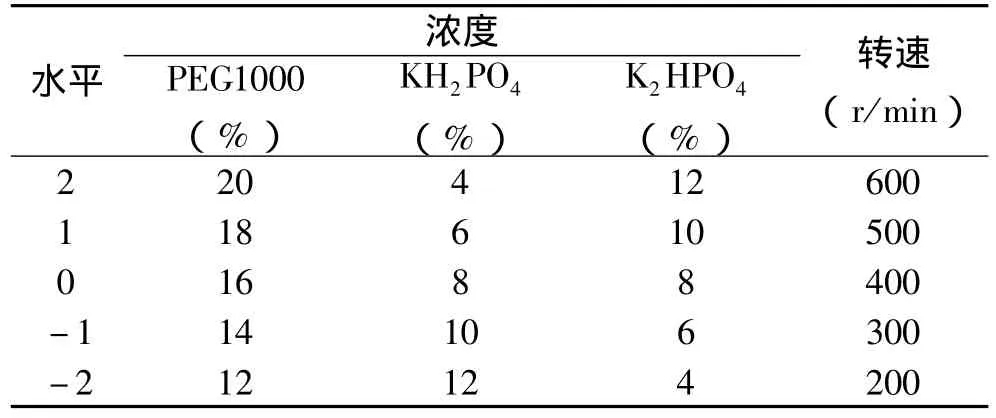
表1 实验因素和水平编码对照表
1.2.4 TLC检测方法 将TLC薄板切割成10cm×5cm的大小,在距离薄板底部0.5cm划一横线,横线上每隔0.5cm点样,用0.5mm毛细管点样一次,配制正丁醇∶乙醇∶水=5∶3∶2,放于4℃冰箱中,展开时取下层4mL放于展缸,同时加0.05mL浓氨水,混匀,进行展开。乙醇∶浓硫酸=1∶9的溶液为显色剂,120℃电炉上显色[18]。
1.2.5 超滤分级纯化方法[19-21]收集逆流色谱分离的多糖组分用半透膜进行脱盐、脱PEG。半透膜采用截留分子量8000~14000Da的透析,流水透析3昼夜,喹钼柠酮法测定无磷酸根离子存在时即停止透析。
为防止杂质污染超滤膜,导致超滤浓缩效率下降,超滤前将透析后的组分用0.45"m滤膜过滤,以降低对膜的污染。超滤膜采用透过分子量为30×103Da和50×103Da的滤膜进行超滤。
超滤时先将待过滤液装入量杯,泵流速20mL/min,压力1.5MPa,过滤前后分别测定多糖浓度,比较多糖的损失情况,结果见表3。处理过程流程图见图2。
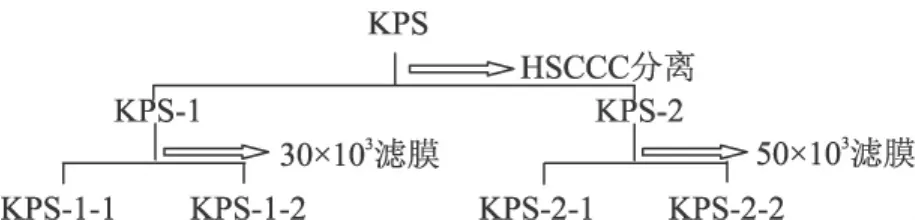
图2 逆流色谱和超滤分级流程图
1.2.6 HPLC法检测多糖纯度[22-24]用HPLC法测定多糖的分离效果。岛津LC-10A液相色谱仪,检测器为SEDEX75蒸发光检测器,色谱柱为Shodex TSK G-5000 PWxl凝胶柱(5m,300mm×1.5mm I.D.,Kyoto,Japan),流动相为纯净水,流速0.8mL/min,柱温为35℃,漂移管温度为80℃,压力3.5bar,进样量10"L。
2 结果与分析
2.1 海带多糖精制得率
在精制过程中发现海带粗多糖中有少量杂质和不溶物,这些杂质和不溶物在离心和溶解过程中都可除去。用2%三氯乙酸进行脱蛋白时,在溶液底部发现有少量沉淀,可知海带多糖中含有少量蛋白。实验发现海带中的蛋白一般用2%三氯乙酸作用一昼夜就可除去。海带多糖49.3626g经精制后得精制多糖33.4261g,得率67.71%,纯度56.02%。
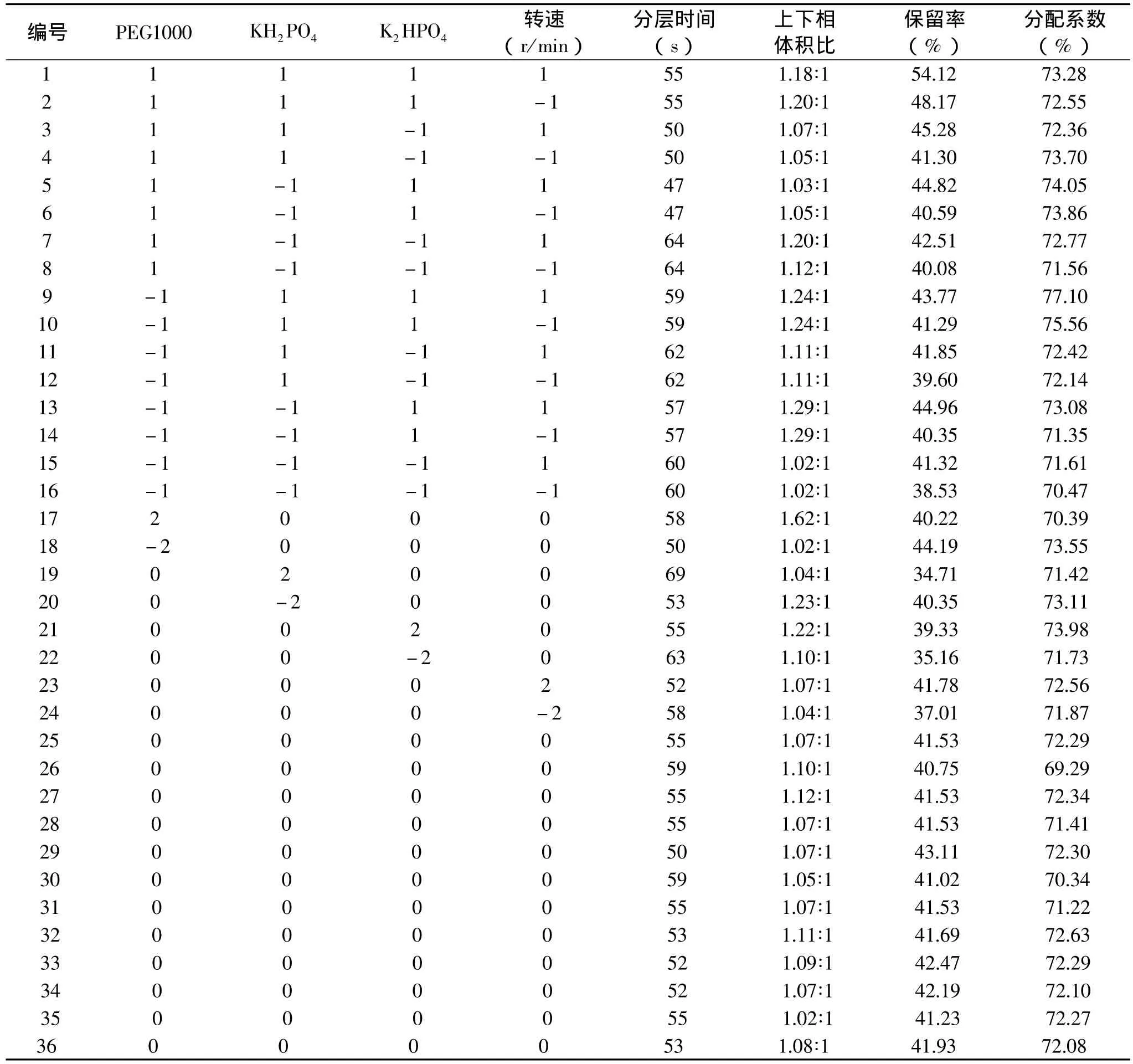
表2 逆流色谱分离系统四因素五水平中心组合实验设计及结果
2.2 逆流色谱分离条件
逆流色谱分离的效果主要取决于样品在固定相与流动相之间的分配系数K和固定相保留率SF。其中后者又主要受溶剂系统分层时间以及逆流色谱仪转速、流动相流速、实验温度等逆流色谱参数的影响。因此,在溶剂系统既定的情况下,选择适宜的逆流色谱工艺参数至关重要。
一般来说,保留率SF随转速增加而不断上升,但同时也需要考虑仪器的稳定性,因此在仪器所能承受的限度内尽量选择较大转速。而随流速的增大,保留率SF不断下降,但是流速过低会导致分离时间过长,分离效率降低[17]。综合考虑,实验中采用400r/min的转速和1.0mL/min的流速。在不同的逆流系统条件下,各溶剂系统的情况见表2。
2.3 逆流色谱分离结果
各分离系统的分离情况用TLC检测方法进行检测。经比较采用系统18的分离效果较好,见图3。在 PEG1000含量为 12%,K2HPO4含量为 8%,KH2PO4含量为8%时,可使海带多糖达到分离。
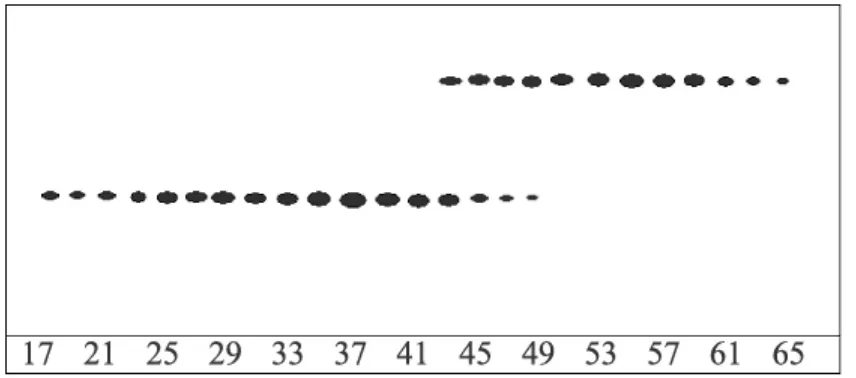
图3 逆流色谱分离海带多糖TLC图谱
收集17~41管组分和51~65管组分,并分别命名为KPS-1和KPS-2。将获得的组分KPS-1和KPS-2用8000~14000Da透析袋进行连续透析72h、减压旋转蒸发浓缩、冷冻干燥得海带多糖组分KPS-1 64.1mg和KPS-2 52.7mg。各精确称5mg KPS-1和
定量至50mL,苯酚-硫酸法测定多糖含量。测得KSP-1和KSP-2含量分别为87.5%和89.6%,纯度有了很大提高。HPLC图见图4、图5。由图4、图5可看出,HPLC图谱顶端有峰未分开,推测可能有相似的多糖组分未分离。
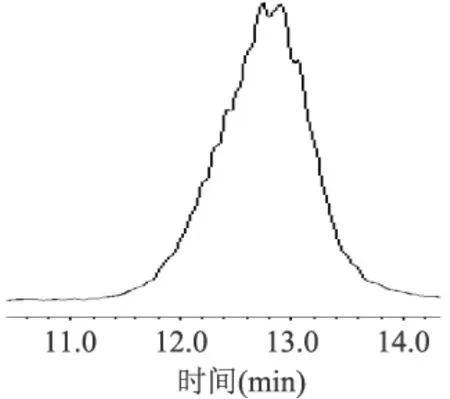
图4 KPS-1 HPLC图谱
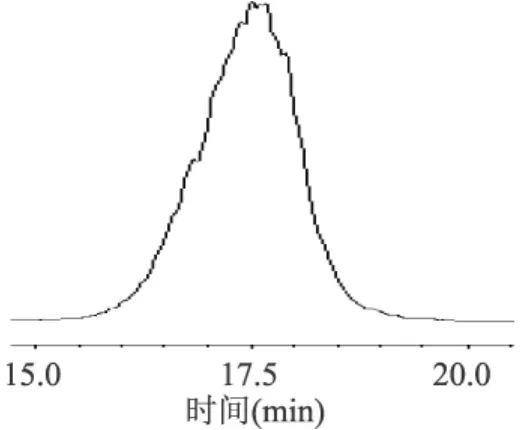
图5 KPS-2 HPLC图谱
2.4 预处理及超滤分级效果
将得到的KPS-1和KPS-2溶于50.00mL蒸馏水中,然后分别用30×103Da和50×103Da超滤膜超滤,苯酚-硫酸法测定各溶液的浓度,结果见表3。KPS-1经30×103Da滤膜过滤后得滤液29.4mL,记作KPS-1-1,非滤过液18.3mL,记作KPS-1-2;KPS-2经50×103Da超滤膜超滤后得滤液28.6mL,记作KPS-2-1,非滤过液17.7mL,记作KPS-2-2。KPS-1-1、KPS-1-2、KPS-2-1、KPS-2-2分别用HPLC进行纯度检验,见图6~图9。
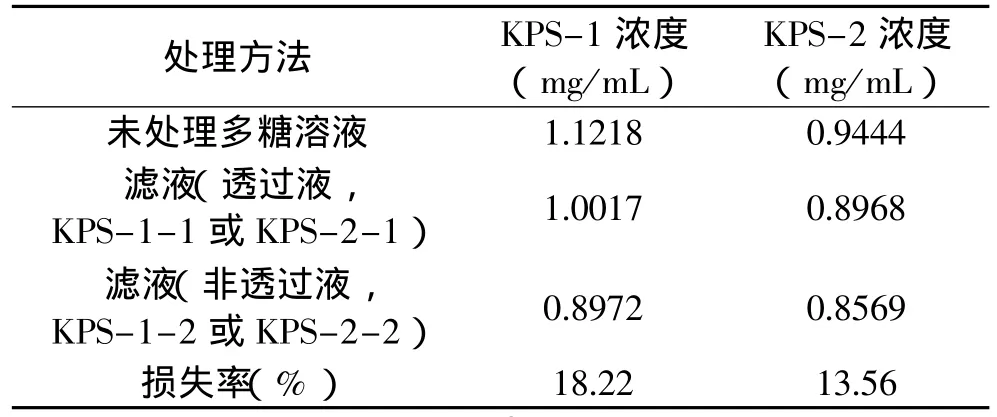
表3 多糖KPS-1和KPS-2处理结果比较
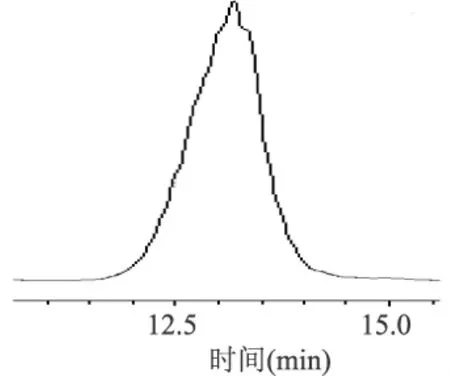
图6 KPS-1-1 HPLC图谱
应用超滤膜进行过滤多糖有一定的损失,KPS-1损失率为18.22%,KPS-2损失率为13.56%,损失率并不大。与其它分级方法相比具有速度快、效率高、分级效果好的特点,因此具有很大的应用前途。

图7 KPS-1-2 HPLC图谱

图8 KPS-2-1 HPLC图谱
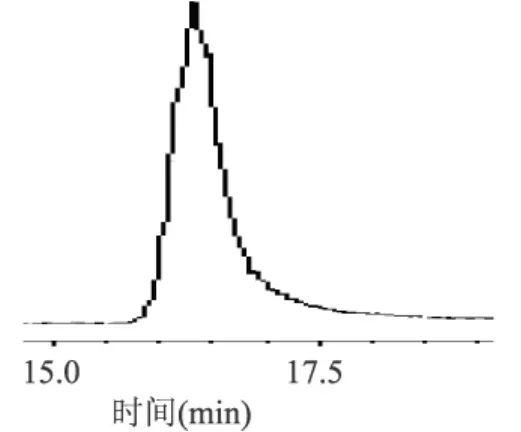
图9 KPS-2-2 HPLC图谱
超滤后的多糖进行 HPLC纯度分析,可看出KPS-1经超滤分级得到的两个组分KPS-1-1和KPS-1-2其HPLC图谱都较好,超滤分级发挥了很好的效果,是一种重要的分离纯化方法。
3 结论
对逆流色谱分离海带多糖的方法进行了研究,同时对超滤纯化多糖的效果进行了分析,获得了较
好的效果。
3.1 建立了逆流色谱分离多糖的双水相系统,在PEG1000浓度为12%,KH2PO4浓度为8%,K2HPO4浓度为8%,转速在400r/min时,可以使海带多糖达到很好的分离,是多糖分离的又一重要方法。
3.2 研究了超滤在分离纯化海带多糖方面的应用效果,结果表明采用不同的超滤膜可以使多糖达到较好的纯化效果。与传统的纯化方法相比是一种效果好、速度快、损失小的纯化方法,具有广阔的应用前景。
3.3 获得了四种多糖组分,分别命名为KPS-1-1、KPS-1-2、KPS-2-1、KPS-2-2,其纯度分别为95.24%、94.36%、94.80%和95.57%,获得了较高的纯度,为后续的结构分析及活性研究打下了基础。
[1]Ito Y.Countercurrent Chromatography:Theory and Practice.New York:Marcel Dekker,1988,79.
[2]Ito Y,Bowman RL.Countercurrent chromatography:liquid-[J].Science,1970,167:281-283.
[3]Jacques Goupy.Countercurrent chromatography:Ito’s solvent classification analysed with Boolean experimental designs[J].Chemometrics and Intelligent Laboratory Systems,2001,59:53-66.
[4]Duan J,Wang X,Dong O,et al.Structural features of a pectic arabinogalactan with immunological activity from the leaves of Diospyros kaki[J].Carbohydrate Research,2003,338:1291-1297.
[5]Gi-Young Kim,Hyung-Sik Park,Byong-Hyok Nam,et al.Purification and characterization of acidic proteo-heteroglycan from the fruiting body of Phellinus linteus(Berk&M A Curtis)[J].Teng Bioresource Technology,2003,89:81-87.
[6]HenselA,MeierK.Pectinsand xyloglucansexhibit antimutagenic activities against nitro aromatic compounds[J].Planta Medica,1999,65:395-399.
[7]Lina Zhang,Xuelian Li,Xiaojuan Xua,et al.Correlation between antitumor activity,molecular weight,and conformation of lentinan[J].Carbohydrate Research,2005,340:1515-1521.
[8]Sendl A,Mulinacci N,Vincieri F F,et al.Antiinflammatory and immunologically active polysaccharides of sedum telephium[J].Phytochemistry,1993,34:1357-1362.
[9]Schmidgall J,Schnetz E,Hensel A.Evidence for bioadhesive effects of polysaccharides and polysaccharide-containing herbs in an ex vivo bio adhesion assay on buccal membranes[J].Planta Medica,2000,66:48-53.
[10]Alexandra M Deters,Christian Lengsfeld,Andreas Hensel.Oligo-and polysaccharides exhibit a structure-dependent bioactivity on human keratinocytes in vitro[J].Journal of Ethnopharmacology,2005,102:391-399.
[11]Xingfeng Bao,Yun Zhen,Li Ruan,et al.Purification,characterization,and modification of T Lymphocyte-stimulating polysaccharide from spores of Ganoderma lucidum[J].Chem Pharm Bull,2002,50(5):623-629.
[12]Malcolm B Perry,Leann L MacLean,a Marianna A Patrauchanb,et al.The structure of the exocellular polysaccharide produced by rhodococcus sp[J].Carbohydrate Research,2007,342:2223-2229.
[13]Nikolay P Arbatsky,Anna N Kondakova,Sofan Senchenkova,et al.Structure of a new ribitol teichoic acid-like O-polysaccharide of a serologically separate Proteus vulgaris,TG 276-1,classified into a new Proteus serogroup O53[J].Carbohydrate Research,2007,342:2061-2066.
[14]Dubois M,Gilles KA,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28:350-356.
[15]Gabriela Cuesta,Norma Suarez,Maria I Bessio,et al.Quantitative determination of pneumococcal capsular polysaccharide serotype 14 using a modification of phenol-sulfuric acid method[J].Journal of Microbiological Methods,2003,52:69-73.
[16]Beatriz Farruggia,Bibiana Nerli,Guillermo Picó.Study of the serum albumin-polyethyleneglycol interaction to predict the protein partitioning in aqueous two-phase systems[J].Journal of Chromatography B,2003,798:25-33.
[17]Yoichiro Ito.Golden rules and pitfalls in selecting optimum conditions for high-speed counter-current chromatography[J].Journal of Chromatography A,2005,1065:145-168.
[18]Katarına Reiffova,Radomıra Nemcov.Thin- layer chromatography analysis of fructooligosaccharides in biological samples[J].Journal of Chromatography A,2006,1110:214-221.
[19]SuWan Myung,Inhwan Choi,Sumin Lee,et al.Separation of silk proteins and silk oligopeptides by thin film composite ultrafiltration membrane[J].Desalination,2008,234:158-165.
[20]AnnsofiJensson,Annakarin Nordin,Ola Wallberg.Concentration and purification of lignin in hardwood kraft pulping liquorby ultrafiltration and nanofiltration[ J].Chemical Engineering Research and Design,2008,86:1271-1280.
[21]Hong Ye,Keqi Wang,Chunhong Zhou,et al.Purification,antitumor and antioxidant activities in vitro of polysaccharides from the brown seaweed Sargassum pallidum[J].Food Chemistry,2008,111:428-432.
[22]Libin Ye,Jingsong Zhang,Xijun Ye,et al.Structural elucidation ofthe polysaccharide moiety ofa glycopeptide(GLPCW-II)from Ganoderma lucidum fruiting bodies[J].Carbohydrate Research,2008,343:746-752.
[23]Cuixian Yang,Ning He,Xueping Ling,et al.The isolation and characterization of polysaccharides from longan pulp[J].Separation and Purification Technology,2008,63:226-230.
[24]Yi Chen,Mingyong Xie,Shaoping Nie,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J].Food Chemistry,2008,107:231-241.
Study on separation and purification of kelp polysaccharide by using countercurrent chromatography and ultrafiltration grade separation method
SONG Guang-lei,DU Qi-zhen
(College of Food Science and Biology,Zhejiang Gongshang University,Hangzhou 310035,China)
The method of separation and purification of kelp polysaccharide by countercurrent chromatography and ultrafiltration were studied,and good results were achieved.The polysaccharide countercurrent chromatography solvent system was screened out by using the central composite experiment design.12%PEG1000,8%KH2PO4,8%K2HPO4and the rotation speed 400r/min were the best condition.Two of polysaccharides,KPS-1 and KPS-2 were isolated according to the parameters,and the purity was 87.5%and 89.6%respectively.Using ultrafiltration to purify the KPS-1 and KPS-2,the KPS-1-1,KPS-1-2 from KPS-1,and KPS-2-1,KPS-2-2 from KPS-2 were obtained.high performance liquid chromatography(HPLC)analysis result showed that KPS-1 and KPS-2 were purified.
countercurrent chromatography(CCC);solvent system;ultrafiltration;polysaccharide
TS201.2+3
B
1002-0306(2011)02-0269-05
2009-12-30
宋广磊(1978-),男,博士研究生,讲师,研究方向:功能性食品。
