三元TBZ/HPB-铜(Ⅱ)-L-蛋氨酸配合物的合成、表征、抑菌活性及与DNA的作用
2011-09-29卢艳梅区志镔刘海峰乐学义
卢艳梅 区志镔 刘海峰,2 乐学义*,,2
(1华南农业大学理学院应用化学系,广州 510642)(2华南农业大学生物材料研究所,广州 510642)
三元TBZ/HPB-铜(Ⅱ)-L-蛋氨酸配合物的合成、表征、抑菌活性及与DNA的作用
卢艳梅1区志镔1刘海峰1,2乐学义*,1,2
(1华南农业大学理学院应用化学系,广州 510642)(2华南农业大学生物材料研究所,广州 510642)
本文合成了2个新的三元铜(Ⅱ)配合物:[Cu(TBZ)(L-Met)(H2O)]ClO4·H2O(1)和[Cu(HPB)(L-Met)]ClO4(2)[TBZ=2-(4′-噻唑基)苯并咪唑,HPB=2-(2-吡啶)苯并咪唑,L-Met=L-蛋氨酸]。通过元素分析、摩尔电导率、IR、UV-Vis及电喷雾质谱对这些配合物进行了表征。用二倍稀释法研究了配合物的抗菌活性,发现配合物对金黄色葡萄球菌(Staphylococcus aureus,G+),枯草杆菌(Bacillus subtilis,G+),沙门氏杆菌(Salmonella,G-)和大肠杆菌(Escherichia coil,G-)具有良好的抑制作用。采用电子吸收光谱、荧光光谱、粘度测定及琼脂凝胶电泳方法研究了配合物与DNA的相互作用,结果表明,配合物以插入方式与DNA作用,在维生素C存在下通过羟自由基·OH,单线态氧1O2或者1O2类似物如Cu-O2,切割pBR322 DNA双螺旋结构。
铜(Ⅱ)配合物;2-(4′-噻唑基)苯并咪唑;2-(2-吡啶)苯并咪唑;DNA;抑菌活性
小分子特别是过渡金属配合物与DNA的键合和分子识别特性使其有可能作为DNA结构探针、化学核酸酶、药物和杀菌剂等而具有广泛的应用前景[1-14]。研究发现,苯并咪唑衍生物具有杀菌、抗癌等活性[15-16],尤其是这些化合物与某些金属形成配合物时可进一步提高其生物活性[17-19],因此苯并咪唑衍生物过渡金属配合物与DNA相互作用及其应用受到人们广泛关注[20-26]。L-α-氨基酸是重要的生物配体,当在金属配合物中插入这类氨基酸后,不仅有助于提高配合物的生物活性,而且能够提高配合物在水中的溶解性,从而有助于减小配合物因水溶性差而导致细胞对药物吸收效果不好等不足之处[27],因此研究含L-α-氨基酸及苯并咪唑衍生物过渡金属配合物具有重要意义。
基于 2-(4′-噻唑基)苯并咪唑(TBZ)(图 1)与 2-(2-吡啶)苯并咪唑(HPB)(图2)是2个重要的苯并咪唑衍生物,具有良好的抗寄生物、抗菌和抗真菌活性等[20-22],本文合成了2个含有2-(4′-噻唑基)苯并咪唑(TBZ)/2-(2-吡啶)苯并咪唑(HPB)及 L-蛋氨酸的铜(Ⅱ)三元配合物[Cu(TBZ)(L-Met)(H2O)]ClO4·H2O(1)和[Cu(HPB)(L-Met)]ClO4(2)[TBZ=2-(4′-噻唑基)苯并咪唑,HPB=2-(2-吡啶) 苯并咪唑,L-Met=L-蛋氨酸],通过元素分析、摩尔电导率、IR、UV-Vis光谱及电喷雾质谱对配合物的结构进行了表征,用二倍稀释法研究了配合物的抑菌活性,并采用电子吸收光谱、荧光光谱、粘度测定及琼脂凝胶电泳方法研究了配合物与DNA的相互作用。

图1 2-(4′-噻唑基)苯并咪唑(TBZ)的分子结构式Fig.1 Molecular structure of 2-(4′-thiazolyl)benzimidazole

图2 2-(2-吡啶)苯并咪唑(HPB)的分子结构式Fig.2 Molecular structure of 2-(2-pyridyl)benzimidazole
1 实验部分
1.1 试剂及仪器
配体 2-(2-吡啶)苯并咪唑(HPB)、Cu(ClO4)2·6H2O分别参照文献[28-29]方法制备。 L-蛋氨酸(L-Met)、2-(4′-噻唑基)苯并咪唑(TBZ)、抗坏血酸(Vit C)、溴化乙啶(EB)、小牛胸腺 DNA(CT-DNA)、琼脂糖凝胶、质粒pBR322DNA和三羟甲基氨基甲烷(Tris)均为生化试剂,其他为市售分析纯试剂。研究配合物与DNA相互作用时,底液为 10 mmol·L-1Tris+50 mmol·L-1NaCl缓冲液 (pH=7.2),TBE 电泳缓冲液为:4.5×10-2mol·L-1Tris+4.5 ×10-2mol·L-1H3BO3+1 mol·L-1EDTA(pH=8.3),参照文献方法[30]确定CT-DNA浓度。ACATAR 360 FTIR型红外光谱仪(KBr压片),美国Nicolet公司;Vario EL元素分析仪,ELEMENTAR公司;DDS-12A型电导率仪,上海宇隆仪器有限公司;Shimadzu UV-2550型紫外/可见分光光度计,日本Shimadzu公司;F-4500荧光光谱仪,日本HITACHI公司;乌氏粘度计,上海晶菱玻璃有限公司;移液枪,大龙医疗设备(上海)有限公司;凝胶电泳池,大连捷迈科贸有限公司;BIO-RAD凝胶成像系统,BIO-RAD Laboratories-Segrate意大利米兰;LCQDECA液质联用仪,美国FINNIGAN公司。
1.2 配合物的合成
称取0.5 mmol TBZ(HPB)溶于20 mL无水乙醇中,加热搅拌下加入1.0 mL 0.5 mol·L-1Cu(ClO4)2溶液,反应 15 min,得溶液A;称取0.5 mmol L-Met溶于5 mL双蒸水中,加热,得溶液B;把溶液B加入溶液A中,加热搅拌回流30 min;反应结束后,冷却混合液至室温,过滤,静置滤液,10 d后析出蓝色晶体。过滤并依次用少量水、乙醇洗涤,空气中干燥后置于干燥器中保存。
配合物 1:IR(KBr),ν/cm-1:3431(s,br),3258(m),3 092(m),1 621(vs),1 387(s),1 524(w);UV-Vis,λ/nm(ε/(L·mol-1·cm-1)):243(14694),301(18197),619(196);EA(%), Found: C,32.80;H,3.38;N,11.82;Calc for C15H21O8N4CuS2Cl(%):C,32.79;H,3.18;N,11.89。 ESMS(甲醇,m/z):432.1([Cu(TBZ)(L-Met)(H2O)]+)。
配合物 2:IR(KBr),ν/cm-1:3438(s,br),3263(m),2 914(m),1 638(vs),1 396(s),1 486(w);UV-Vis,λ/nm(ε/(L·mol-1·cm-1)):239(26241),325(27001),627(301);EA(%), Found: C,40.19; H,3.81;N,11.08;Calc for C17H19O6N4CuSCl(%):C,40.24;H,3.75;N,11.05。 ESMS(甲醇,m/z):405.9([Cu(HPB)(L-Met)]+)。
1.3 抑菌试验
采用试管二倍稀释法测定配合物最小抑菌浓度 (MIC)。 所用菌株为: 金黄色葡萄球菌(Staphylococcusaureus, G+), 枯 草 杆 菌(Bacillus subtilis,G+),沙门氏杆菌(Salmonella,G-),大肠杆菌(Escherichia coil,G-),G+为革兰氏阳性,G-为革兰氏阴性 (由华南农业大学农学院-广东省植物分子育种重点实验室提供)。取10支(10 mL)消毒试管并进行编号。往每支试管中分别加入1.0 mL营养肉汤,然后把1.0 mL待测样品加入到1号管内,振荡摇匀后,从1号管吸取1.0 mL溶液加入到2号管,再从2号管吸取1.0 mL溶液加入到3号管,一直到9号管,再从9号管内吸取1.0 mL溶液弃去。10号管不加待测样品。在1号管到10号管中分别加入20 μL菌液,其中10号管作为阳性对照管,然后将10支试管放入恒温恒湿培养箱,在相对湿度大于80%和温度37℃条件下培养24 h后取出观察,记录现象。
1.4 配合物与CT-DNA作用
1.4.1 电子吸收光谱
以Tris-HCl/NaCl缓冲溶液为空白对照液,测定标题配合物在200~400 nm之间的吸收光谱。然后,依次往空白池和样品池中加入等体积的CT-DNA溶液,使DNA与配合物的浓度比值不断增加,室温下反应6 min后在同样波长范围内扫描。配合物浓度为 0.1 μmol·L-1。
1.4.2 荧光光谱
溴化乙啶 (EB)与CT-DNA加入到5 mL Tris-HCl/NaCl缓冲溶液中,放置4 h。在扫描速度为240 nm·s-1和525 nm为激发波长条件下,测定EB-CTDNA体系在550~650 nm波长区间的荧光强度。然后,依次增加标题配合物浓度,室温下反应5 min后在同样同样波长范围内扫描。系列试样溶液中EB浓度为 4.8 μmol·L-1,CT-DNA 浓度为 5.5 μmol·L-1。
1.4.3 粘度试验
温度恒定在(29.0±0.1)℃,CT-DNA 浓度固定为0.2 mmol·L-1,依次增大配合物浓度。 相对粘度按公式η=(t-t0)/t0(t0为缓冲溶液流经毛细管所需时间,t为含不同浓度配合物的DNA溶液流经毛细管所需的时间)计算。 以(η/η0)1/3对 CComplex/CDNA(η0为未加配合物时DNA溶液的比粘度)作图。
1.5 配合物对pBR322DNA的切割作用
将200 ng pBR322 DNA与不同浓度的配合物以及50倍于配合物浓度的还原剂Vit C混合,然后用Tris-HCl/NaCl缓冲溶液定容至17 μL,在28℃下放置 2 h 后,加入 3 μL Loading buffer(含 0.25%溴酚蓝和50%甘油的水溶液),在0.8%琼脂糖凝胶和TBE 电泳液(45 mmol·L-1Tris+45 mmol·L-1H3BO3+1 mol·L-1EDTA,pH=8.3)中电泳(100 V)40 min。 Gold View(4~5 μL)作为凝胶着色剂,溴酚蓝作为电泳过程指示剂,电泳结果在BIO-RAD紫外检测仪下观察并拍照。为了探索配合物切割DNA的作用机理,先分别将 4 μL DMSO、100 μmol·L-12,2,6,6-四甲基-4-哌啶酮(TMP)和 NaN3与 200 ng pBR322 DNA混合作用15 min,再加入配合物及Vit C,28℃下放置2 h后,进行电泳。
2 结果与讨论
2.1 配合物表征
元素分析结果与理论值基本吻合,由此推测的配合物组成与实际一致。测得配合物1,2在甲醇溶液中的摩尔电导率分别为 81.5 和 103 S·cm2·mol-1,表明配合物均为1∶1型电解质[31]。
用KBr压片测定配合物红外光谱。结果表明,配合物1、2在3430 cm-1附近强的吸收峰归属于结晶 H2O 的 ν-O-H;2914~3263 cm-1范围内 2 个强吸收带归属于-NH2的2个不对称分裂吸收峰 ν-N-H,表明 -NH2参与了配位;1 700~1 750 cm-1范围内没有任何吸收带,表明L-Met的羧基参与了配位,且Δν(νas(COO-)-νs(COO-))>200 cm-1,表明-COO-为单齿配体基团[32]。另外,配合物在1500 cm-1附近都有吸收,归属于配体TBZ(HPB)上的C=N伸缩振动。
UV-Vis光谱表明,配合物甲醇溶液在紫外区均有2个较强的吸收峰,归属于配体的π→π*跃迁。与自由配体相比,最大吸收峰的位置未发生改变,但强度有所减弱,归因于TBZ/HPB上的氮原子配位后引起配体上电子云密度的降低。与配体相比,配合物1、2分别在619和627 nm处出现了一个新的弱而宽的吸收峰,归属于配合物分子中心Cu(Ⅱ)离子的d→d跃迁。
用甲醇作溶剂测得配合物ES-MS。结果表明,配合物1的ES-MS具有正离子峰m/z=432.1,表明配合物分子中存在配离子[Cu(TBZ)(L-Met)(H2O)]+;而配合物2的ES-MS具有正离子峰m/z=405.9,推测该配合物分子中存在配离子[Cu(HPB)(L-Met)]+。
综合上述配合物的元素分析、摩尔电导率、红外光谱、UV-Vis光谱及ES-MS分析结果,并分别参考类似配合物[33-34],可推测配合物1、2分子式为:[Cu(TBZ)(L-Met)(H2O)]ClO4·H2O(1)和 [Cu(HPB)(L-Met)]ClO4(2),分别为变形四方锥和平面四方形结构,如图3所示。

图3 配合物1、2的可能分子结构Fig.3 Possible molecular structures of the complexes
2.2 抑菌活性
将化合物配成浓度为 1 024、800 及 640 μg·mL-1的原液,通过二倍稀释法配制成系列浓度溶液, 细菌最终接种量为5×106CFU·mL-1,37℃下培养 24 h,测得 Cu(ClO4)2、TBZ、HPB 和配合物抑制细菌最低浓度(MIC),结果见表1。
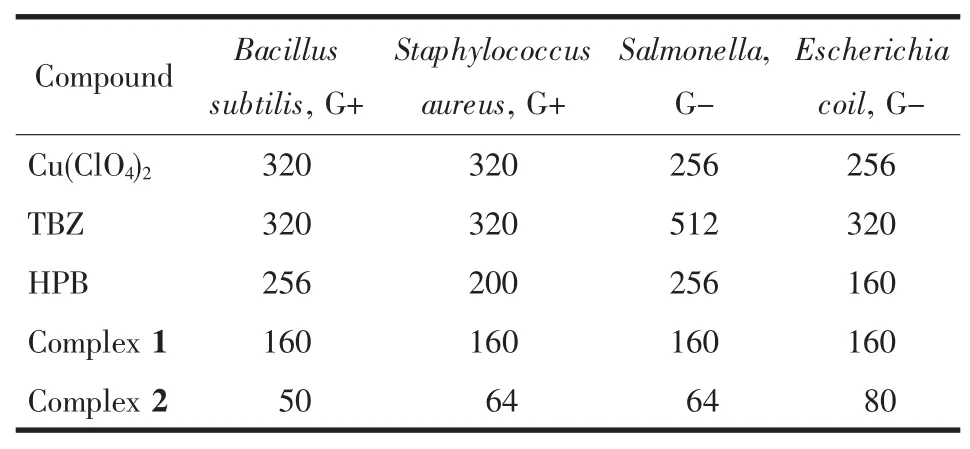
表1 化合物抑制细菌生长的最低浓度Table 1 Minimal inhibitory concentrations(MIC,μg·mL-1)of the compounds for the assayed bactera
表1中实验数据表明:配合物抑菌活性均高于Cu(ClO4)2及2-取代苯并咪唑配体(TBZ/HPB),这可能是由于金属离子与配体之间协同作用的结果。另外,对所有细菌,配合物2的MIC值小于配合物1,表明2-取代苯并咪唑配体本身的性质对配合物抑菌活性有重要影响,2-取代苯并咪唑配体抑菌活性越强,其对应的配合物抑菌活性就越强。
2.3 配合物与CT-DNA的相互作用
为了初步探索配合物抑菌作用机理,本文通过光谱学、流体力学等方法研究了配合物与CT-DNA的作用。
2.3.1 电子吸收光谱
电子吸收光谱是研究小分子化合物与CT-DNA相互作用的最常用和最有效的方法之一。在210~400 nm范围内,标题配合物均出现了2个吸收峰,归属于2-取代苯并咪唑配体的π→π*跃迁峰。配合物与CT-DNA相互作用的吸收光谱滴定曲线如图4所示。
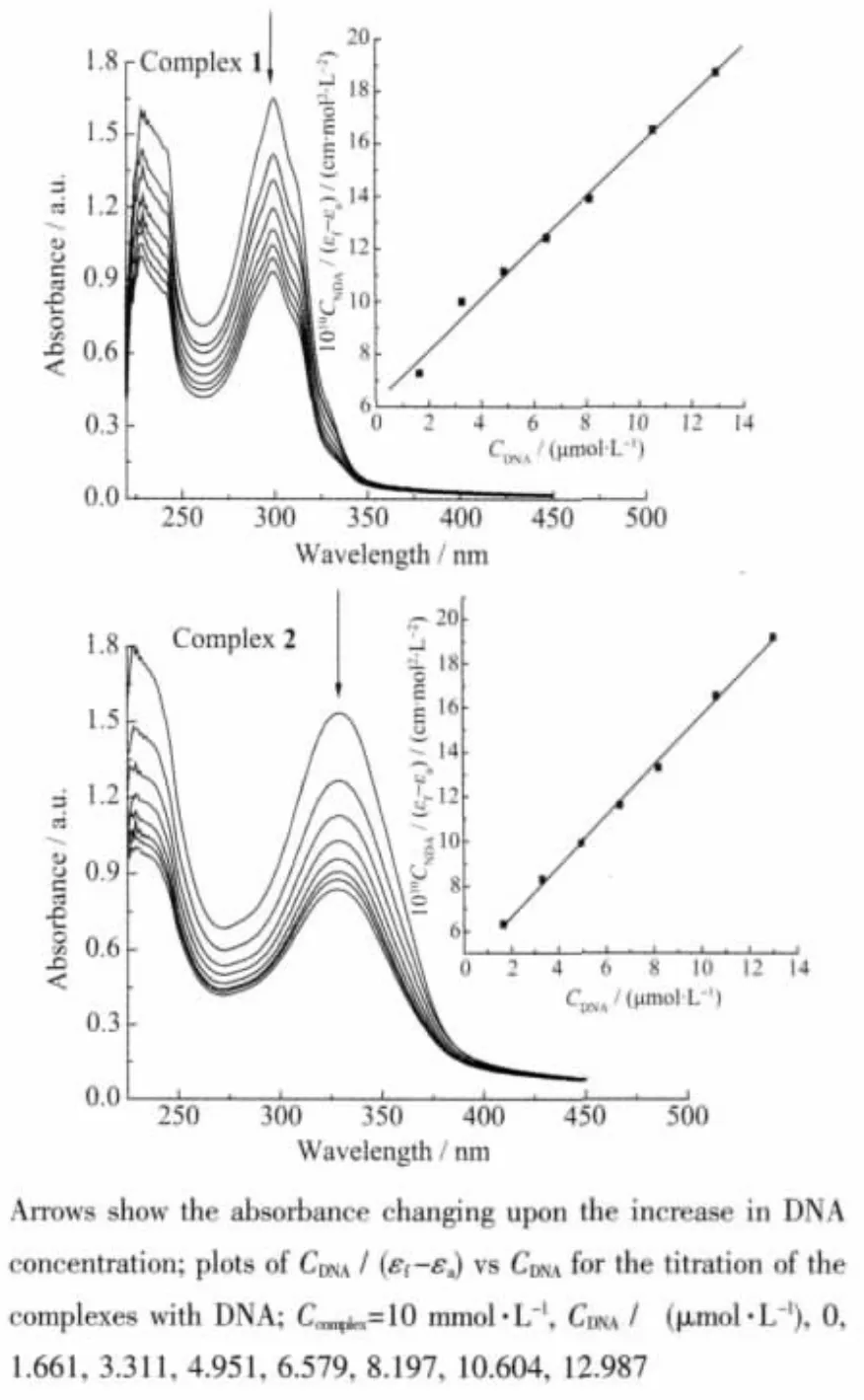
图4 配合物在不同DNA浓度下的电子吸收光谱图Fig.4 Absorption spectra of the complexes upon addition of DNA
结果表明,随着CT-DNA浓度增加,配合物在210~400 nm波长范围内吸收峰强度显著减弱。这可能归因于配体插入到CT-DNA碱基之间,导致配体的π空轨道与碱基的π轨道发生偶合,偶合后的π轨道因部分填充电子,使π→π*跃迁几率减小,从而产生减色效应[35]。
另外,通过CT-DNA对配合物的电子光谱滴定试验,能够根据以下方程式求得配合物与CT-DNA的结合常数:
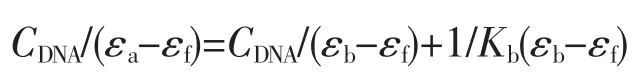
其中,CDNA表示 CT-DNA 的浓度,εa、εf和 εb分别表示Aobsd/CCu、自由配合物的摩尔吸光系数和完全结合后的配合物的摩尔吸光系数,以CDNA/(εf-εa)对CDNA作图,斜率与截距的比值即为配合物与DNA的结合常数 Kb[36]。 配合物 1、2的 Kb值分别为 1.584×105和 2.601×105L·mol-1, 表明配合物 2 与 CT-DNA的相互作用强于配合物1,这可能主要归因于HPB的芳环面积大于TBZ,有助于配合物插入到DNA的碱基对之间。
2.3.2 荧光光谱
荧光光谱被广泛的应用于研究配合物与DNA之间的相互作用。测得配合物与CT-DNA作用的溴化乙啶(EB)荧光光谱如图5所示。

图5 配合物对EB-DNA体系荧光光谱的影响Fig.5 Effects of the complexes on the fluorescence spectra of EB-DNA system
从图中可以看出,随着配合物浓度增加,EBCT-DNA体系的荧光强度被显著地淬灭,这归因于配合物分子将EB从EB-CT-DNA复合物中挤出,即配合物对CT-DNA的插入作用[37]。通过配合物对EB-DNA体系荧光光谱的滴定实验,可以应用经典Stern-Volmer方程求得配合物取代EB而与CTDNA作用的淬灭常数Ksq[38]

其中,I和I0分别表示滴加和未滴加配合物时EBCT-DNA体系的荧光强度,r表示配合物与CT-DNA的浓度比。以I0/I对r作图获得一条直线(图5中插图),直线的斜率即Ksq值。由此获得配合物1、2的Ksq值分别为 0.0898 和 0.1012, 表明与 DNA 作用大小次序为:配合物2>1,与上述电子吸收光谱测定结果一致。
2.3.3 粘度测定
粘度法被认为是在缺乏晶体结构数据情况下确定配合物与DNA键合模式最有力的证据之一[39]。DNA粘度对其链长度变化非常敏感。当配合物以静电、沟面结合等非插入方式与DNA作用时,DNA溶液的粘度无明显变化;以部分插入方式与DNA作用时,DNA溶液的粘度降低;而通过经典插入方式与DNA作用时,DNA溶液的粘度增加。CT-DNA相对比粘度随配合物加入量的变化如图6所示。
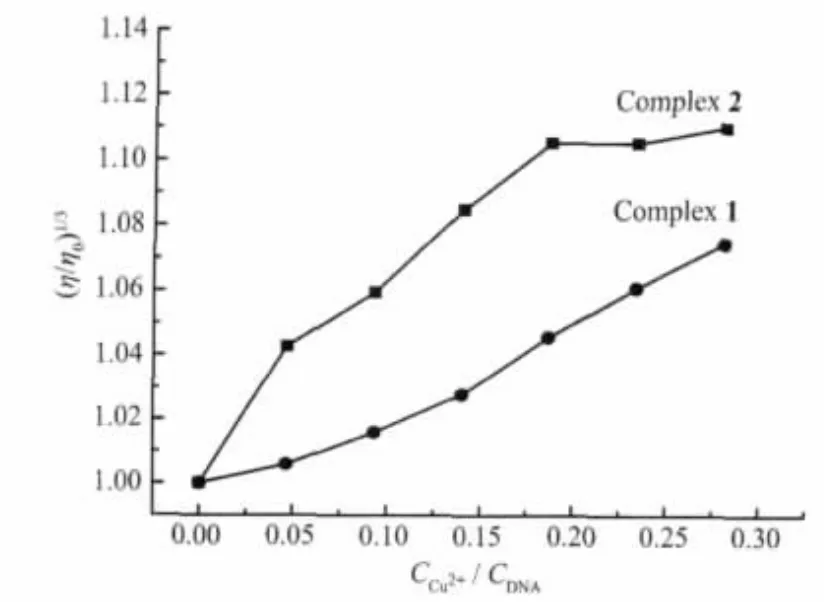
图6 DNA相对粘度随配合物加入量的变化Fig.6 Effect of increasing amounts of the complexes on the relative viscosity of CT-DNA
结果表明,随着配合物加入量的增加,CT-DNA溶液的相对比粘度增大,由此推测配合物通过配体HPB或TBZ以插入方式与CT-DNA作用。据CTDNA溶液相对比粘度的变化幅度推得配合物与CT-DNA插入作用的强弱为:配合物2>1,与上述电子吸收光谱和荧光光谱分析的结果一致。
2.4 配合物对pBR322 DNA的切割作用
完整的pBR322 DNA通常呈超螺旋型 (Ⅰ型),当其中一条链上出现一个切口(即单链断裂)时就变为切口环形(Ⅱ型),而当两条链在同一位置都发生断裂时就变为线型(Ⅲ型)。这3种构型pBR322DNA在电泳过程中具有不同的迁移速率,通常Ⅰ型迁移速率最快,Ⅲ型次之,Ⅱ型最慢[40]。28℃下,配合物对pBR322DNA的切割作用如图7所示。

图7 配合物切割pBR322 DNA的凝胶电泳图Fig.7 Agarose gel eletrophoresis for the cleavage of pBR322 DNA by the complexes in the presence of Vit C
结果表明,抗坏血酸、配合物、或Cu(ClO4)2、TBZ及HPB在存在抗坏血酸时,均未对pBR322 DNA显示出明显的切割作用,但2个配合物在存在抗坏血酸时,能将pBR322 DNA共价闭环的超螺旋构型(FormⅠ)切割成缺刻构型(FormⅡ),且切割作用大小为配合物2>1,与上述配合物对DNA的插入作用大小一致,由此推测这种割作用可能与配合物对DNA的插入作用有关。
为进一步探索配合物对DNA切割的作用机制,在活性氧·OH自由基清除剂(DMSO)及单线态氧1O2清除剂(TMP和NaN3)存在下,研究了配合物对pBR322 DNA的切割作用(图8)。

图8 加入抑制剂后配合物切割pBR322 DNA的凝胶电泳图Fig.8 Cleavage of pBR322 DNA by the complexes in the presence of an inhibitor DMSO,TMP,or NaN3
由图8可知,在没有DMSO,TMP或NaN3存在的条件下,2个配合物都能将pBR322 DNA共价闭环的超螺旋构型 (FormⅠ)切割成缺刻构型(FormⅡ)(第 2,3泳道)。然而,羟自由基·OH 抑制剂 DMSO的加入可明显抑制配合物对pBR322 DNA的切割作用(第4,5泳道),表明切割作用与羟自由基·OH有关;另外,加入单线态氧1O2抑制剂TMP后,配合物对pBR322 DNA的切割被明显抑制 (6,7泳道),表明切割作用还可能涉及到单线态氧1O2或者其类似物,用另一单线态氧1O2抑制剂NaN3试验也得到了类似的结果(第8,9泳道)。综合以上分析结果,推测两配合物切割pBR322 DNA涉及到羟基自由基·OH、单线态氧1O2或者单线态氧1O2类似物,可能的反应历程如下:
配合物(以[Cu(Ⅱ)]表示)首先与DNA作用,然后在Vit C作用下被还原:
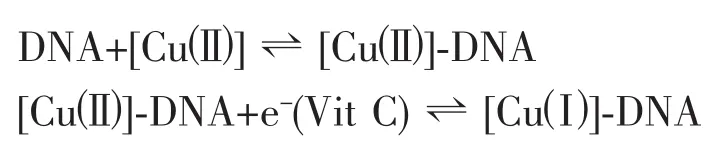
而 [Cu(Ⅱ)-DNA中Cu+易被空气中O2氧化产生(Haber-Weiss 反 应 第 一步)[41]:

标题配合物与本课题组所报道的芳胺铜(Ⅱ)氨基酸配合物有着类似的配位组成和结构,可能具有超氧化物歧化酶(SOD)活性[42],因而能有效地催化歧化产生 H2O2和 O2:

接着H2O2氧化 [Cu(Ⅱ)]-DNA产生活性氧物种,如羟自由基·OH、单线态氧1O2或其类似物,例如Cu-O2[43],这些活性氧物种能进攻并切割pBR322 DNA双螺旋结构[1,42-45]。
[1]Jiang Q,Xiao N,Shi P F,et al.Coord.Chem.Rev.,2007,251(15/16):1951-1972
[2]Biver T,Secco F,Venturini M.Coord.Chem.Rev.,2008,252(10/11):1163-1177
[3]Garoufis A,Hadjikakou S K,Hadjiliadis N.Coord.Chem.Rev.,2009,253(9/10):1384-1397
[4]Bencini A,Lippolis V.Coord.Chem.Rev.,2010,254(17/18):2096-2180
[5]REN Xiang-Xiang(任祥祥),WANG Cai-Xia(王彩霞),LU Yan-Mei(卢艳梅),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(5):891-898
[6]ZHOU Jian-Liang(周建良),CHUN Xiao-Gai(春晓改),ZHOU Lin-Jiao(周琳姣),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(4):645-650
[7]Patra A K,Bhowmick T,Roy S,et al.Inorg.Chem.,2009,48(7):2932-2943
[8]Jiang J,Tang X L.J.Inorg.Biochem.,2010,104(5):583-591
[9]Efthimiadou E K,Karaliota A,Psomas G.J.Inorg.Biochem.,2010,104(4):455-466
[10]LU Yan-Mei(卢艳梅),LE Xue-Yi(乐学义).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(2):199-213
[11]LI Hong(李红),LE Xue-Yi(乐学义),WU Jian-Zhong(吴建中),et al.Acta Chim.Sin.(Huaxue Xuebao),2003,61(2):245-250
[12]DING Yang(丁 杨),REN Xiang-Xiang(任 祥 祥),ZHUANG Chu-Xiong(庄楚雄),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(4):656-662
[13]GU Qin(古琴),LE Xue-Yi(乐学义),XIE Yun(谢韵),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22(4):757-760
[14]JIANG Qin(姜琴),SHI Peng-Fei(施鹏飞),ZHU Yang-Guang(朱阳光),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(4):589-595
[15]Wright J B.Chem.Rev.,1951,48(3):397-541
[16]Bhattacharya S,Chaudhuri P.Curr.Med.Chem.,2008,15(18):1762-1777
[17]Choquesillo-Lazarte D,Covelo B,Gonzalez-Perez J M,et al.Polyhedron,2002,21(14/15):1485-1495
[18]Mothilal K K,Karunakaran C,Rajendran A,et al.J.Inorg.Biochem.,2004,98(2):322-332
[19]REN Xiang-Xiang(任祥祥),LU Yan-Mei(卢艳梅),LE Xue-Yi(乐学义).Chem.Bull.(Huaxue Tongbao),2010,73(6):551-555
[20]Devereux M,McCann M,O′Shea D,et al.J.Inorg.Biochem.,2004,98(6):1023-1031
[21]Devereux M,O′Shea D,Kellett A,et al.J.Inorg.Biochem.,2007,101(6):881-892
[22]El-Sherif A A,Jeragh B J A.Spectrochim.Acta Part A,2007,68A(3):877-882
[23]Gumus F,Eren G,Acik L,et al.J.Med.Chem.,2009,52(5):1345-1357
[24]Saha D,Das S,Bhaumik C,et al.Inorg.Chem.,2010,49(5):2334-2348
[25]Lezcano M,Soufi W A L,Novo M,et al.J.Agric.Chem.,2002,50(1):108-112
[26]Delescluse C,Piechock M P,Ledirac N,et al.Biochem.Pharmacol.,2001,61(4):399-407
[27]Zhang S C,Zhu Y G,Tu C,et al.J.Inorg.Biochem.,2004,98(12):2099-2106
[28]Yue S M,Xu H B,Ma J F,et al.Polyhedron,2006,25(3):635-644
[29]The Chemical Society of Japan.Translated by AN Jia-Ju(安家驹),CHEN Zhi-Chuan(陈之川).Handbook of Inorganic Compounds:Vol.2(无机化合物手册:第 2册),Bejing:Chemistry Industry Press,1986:513
[30]Cater M T,Rodriguez M,Bard A J.J.Am.Chem.Soc.,1989,111(24):8901-8911
[31]Geary W J.Coord.Chem.Rev.,1971,7(1):81-122
[32]Nakamoto K.Infrared and Raman Spectra of Inorganic and Coordination Compounds.4th Edition,New York:John Wiley and Sons Inc.,1986:257
[33]SONG Zhi-Jun(宋 智 君),LE Xue-Yi(乐 学 义),LI Hong(李红),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2005,21(4):527-530
[34]ZHOU Xiao-Hua(周晓华),LE Xue-Yi(乐学义),LI Ming-Hua(李明华).Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2000,21(5):681-682
[35]Tysoe S A,Baker A D,Strekas T C.J.Phys.Chem.,1993,97(8):1707-1711
[36]Wolfe A,Jr.Shimer G H,Meehan T.Biochemistry,1987,26(20):6392-6396
[37]Selvakumar B,Rajendiran V,Maheswari P U,et al.J.Inorg.Biochem.,2006,100(6):316-330
[38]Lakowicz J R,Webber G.Biochemistry,1973,12(21):4161-4170
[39]ZHOU Qing-Hua(周庆华),YANG Pin(杨频).Acta Chim.Sin.(Huaxue Xuebao),2005,63(1):71-74
[40]SHEN Tong(沈同),WANG Jing-Yan(王镜岩),ZHAO Bang-Ti(赵邦悌).Biochemistry(生物化学).Beijing:People Education Press,1983.
[41]Thederahn T B,Kuwabara M D,Larsen T A,et al.J.Am.Chem.Soc.,1989,111(13):4941-4946
[42]LIAO Sheng-Rong(廖升荣),LE Xue-Yi(乐学义),LIN Qing-Bin(林庆斌),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22(2):203-206
[43]Goyne T E,Sigman D S.J.Am.Chem.Soc.,1987,109(9):2846-2848
[44]Ferrer S,Ballesteros R,Sambartolomé A,et al.J.Inorg.Biochem.,2004,98(8):1436-1446
[45]González-A′lvarez M,Alzuet G,García-Giménez J,et al.Z.Anorg.Allg.Chem.,2005,631(11):2181-2187
Syntheses,Characterization,Antibacterial Activities of Ternary Copper(Ⅱ)Complexes with 2-(4′-Thiazolyl)benzimidazole/2-(2-pyridyl)benzimidazole and L-Methionine and Their Interaction with DNA
LU Yan-Mei1OU Zhi-Bin1LIU Hai-Feng1,2LE Xue-Yi*,1,2
(1Department of Applied Chemistry,South China Agricultural University,Guangzhou 510642,China)(2Institue of Biomaterial,South China Agricultural University,Guangzhou 510642,China)
Two new ternary copper(Ⅱ) complexes:[Cu(TBZ)(L-Met)(H2O)]ClO4·H2O(1)and[Cu(HPB)(L-Met)]ClO4(2)[TBZ=2-(4′-thiazolyl)benzimidazole,HPB=2-(2-pyridyl)benzimidazole,L-Met=L-methionine],were synthesized and characterized by elemental analysis,molar conductivity,IR,UV-Vis spectroscopy and ES-MS.The complexes were assayed against gram-positive (Staphylococcus aureus,Bacillus subtilis)and gram-negative(Salmonella,Escherichia coil)bacteria by doubling dilutions method,and the interaction of the complexes to DNA was investigated by electronic absorption spectroscopy,fluorescence spectroscopy,viscosity measurements and agarose gel electrophoresis.The results indicated that the complexes could bind to DNA by intercalative mode,and cleave pBR322 DNA in the presence of vitamin C in the involvement of the hydroxyl radical,and may be a singlet oxygen or a singlet oxygen-like entity such as copper-peroxide Cu-O2,with the order of the binding ability and cleavage activity of the complexes to DNA:complex 2>1.
ternary copper(Ⅱ) complex;2-(4′-thiazolyl)benzimidazole;2-(2-pyridyl)benzimidazole;DNA;antibacterial activity
O614.121
:A
:1001-4861(2011)04-0704-07
2010-09-25。收修改稿日期:2010-11-21。
广东省科技计划项目(No.2009B020312010),广东省自然科学基金(No.10151064201000016)及华南农业大学211工程项目(No.2009B010100001)资助。
*通讯联系人。 E-mail:lexyfu@163.com,Tel:08620-85287010
