二氧化钛干凝胶热分解及热处理对表面有机官能团变化的影响
2011-09-29席文君
吴 伟 席文君
(北京航空航天大学材料科学与工程学院,北京 100191)
二氧化钛干凝胶热分解及热处理对表面有机官能团变化的影响
吴 伟 席文君*
(北京航空航天大学材料科学与工程学院,北京 100191)
利用X射线衍射(XRD)、差示扫描量热法(DSC)、红外光谱(FTIR)、X射线光电子能谱(XPS)等技术手段研究了溶胶-凝胶(sol-gel)法制备的二氧化钛干凝胶粉末在不同温度下煅烧后表面成分和结构变化,并对不同煅烧温度的粉末样品表面有机官能团的种类及所占的比例进行了探讨。结果表明:二氧化钛干凝胶粉末随着煅烧温度的提高,O-Ti-O结构逐步由复杂的无序网链状结构向有序的晶体结构转变,粉末表面的有机官能团中羧基通过反应产生的螯合物影响二氧化钛晶化;在200~300℃温度范围二氧化钛表面存在大量羟基;300℃左右羧基螯合物分解,在350℃时,憎水碳链官能团已基本除去,在300~350℃,有机官能团加速减少。
二氧化钛干凝胶;热处理;表面有机官能团;羟基
近几十年来的研究发现半导体光催化氧化技术在去除污染物方面,具有能耗低、氧化能力强、反应条件温和、操作简便、可减少二次污染等突出特点[1]。1976年Cary等[2]陆续报道了紫外光照射下二氧化钛可降解有机物以来,二氧化钛因其价廉、无毒害、催化活性高、稳定性好、易于回收等特性而倍受青睐。用sol-gel法制备二氧化钛凝胶,水解过程中能促进晶核的形成,抑制晶核的长大和颗粒的聚集,工艺简单,合成温度低,条件易控且得到的产品具有良好的均一性和较高的纯度。利用该方法制备的凝胶通过干燥为二氧化钛干凝胶后煅烧得到二氧化钛粉末或薄膜。影响二氧化钛粉末或薄膜光催化性能的因素有很多,如表面的羟基含量、晶型、晶粒大小以及样品纯度等等[3]。
在二氧化钛粉末和薄膜表面发生的非均相光催化反应[4],使得表面的羟基产生羟基自由基。一般认为,在二氧化钛粉末和薄膜表面的羟基含量越高产生的自由基数量越多,有助于提高光催化性能。余家国等[5]在前驱体溶胶中添加聚乙二醇增加二氧化钛粉末和薄膜的表面羟基量。通常在制备粉末和薄膜的过程都需要煅烧,所以热分解中的羟基含量变化的研究就显得异常重要,因为它直接影响到二氧化钛粉末和薄膜的光催化性能。
用sol-gel法制备纳米二氧化钛粉末和薄膜时,由于先驱体、溶剂和添加剂等均含有大量的有机官能团,这些官能团有的具有亲水性,如羟基和羧基等亲水官能团,有的具有憎水性,如含碳链的有机分子等。二氧化钛粉末或薄膜表面也具有两性,存在着憎水和亲水位置,一般认为,当碳链或芳香环等直接吸附到表面的憎水位置时,光催化降解性能最为有效[6];而二氧化钛制备过程中的憎水官能团的存在,会吸附需要降解的有机分子,使得有机分子不能直接吸附到二氧化钛表面,从而导致光催化性能下降。所以,在二氧化钛干凝胶煅烧过程中既要保证有效去除憎水有机官能团又要保证有高的羟基含量,从而获得具有优良光催化性能二氧化钛粉末。目前已对二氧化钛干凝胶煅烧过程中有机官能团的种类和作用进行了详细的研究[3,5,12],但仅限于定性的研究,尚缺乏对有机官能团做更为细致的定量研究。为进一步优化制备工艺,提高用sol-gel法制备的二氧化钛光催化性能,本文探讨了二氧化钛干凝胶热分解及热处理对表面有机官能团变化的影响。
1 实验部分
1.1 样品的制备
用sol-gel法制备二氧化钛干凝胶粉末:用钛酸四丁酯(化学纯)为先驱体,溶剂为无水乙醇(分析纯),并加入冰醋酸(分析纯)和水,按物质的量的比为n钛酸四丁酯∶n乙醇∶n水∶n冰醋酸=1∶10∶4∶1。 室温下将 27.90 mL冰醋酸加到盛有216.6 mL无水乙醇中,再加入126.50 mL钛酸四丁酯,搅拌15 min使之混合均匀,得到淡黄色透明溶液;剧烈搅拌下用滴管将26.78 mL去离子水以3 mL·min-1缓慢速率滴加到溶液中,滴加完毕得到均匀透明的溶胶,继续搅拌直到无法流动,通过溶剂慢慢挥发得半透明湿凝胶。
将湿凝胶在空气中陈化12 h以上,接着置于恒温干燥箱中110℃下烘干大约10 h,得暗黄色小块体,研磨后得到二氧化钛干凝胶粉末。
取干凝胶粉末放入马弗炉中煅烧,设定温度分别为110、200、300、350和 450℃保温 3 h后随炉冷却,得到煅烧后的粉末。
1.2 样品表征
用Thermo Scientific公司的ESCALab250型X射线光电子能谱仪(XPS)表征二氧化钛干凝胶粉末的表面元素组成及各个元素的价态。激发源为单色器 Al Kα X 射线(λ=0.833 9 nm),Al Kα 线能量为1486 eV,线宽为0.9 eV,功率为150 W。分析时的基础真空约为 6.5×10-8Pa。 结合能用碳的 C1s峰(284.8 eV)校正。
用NEXUS公司的Thermo Nicolet Nexus 470型傅立叶变换红外光谱仪(FTIR)对二氧化钛干凝胶粉末进行官能团分析。红外光谱仪的扫描范围4000~400 cm-1;光学分辨率 0.5 cm-1;波数精度 0.01 cm-1。
用德国BRUDER公司的BRUDER axs 8D advance型X-ray衍射仪测量二氧化钛干凝胶粉末样品,扫描步长 0.01°,扫描速率为 2°·min-1,衍射角(2°)范围 20°~80°,采用 Cu 靶的 Kα 射线(λ=0.15418 nm),工作电压为40 kV,电流为40 mA。
用NETZSCH公司的DSC-404C热分析仪测量DSC曲线,观察二氧化钛干凝胶粉末热分解过程。采用空气气氛,加热速率为20 K·min-1,加热范围为50~1200 ℃。
2 结果与讨论
2.1 二氧化钛干凝胶粉末热分解
图1为二氧化钛干凝胶粉末分别在110、200、300、350和450℃煅烧3 h的XRD图。从图1可知,在200℃以下二氧化钛干凝胶粉末为无定形状态或非晶态,与文献报道一致[10]。这一现象的原因是:首先在干凝胶颗粒内部的O-Ti-O结构是链网状结构[4],不是晶体的有序结构;其次,颗粒表面吸附大量的羟基和有机物。当煅烧温度进一步提高到300℃时,XRD图显示出现明显的锐钛矿相特征峰,说明O-Ti-O结构就已经开始有序化,向有序的金红石晶型转变,并且随着温度升高峰型变得尖锐。
图2为不同温度煅烧3 h后的二氧化钛干凝胶粉末的红外谱图。从图2可以看出,110℃煅烧的样品中含有大量的有机官能团,种类也非常丰富,表面吸附着残留的水,烃基,羟基,羧基和羧酸盐等,样品对应的红外峰位如表1所示。Doeff S等[11]发现,当醋酸加到溶液中后,不仅作为酸性催化剂,还改变了反应前驱体的结构,在不同比例下形成了3种配合物:单齿配合物I(Monodentate chelatingⅠ),二齿配合物II(Bidentate chelatingⅡ),二齿配合物 III(Bidentate bridgting III)。反应式如下:然后这种化合物再发生水解反应,并且这种鳌合物一直存在直到260℃才分解。所以,在110℃和200℃煅烧后仍有螯合物形成的羧酸盐和羧基存在,温度进一步提高后逐步减少消失。从红外图谱还可以发现即使温度提高后,粉末表面仍有少量羧基,说明羧基相对于其他有机官能团比较难以除去。

图1 不同温度下二氧化钛干凝胶粉末煅烧3 h后样品的XRD图Fig.1 XRD patterns of TiO2xerogel powder calcined for 3 h at different temperatures

图2 不同温度下二氧化钛干凝胶粉末煅烧3 h后样品的红外光谱图Fig.2 FTIR spectra of TiO2xerogel powder calcined for 3 h at different temperatures

表1 二氧化钛干凝胶粉末110℃煅烧3 h后样品的红外峰位归属Table 1 Peak assignmemt for IR spectra in the case of TiO2xerogel powder calcined for 3 h at 110℃

综合FTIR谱和XRD图的分析结果,可以看出当粉末表面的有机官能团量较多时,如110和200℃煅烧后,XRD结果显示O-Ti-O结构的有序性很差,而当温度提高到300℃时,该结构已经有了明显的有序性变化,该温度正好是羧酸盐大量减少的温度,因为此时温度已高于螯合物Ti(OC4H9)4-x(CH3COO)x的分解温度,有文献[12]报道称由于醋酸的加入使得制备的样品晶化温度提高,原因正是由于醋酸的存在形成了螯合物,螯合物中的羧酸盐导致了O-Ti-O结构有序化困难。
图3所示为二氧化钛干凝胶粉末样品的DSC曲线,从图中可以看出:在113℃左右有一个较大的吸热峰,是由于粉末表面吸附的水和乙酸、乙醇、丁醇等有机物质的挥发造成的。而在310℃左右的吸热峰,是由于二氧化钛表面的羟基、螯合物羧酸盐和(TiO2)n-O-COCH3,(TiO2)n-O-C4H9等物质断键脱附[14]造成的。随后,在350~900℃之间有3~4个放热峰。有文献[12]报道350℃左右有一个有机物脱附燃烧的放热峰,但在图3中,只在348℃时有一个并不明显的放热峰,原因可能是升温速率较快,样品数量较少,所以放热不明显。410℃左右的尖锐的放热峰是二氧化钛晶化为锐钛矿晶体的晶化放热峰,而在650~850℃之前有多个小的放热峰,是锐钛矿晶型缓慢向高温相金红石晶型转变的放热峰。
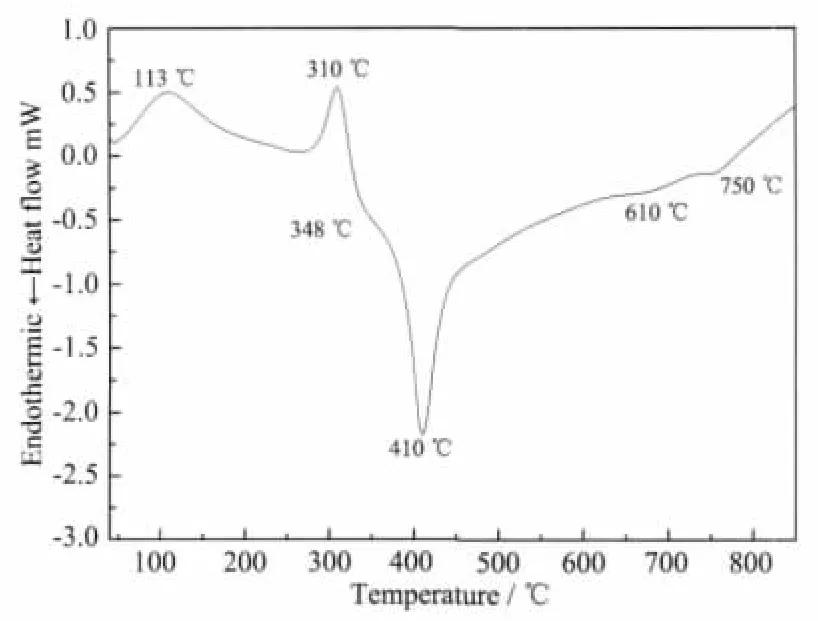
图3 二氧化钛干凝胶粉末样品的DSC曲线Fig.3 DSC curve for TiO2xerogel power
综合以上结果,可以画出二氧化钛干凝胶粉末热分解过程示意图,如图4所示。图中干凝胶颗粒表面有的有机官能团是用虚线与颗粒表面的羟基相连,代表是氢键形式结合的,吸附的有机官能团,用实线与O-Ti-O结构相连的代表与表面羟基反应后留下的有机官能团。

图4 二氧化钛干凝胶粉末热分解过程示意图Fig.4 Schematics for the process of xerogel powder heat decomposition
根据示意图二氧化钛干凝胶粉末热分解过程可以描述为:在113℃左右,以氢键形式链接的乙醇、乙酸等物质蒸发离开颗粒表面,当加热到310℃时,(TiO2)n-O-COCH3,(TiO2)n-O-C4H9、螯合物羧酸盐和羟基等物质开始脱键,348℃时脱键物质开始燃烧并有二氧化钛开始晶化。在410℃左右时,链网状的O-Ti-O结构开始完全解链有序重组,形成锐钛矿晶型的二氧化钛晶体。当继续加热到600℃左右时,发生了晶型转变,二氧化钛由锐钛矿晶型向金红石晶型转变。
2.2 二氧化钛干凝胶粉末表面有机官能团变化的定量研究
图5为二氧化钛凝胶粉末不同温度煅烧3 h后的XPS图谱,图谱上主要有C、O和Ti 3种元素的峰位。对比煅烧前后的图谱,可以发现:干凝胶样品加工过程中混入的Ca和N元素,在样品高温煅烧后基本消失,随着煅烧温度的提高,二氧化钛粉末表面C元素的C1s峰明显变弱,且峰越来越尖锐,说明在煅烧过程中干凝胶表面有大量的含C有机官能团损失,温度越高官能团的种类和数量越少。煅烧后粉末表面的Ti元素的Ti2p峰和O元素的O1s峰峰位没有变化,但是煅烧温度越高峰越尖锐。

图5 二氧化钛凝胶粉末在不同温度下煅烧3 h后样品的XPS图Fig.5 XPS spectra of TiO2xerogel powder calcined for 3 h at different temperatures

图6 二氧化钛凝胶粉末不同温度煅烧3 h后样品表面的Ti2p轨道的XPS图Fig.6 XPS spectra of Ti2p on the surface TiO2xerogel powder calcined for 3 h at different temperatures
XPS图谱中,由于电子的自旋-轨道耦合使Ti2p能级分解为2个能级,即Ti2p3/2和Ti2p1/2。图6为Ti2p的光电子图谱,不同煅烧温度下,Ti2p3/2峰位基本相同,均在0.2 eV误差范围之内。证明二氧化钛干凝胶粉末煅烧前后Ti-O之间的价键结构均为TiO2,唯一不相同的是Ti2p3/2峰的半峰宽不一样。图7为煅烧温度对Ti2p3/2峰半峰宽的影响,随着煅烧温度提高,Ti2p3/2峰的半峰宽越来越小,这一现象也有学者在用sol-gol法制取二氧化钛薄膜时发现,非晶的TiO2薄膜要比单晶的TiO2标准样品(半高峰宽(FWHM)为 1.10 eV)的 Ti2p3/2峰半高峰宽宽许多[13]。对于这一现象的解释,首先要考虑到半高峰宽的影响因素是该元素的化学环境,即Ti元素的化学环境,煅烧温度在200℃以下时,O-Ti-O结构是网链状三维结构,结构无序且复杂,煅烧温度到300℃时,结构逐渐有序化,直到450℃为单一的金红石结构,所以,Ti2p3/2峰的半峰宽会随着温度的提高而变窄。
图8为二氧化钛凝胶粉末不同温度煅烧3 h后表面O1s分峰图谱,从图中可以看出,由于存在大量的有机官能团,110℃时O1s的分峰有5种结构形态的的O元素与其他元素的结合,比例为:(C-O、H2O)∶(C=O、 污 染 碳 (contaminants))∶(Ti-OH)∶(TiO2)=1.93∶2.81∶8.25∶20.78。 O1s分峰后 O 元素的各种化学键结合及所占的原子百分比如表2所示。图8还显示随着温度的提高,粉末表面残留的有机官能团的数量和种类在减少。煅烧温度对干凝胶表面羟基含量的影响如图9所示,可以看出羟基含量是随着温度的升高先增加后减少。(羟基含量随煅烧温度的变化 :8.25%(110 ℃)、15.42%(200 ℃)、8.52%(300 ℃)、7.08%(350℃)、6.67%(450 ℃),转折点大约在 200 ℃附近。

图8 二氧化钛凝胶粉末不同温度煅烧3 h后样品表面O1s的XPS图Fig.8 High-resolution spectra of O1s on the surface TiO2xerogel powder calcined for 3 h at different temperatures

图9 不同煅烧温度对二氧化钛干凝胶粉末表面羟基含量的影响Fig.9 Effect of temperature on relative content of hydroxyl group on the surface TiO2xerogel powder

表2 110℃时O1s分峰后关于O元素的各种化学键结合及所占的原子百分比Table 2 Atomic percentage of various chemical bonds for O1s on the surface TiO2xerogel powder calcined for 3 h at 110℃
110℃二氧化钛干凝胶粉末表面的羟基含量没有200℃时高的原因在于,110℃煅烧温度低,不足以使与羟基以结合的各种有机官能团断键脱附,导致羟基的X射线信号不强,200℃时之所以会有较多的羟基含量,主要原因是该温度下与羟基结合的有机官能开始断键脱附,并且由于温度不高,所以O-Ti-O氧桥结构羟基(Bridge OH)得以保留,端基羟基(Terminal OH)在煅烧过程中失去了羟基,但Ti+4原子又会很快与空气中水蒸气发生水解反应,当温度进一步提高时,粉末表面的桥基羟基(Bridge OH)也会因高温而脱附,而且由于该种羟基脱附后于水分子水解反应速度慢,所以当加热温度达到350~450℃时,如图10所示,制备过程中的端基羟基高温脱附后又水解形成,羟基此时在短时间内无法通过水解修复[8-9],羟基的含量已变化不大。因此如果只考虑羟基含量对二氧化钛光催化性能的影响,应考虑在200~300℃温度范围内煅烧二氧化钛于凝胶。

图10 高温下二氧化钛干凝胶表面2种羟基的变化示意图Fig.10 Schemes for changes of two kinds of hydroxyl on the surface of TiO2xerogel powder at high temperature
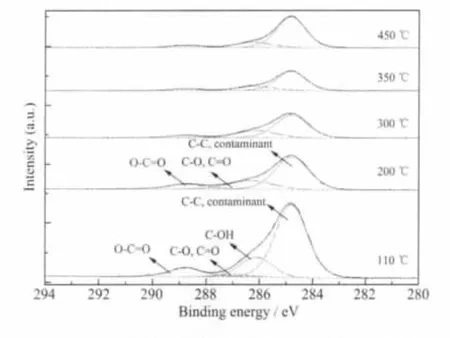
图11 二氧化钛凝胶粉末不同温度煅烧3 h后表面C1s的XPS图Fig.11 High-resolution spectra of C1s on the surface TiO2xerogel powder calcined for 3 h at different temperatures
图11为二氧化钛凝胶粉末不同温度煅烧3 h后表面C1s分峰图谱,表3为分峰后C元素的各种化学键结合及在干凝胶粉末表面所占的原子百分比。结合图11和表3,可以观察到二氧化钛干凝胶粉末表面C元素的结合方式主要有O-C=O、C-O、C=O、C-OH、烃碳以及空气中的污染碳。其中,醇碳在200℃后基本消失,其他种类结合的碳也基本遵循随着温度升高含量下降的规律。但是在300~350℃时,有机官能团的减少速度明显加快,原因为有机管能团已经完成脱附,进入了氧化燃烧的阶段。300℃左右正因为羧基螯合物的分解,所以导致由于羧基分解造成C-O、C=O含量反常升高。在此温度区间,二氧化钛晶化开始,与XRD的分析结果吻合。在350~450℃范围内,各种有机物变化基本不大,特别是憎水官能团C-C和污染碳共同比例从350℃时的22.99%反而上升到了450℃时的 23.09%,说明C-C官能团在350℃时已经基本被除去,此时污染碳占据了大部分二氧化钛表面的憎水位置,这正是我们所希望看到的结果,污染有机物直接吸附到二氧化钛的表面。

表3 在不同温度煅烧后样品表面C元素的各种化学键结合及所占的原子百分比Table 3 Atomic percentage for various chemical bonds of C element on the surface TiO2xerogel powder calcined for 3 h at different temperatures
考虑到有机官能团中影响二氧化钛晶化的重要因素之一是羧基螯合物Ti(OC4H9)4-x(CH3COO)x的分解,所以煅烧温度要高于260℃。在200~300℃煅烧可以在粉末表面获得大量的羟基,对表面碳元素分析后,发现在300~350℃时表面含碳有机官能团的减少加快,特别是在350℃时憎水的C-C官能团已基本被除去。工业上制备二氧化钛粉末,煅烧温度一般要求达到450~500℃左右[3-4],如果在300℃煅烧就能达到甚至超过原来450~500℃煅烧温度时二氧化钛的光催化性能,将节约大量能源。
3 结 论
(1)二氧化钛干凝胶的热分解过程与其O-Ti-O链网状结构以及表面的有机官能团有着密切的联系,在干凝胶表面的有机官能团中羧基通过产生的羧基螯合物来影响二氧化钛晶化,当煅烧温度高于260℃时,羧基螯合物分解,O-Ti-O链网状结构开始向有序的金红石晶型转变。
(2)随着煅烧温度的升高,二氧化钛干凝胶粉末表面的羟基含量先增加后下降,转折点大约在200℃附近;在300℃左右羧基螯合物分解,C-O、C=O含量反常升高;在300~350℃温度范围内,有机官能团的减少速度明显加快,在350~450℃温度范围内,憎水官能团C-C和污染碳共同比例上升,C-C官能团在350℃时已经基本被除去,污染碳占据了大部分二氧化钛表面的憎水位置。
(3)在300℃左右范围内,羧基螯合物大量减少,二氧化钛开始晶化,同时在粉末表面获得大量的羟基,并能有效去除憎水官能团。
[1]Chen G G,Luo G S,Yang X R,et al.Mater.Sci.Eng.,2004,38:320-325
[2]CareyJ,Lawrence J,Tosine H.Bull.Environ.Co-ntam.Toxicol.,1976,16:697-701
[3]YING Jing-Zhou(殷竟洲).Thesis for the Master′s Degree of Dalian University of Technology(大连理工大学硕士学位论文).2006.
[4]WANG Xing(汪信),LIU Xiao-Heng(刘孝恒)Ed.Chemistry of Micro-Nano Materials(纳米材料化学).Bejing:Chemical Industry Press,2006.
[5]YU Jia-Guo(余家国),ZHAO Xiu-Jian(赵修建).Chinese J.Catal.(Cuihua Xuebao),2000,21(3):213-216
[6]Nosaka A Y,Nishino J,Fujiwara T,et al.J.Phys.Chem.B,2006,110:8380-8385
[7]Higashimoto S,Okada K,Morisugi T,et al.Top.Catal.,2010,53:578-583
[8]Stefano C,Gabriele D M, Riccardo G,et al.Appl.Mater.Interfaces,2010,2(5):1294-1298
[9]Murakami Y,Kenji E,Nosaka A Y,et al.J.Phys.Chem.B,2006,110:16808-16811
[10]Lee C,Kim D,Lee J,et al.J.Sol-Gel Sci.Technol.,2004,31:67-72
[11]Doeff S,Henry M,Sanchez C,et al.J.Non-crystal.Solid,1987,89:206-216
[12]LIU Qing(刘 清),XU Zhu-De(徐 铸 德),SHUI Miao(水 淼),YU Lin-Hai(岳林海).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),200,16(6):933-938
[13]Ong J,Lucas L,Raikar G,et al.J.Mater.Sci.:Mater.Med.,1995,6:113-119
[14]Fcchin G,Carturan G,Campostrini R,et al.J.Sol-Gel Sci.Techno.,2000,18:29-59
Effect of Heat Decomposition Process and Thermal Treatment for TiO2Xerogel Powder on Surface Organic Functional Groups
WU WeiXI Wen-Jun*
(School of Materials Science and Engineering,Beihang University,Beijing 100191,China)
The changes of component and structure on the surface of TiO2xerogel powder prepared by sol-gel method were chariterized at several temperature stages by XRD,DSC,FTIR,XPS techniques.Types and proportions of organic functional groups on the surface of powder were studied at different calcination temperatures.The results show that when the calcination temperature increases,O-Ti-O structure transfers from the unordered complex reticulation and chain structure to the ordered crystal one.Surface carboxyl chelate compound is one of the important factors affecting TiO2crystallization,200~300 ℃ is the effective temperature range in which quantities hydroxyl can exist.Carboxyl chelate compound starts decomposing at about 300 ℃ ,hydrophobic carbon chain groups are eliminated at 350℃,and the rate of organic molecules elimination is accelerated significantly at 300~350 ℃.
TiO2xerogel;thermal treatments;surface organics functional groups;hydroxyl
O641.41+1
:A
:1001-4861(2011)04-0659-07
2010-08-10。收修改稿日期:2010-12-10。
国家自然科学基金(No.51072011)资助项目。
*通讯联系人。 E-mail:xiwj@buaa.edu.cn
