含吡啶的抗肿瘤转移NAMI-A衍生物的制备和水解机理动力学
2011-09-29梁曜华梁国刚
梁曜华 毕 葳 梁国刚*,
(1澳门药物及健康应用研究所,澳门科技大学,澳门)(2中国中医科学院中药研究所,北京 100700)
含吡啶的抗肿瘤转移NAMI-A衍生物的制备和水解机理动力学
梁曜华1,2毕 葳2梁国刚*,1,2
(1澳门药物及健康应用研究所,澳门科技大学,澳门)(2中国中医科学院中药研究所,北京 100700)
目的 研究配体结构对NAMI-A衍生物水解机理、电化学性质的影响。方法 制备了trans-[RuCl4(DMSO)(3-MePy)][(3-MePy)H](3-MePy=3-甲基吡啶,化合物 1)和 trans-[RuCl4(DMSO)(4-MePy)][(4-MePy)H](4-MePy=4-甲基吡啶,化合物 2)。用 UV、NMR、CV 法研究化合物1、化合物2的水解机理-动力学、溶液稳定性及电化学性质。结果 化合物1和化合物2与NAMI-A相似,在pH 7.40的缓冲液中发生脱氯水解反应(Ⅰ氯水解及Ⅱ氯水解)(分步反应);在pH 5.00缓冲液中DMSO(二甲亚砜)及少量吡啶水解。测定各水解反应表观速率常数及半衰期、溶液稳定性及氧化还原电位。结论 化合物1、化合物2的Ⅰ氯、Ⅱ氯及DMSO水解反应机理与NAMI-A相似,而且各水解速率与NAMI-A相差不大,即用甲基吡啶取代咪唑环,对NAMI-A衍生物的Ⅰ氯、Ⅱ氯及DMSO水解反应速率影响较小。化合物在酸性溶液中的稳定性明显高于中性溶液。
钌配合物;抗肿瘤转移;水解动力学;稳定性
0 引 言
顺铂(cisplatin)是当前仍广泛应用于临床的抗肿瘤药。其抗癌药效显著,但毒副作用和耐药性较强,且不能抑制肿瘤转移。发现毒副作用小的抗肿瘤转移化合物一直是研发抗肿瘤药物的重要目标。NAMI-A,[H2Im][trans-RuCl4(DMSO)HIm]对小鼠肺癌、乳腺癌的抗转移作用明显、毒性小[1-4]。其已完成Ⅰ期临床试验[5]并进入Ⅱ期临床试验[6]。
顺铂水解后才有抗癌活性。卡铂(carboplatin)的水解速率比顺铂慢,因此毒性比顺铂低[7]。与顺铂相似,NAMI-A本身无药效,其在pH>7.0的溶液中的脱氯水解产物被认为是抗肿瘤转移作用的活性成分[8-10]。 但在 pH<6.50 的溶液中,NAMI-A 分子中以DMSO水解为主,且随pH降低DMSO的水解程度增大[3,8,11-12]。近来也有用不同化学计算的方法预测NAMI-A水解反应的多篇文献报道[13-15],验证了脱氯、脱DMSO的水解过程。Sava等曾用HPLC法研究了 NAMI-A 的Ⅰ氯水解反应(pH 7.40,20~23 ℃),但测定误差较大[2]。Reedijk等用NMR测定了NAMI-A的Ⅰ氯和DMSO水解反应,但未得到相应动力学参数[8]。虽然Ⅱ氯水解产物的抗转移活性大于Ⅰ氯水解产物[10],但因为NAMI-A衍生物Ⅱ氯水解过程较复杂而难于准确测定[16]。
NAMI-A在生物体内可能转化为更利于与靶分子结合的Ru(Ⅱ)[17],肿瘤内环境(缺氧)[18]有利于此类还原反应发生[19-21]。因此NAMI-A水解产物的氧化-还原电位可能影响药效。
用适当配体取代NAMI-A中的咪唑环不但影响NAMI-A的水解、电化学性质,而且影响其抗肿瘤转移药效和毒性[3-4,12]。Sava等曾在专利中制备过含有吡啶的NAMI-A衍生物[22],并证明含甲基吡啶的NAMI衍生物(钠盐)有抗肿瘤转移药效,但未指明甲基在苯环中的位置[23]。目前未见含吡啶的NAMI-A衍生物水解动力学、电化学测定报道。本文制备了含有 3-MePy、4-MePy的 NAMI-A衍生物,测定了两化合物在pH 7.40(模拟人体血液环境)和pH 5.00缓冲液(肿瘤细胞内为酸性环境[24-25])中的水解机理和反应动力学、电化学性质及溶液稳定性,并与NAMI-A及其衍生物在相同条件下的测定数据比较,以探讨配体结构对NAMI-A衍生物水解机理、电化学性质的影响,并初步预测其药理活性。
1 实验部分
RuCl3·XH2O(水合三氯化钌)(Aldrich,purum,Ru~41%);3-甲基吡啶(Merck,+98%);4-甲基吡啶(上海化学试剂有限公司,>98.5%);NaH2PO4.H2O(International Lab USA);其余试剂均为分析纯;实验用水为去离子水。trans-[RuCl4(DMSO)2][(DMSO)2H][26]、NAMIA[22]及 trans-[RuCl4(DMSO)(2-MeIm)][2-MeImH][27]按文献方法制备。缓冲溶液制备:(a)磷酸缓冲溶液:分别用 0.15 mol·L-1NaCl配 制 0.1 mol·L-1NaH2PO4和0.5 mol·L-1NaOH 溶液, 并用 0.5 mol·L-1NaOH 溶液调节 NaH2PO4溶液至 pH=7.40±0.02。 (b)醋酸缓冲溶液: 分别用 0.15 mol·L-1NaCl配制 0.2 mol·L-1醋酸钠和 0.2 mol·L-1醋酸溶液,并用 0.2 mol·L-1醋酸溶液调节醋酸钠溶液至 pH=5.00±0.02。
Bruker WYS-300型核磁共振仪,测定溶剂(CD3)2SO,TMS内标;美国 Beckman Co.DU 800 紫外可见分光光度计 (电子控温±0.1 ℃);Φ 350 pH/Temp/mV meter pH计;Carbo-ERBA-1106型元素分析仪;Perkin Elmer spectrum BXⅡ红外光谱测定仪(KBr压片);Stuart SMP10熔点测定仪。LK98BⅡ微机电化学分析系统。动力学及电化学数据至少测定2次结果取均值。
1.1 化合物1的制备
将 trans-[RuCl4(DMSO)2][(DMSO)2H]0.15 g(0.27 mmol)溶于 8 mL 丙酮,加入 3-甲基吡啶 0.10 mL(1.1 mmol)后,超声振荡1.5 h。生成的桔黄色沉淀过滤,分别用丙酮(1 mL×6)和乙醚(1 mL×3)洗涤,硅胶干燥过夜。 产率:75%。M.P.:176~179 ℃。 Mw=508.28。Anal.Calcd.for C14H21N2Cl4ORuS(%):H 4.16,C 33.08,N 5.51;Found(%):H 3.94,C 33.18,N 5.37。UV-Vis(25 ℃,H2O)λmax,nm(ε,L·mol-1·cm-1):286(3 320),394(4 026),457(500)。 IR(4 000~400 cm-1)(ν,cm-1):3 163(s),3 120(s),3 071(s),1 631,1 579,1 545,1184(s),1106(vs),459(s),422(s)。ESI-MS(negative),m/z 416[RuCl4(DMSO)(3-MePy)]-,322[RuCl4(DMSO)]-,244[RuCl4]-;ESI-MS(positive),m/z 95[3-MePy]H+。1H NMR(DMSO-d6,δ):8.81(3-MePyH+,H6 or H2,s),8.47(3-MePyH+,H4,s),8.00(3-MePyH+,H5,s),-0.07(3-MePy-Ru, CH3′H, s),-2.41(3-MePy-Ru, H2, s),-12.84(DMSO,CH3′S,s)。
1.2 化合物2的制备
将 trans-[RuCl4(DMSO)2][(DMSO)2H]0.17 g(0.31 mmol)溶于8 mL丙酮,加入4-甲基吡啶0.12 mL(1.24 mmol)后,超声振荡 1.5 h。 生成的桔黄色沉淀过滤,用丙酮(1 mL×6)和乙醚(1 mL×3)洗涤,硅胶干燥过夜。 产率:82%。 M.P.:200~202 ℃。 Mw=508.28。Anal.Calcd.for C14H21N2Cl4ORuS(%):H 4.16,C 33.08,N 5.51;Found(%):H 3.98,C 33.26,N 5.38。 UV-Vis(25 ℃,H2O),λmax,nm(ε,L·mol-1·cm-1):280(3230),393(3 880),457(470)。 IR(4 000~400 cm-1)(ν,cm-1):3 223(s),3 059(vs),1 637,1 611,1 504,1 199,1 083,426。ESI-MS(negative),m/z 415.9[RuCl4(DMSO)(4-MePy)]-,322[RuCl4(DMSO)]-,244[RuCl4]-;ESI-MS(positive),m/z 94.8[4-MePyH]+。1H NMR(DMSO-d6,δ):8.80(4-MePyH+,H2 and H6,s),7.96(4-MePyH+,H3 and H5,s),-2.00(4-Mepy-Ru,H2and H6,s),-2.96(4-MePy-Ru,CH3′H,s),-12.90(DMSO,CH3′S,s)。
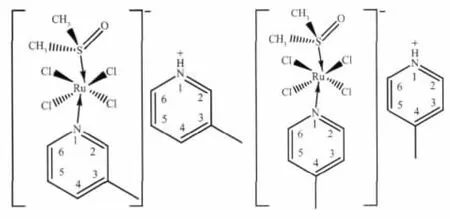
Scheme 1 trans-[RuCl4(DMSO)(3-MePy)][(3-MePy)H](1)及trans-[RuCl4(DMSO)(4-MePy)][(4-MePy)H](2)的化学结构Scheme 1 Chemical structures of trans-[RuCl4(DMSO)(3-MePy)][(3-MePy)H](1)and trans-[RuCl4(DMSO)(4-MePy)][(4-MePy)H](2)
1.3 化合物水解反应机理的研究
研究表明NAMI-A在pH 7.40缓冲液中发生分步脱氯水解反应[28],即Ⅰ氯水解(Abs(389 nm)下降,Abs(340 nm)上升)及Ⅱ氯水解(Abs(340 nm)下降。在生理盐水中发生脱DMSO水解反应(Abs(389 nm)下降[29]。我们分别测定化合物在磷酸缓冲溶液(pH 7.40)及生理盐水溶液(pH 5~6)中的紫外吸收光谱,结果与NAMI-A的相应图谱相似见图1、4。
1.4 化合物的水解动力学研究
为将测定的吸光度转化为浓度,按文献[30]方法分别在化合物或其水解产物的最大吸收波长建立标准曲线方程(n=3,r>0.999)。
将化合物溶于缓冲或非缓冲液,立即选择最大吸收波长测定吸光度。得到的吸光度-时间曲线:对零级反应用标准曲线方程转化成浓度-时间曲线按零级反应方程 (C=B+Kobst其中C为反应浓度;B为拟合常数;Kobs为表观速率常数;t为反应时间)拟合;对一级反应则将吸光度转化成百分吸光度按一级反应方程(Ar=C0+C1exp(-kobst)其中Ar为百分吸光度;C0、C1为拟合常数;Kobs为表观速率常数;t为反应时间)拟合。拟合范围约为反应的10%~90%,r>0.99。动力学反应测定为至少重复两次后取均值。
1.5 化合物的电化学研究
电化学测定使用LK98BII微机电化学分析系统。碳电极(Φ3)为工作电极,铂电极为辅助电极,饱和甘汞电极为参比电极。以氯化钠为支持电解质,扫描速度 0.1 V·s-1。
1.6 1H NMR反应机理研究
使用VNS-600型核磁共振仪,测定溶剂D2O,以 3-三甲基甲硅烷基-2,2,3,3-四氘代丙酸钠(TSP)为内标,测定温度50℃,时间间隔为25 min。
2 结果与讨论
2.1 化合物的结构参数
化合物1、化合物2及NAMI-A衍生物(包括各水解产物)的紫外、红外光谱数据列于表1、表2。表1中2个化合物的紫外、红外光谱数据与NAMI-A衍生物差别不大[22],表明将NAMI-A的咪唑环换成吡啶环,对其结构参数影响较小。表2中化合物1、2的Ⅰ氯、Ⅱ氯水解产物的吸收与NAMI-A的相应水解产物相近,说明化合物1、2与NAMI-A的脱氯水解反应机理相近[10](见scheme 2)。
2.2 化合物1及化合物2在pH 7.40缓冲液中的水解机理及动力学研究
图1为化合物1在pH 7.40缓冲液中水解反应的紫外光谱。
化合物2的水解机理与化合物1非常相近 (图略)。Ⅰ氯水解反应(Abs(393 nm)下降,Abs(346 nm)上升),拐点367 nm;Ⅱ氯水解反应(Abs(346 nm)下降,Abs(300 nm)上升),拐点 270、335 和 438 nm。 相应脱氯水解反应的速度也差别不大。显然,两个化合物与NAMI-A的脱氯水解反应相同,同为明显的分步水解反应[8,10,13-14]。在磷酸盐缓冲液中Ⅱ氯水解反应数据拟合见图2,测定的脱氯水解反应数据见表3。

表 1 trans-[RuCl4(DMSO)(L)][HL](L=3-MePy,4-MePy,Im,N-EtIm,2-MeIm)的红外及紫外光谱Table 1 Infrared and UV spectra of trans-[RuCl4(DMSO)(L)][HL](L=3-MePy,4-MePy,Im,N-EtIm,2-MeIm)

表 2 NAMI-A 衍生物及其水解产物的紫外光谱(λmax)(pH 7.40,0.15 mol·L-1NaCl,37 ℃)Table 2 UV absorptions(λmax)of NAMI-A derivatives together with their degradation products(pH 7.40,0.15 mol·L-1NaCl,37 ℃)
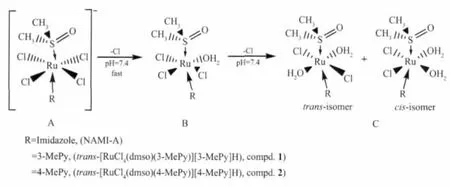
Scheme 2 化合物1、化合物2及NAMI-A在pH 7.40磷酸盐缓冲溶液中的水解过程Scheme 2 Proposed degradation of Compd.1,Compd.2 and NAMI-A in phosphate buffer saline(pH 7.40)
Reedijk等用NMR测定NAMI-A的Ⅰ氯水解、DMSO水解反应时由于曲线拟合不好无法得到动力学参数[8]。Sava等用HPLC测定了NAMI-A的Ⅰ氯水解反应(20~23℃),但测定时需随时加适量酸、碱以维持样品溶液pH值不变;此外分离条件也对测定精度有较大影响[2]。本文用UV-Vis直接测定化合物1的Ⅰ氯、Ⅱ氯水解及DMSO水解反应,影响反应精度因素较少 (温度变化±0.1℃,pH值变化±0.02),方法简单。化合物1的紫外光谱变化(图2)及水解机理与NAMI-A基本一致(已得到NMR谱证明)[8,10]。化合物1水解明显分为Ⅰ氯水解和Ⅱ氯水解反应。Ⅰ氯水解(393 nm吸收下降,346 nm上升)反应中,367 nm处的拐点表明溶液中存在[trans-RuCl4(DMSO)(3-MePy)]-与[RuCl3(DMSO)(3-MePy)(H2O)]的化学平衡,约14 min后此过程结束。346 nm吸收由升转降,300 nm吸收上升。336、391、442 nm处拐点表明溶液中 [RuCl3(DMSO)(3-MePy)(H2O)]和[RuCl2(DMSO)(3-MePy)(H2O)2]+的化学平衡,即Ⅱ氯水解反应[10]。该反应约22 min后结束。计算的化合物1、化合物2的Ⅰ氯、Ⅱ氯水解及脱DMSO水解反应的t1/2与图中的反应时间基本相符。
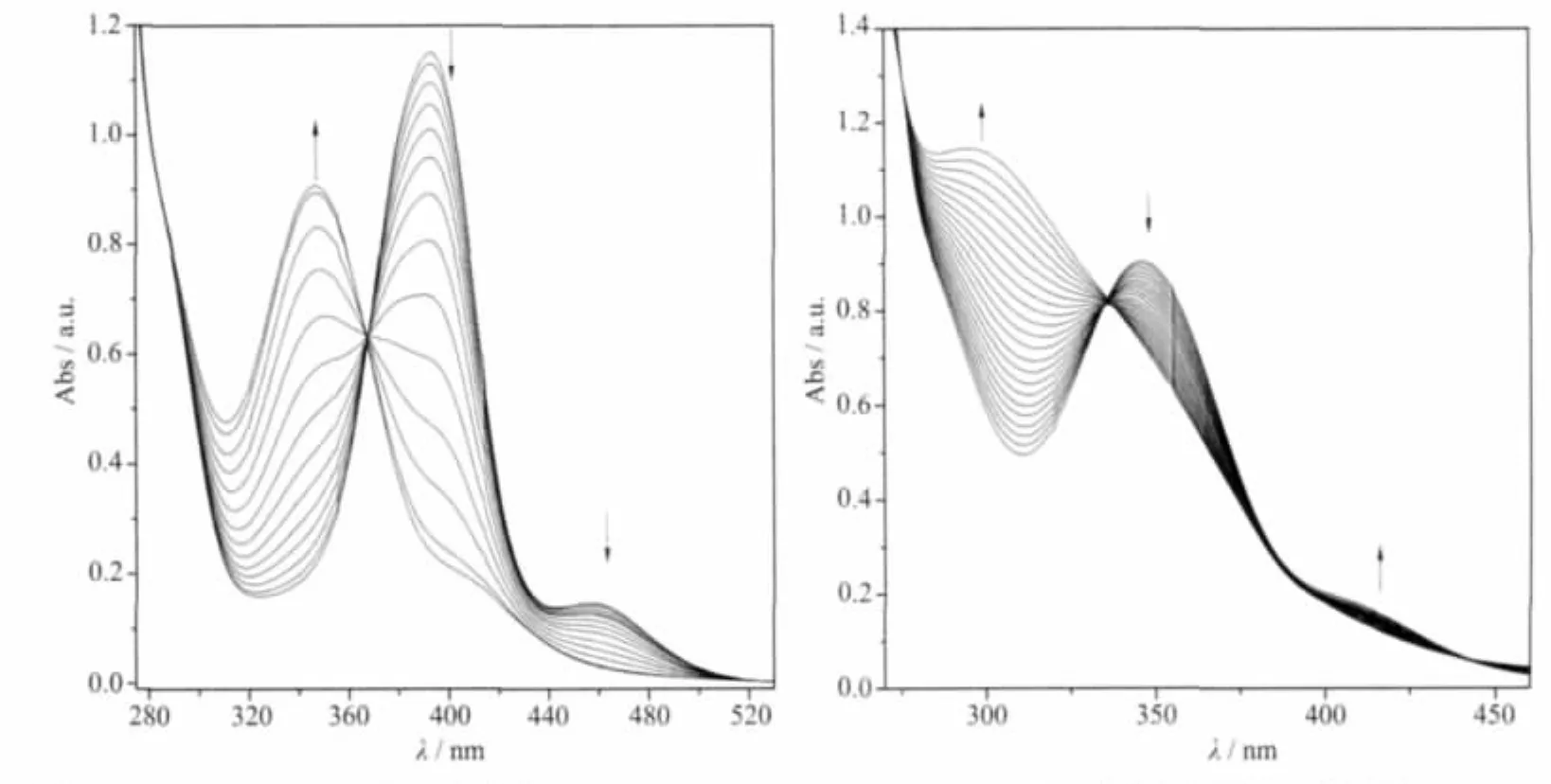
图1 化合物1(0.30 mmol·L-1)在磷酸缓冲溶液(pH 7.40,0.15 mol·L-1NaCl,37℃)中的水解反应(时间间隔1 min)Fig.1 Degradation of Compd.1(0.30 mmol·L-1)in phosphate buffer saline(pH 7.40,0.15 mol·L-1NaCl,37 ℃)recorded every 1 min by UV spectrophotometer

图2 化合物1和化合物2(0.30 mmol·L-1)在磷酸缓冲液(pH 7.40,0.15 mol·L-1NaCl,37 ℃)中的Ⅱ氯水解反应和拟合曲线Fig.2 2ndchloro-hydrolysis of Compd.1 and Compd.2(0.30 mmol·L-1)in phosphate buffer saline(pH 7.40,0.15 mol·L-1NaCl,37 ℃)monitored by plotting C vs t and fitted lines
2.3 化合物1及化合物2在pH 5.00缓冲液中的水解动机理及动力学研究
与NAMI-A相同,化合物1、2在醋酸缓冲液 (pH 5.00)中表现为393 nm(λmax)吸收峰下降,此反应可归结为脱DMSO反应[8]。反应曲线拟合情况见图3。
图3中线a为化合物1脱DMSO水解反应。拟合得直线方程(3):

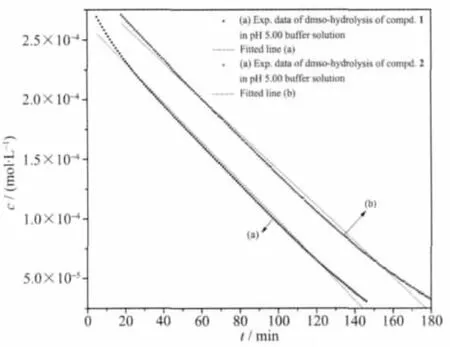
图3 化合物1(a)及化合物2(b)(0.30 mmol·L-1)在醋酸缓冲液(pH 5.00,0.15 mol·L-1NaCl,37 ℃)中的脱DMSO水解曲线及拟合曲线Fig.3 DMSO hydrolytic procedure of Compd.1(a)and Compd.2(b)(0.30 mmol·L-1)in acetic buffer solution(pH 5.00,0.15 mol·L-1NaCl,37 ℃);Straight lines were resulted by plotting C vs t and fitted

表 3 化合物 trans-[RuCl4(DMSO)L][LH](L=3-MePy,4-MePy,Im and 2-MeIm)在缓冲液中(pH 5.00/7.40,0.15 mol·L-1NaCl,37 ℃)或生理盐水(pH 5~6,0.15 mol·L-1NaCl,50 ℃)中的水解速率常数及半衰期的比较Table 3 Comparison on hydrolytic rate and half-life time of trans-[RuCl4(DMSO)L][LH](L=3-MePy,4-MePy,Im and 2-MeIm)in buffer solution(pH 5.00/7.40,0.15 mol·L-1NaCl,37 ℃)or physiological saline(pH 5~6,0.15 mol·L-1NaCl,50 ℃)
由方程3得:
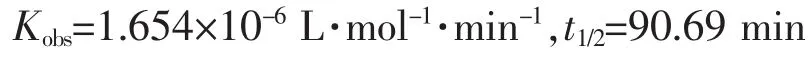
同法测得化合物2的脱DMSO水解反应(图 3b):
Kobs=1.510×10-6L·mol-1·min-1,t1/2=99.34 min
2.4 化合物的稳定性
NAMI-A衍生物的溶液稳定性是影响药效的重要因素[11,31]。图4为2个化合物在生理盐水中的紫外吸收光谱。由于溶液的pH为5~6,水解反应主要为脱DMSO水解,但氢谱证明同时伴随发生碱基水解,因此计算得到的是总表观速率常数(Scheme 3),数据拟合见图5。依本法测定NAMI-A衍生物的溶液稳定性精度较高,且简便[2,32]。

图4 化合物 1 和化合物 2(0.30 mmol·L-1)在生理盐水溶液(pH 5~6,0.15 mol·L-1NaCl,50 ℃)中的水解反应(Abs(393 nm)下降,Abs(320 nm)上升)Fig.4 Aquated procedure of Compd.1 and Compd.2(0.30 mmol·L-1)in physiological solution(pH 5~6,0.15 mol·L-1NaCl,50 ℃)measured at 5 min interval.The absorptions changed by decreasing at 393 nm and increasing at 320 nm
图5a为化合物1在生理盐水溶液中的水解反应(测定波长为393 nm)。以指数衰减一级反应动力学模型拟合得曲线方程:
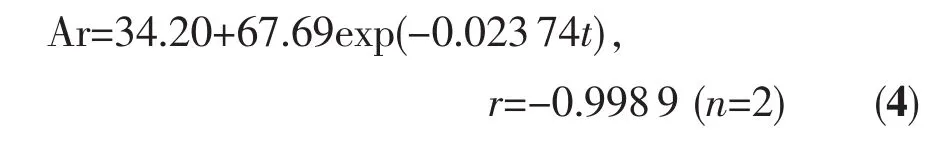
由方程4得:
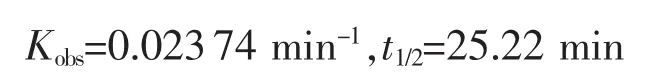
同法测定了化合物2(图5b)、trans-[RuCl4(DMSO)(2-MeIm)][(2-MeIm)H](图 5c) 及 NAMI-A(图 5d)在生理盐水溶液中的稳定性,以一级反应动力学模型经非线性拟合得到各表观速率常数及半衰期(表 3)。
Scheme 2表示化合物1,化合物2及NAMI-A在pH 7.40缓冲液中的水解反应过程及水解产物,其中B、C为主要药效分子,在抗肿瘤转移机理中起重要作用[8-9]。
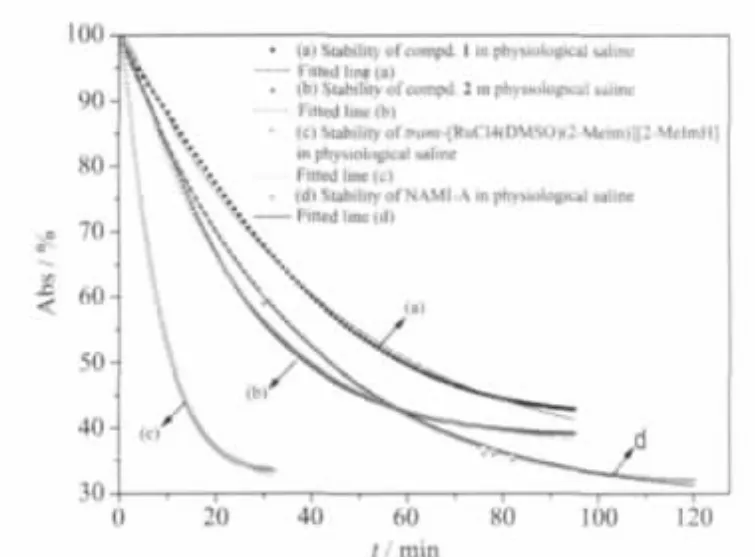
图5 化合物 1(a)、2(b)、trans-[RuCl4(DMSO)(2-MeIm)][2-MeImH](c)和 NAMI-A(d)(0.30 mmol·L-1)在生理盐水溶液(pH 5~6,0.15 mol·L-1NaCl,50 ℃)中的稳定性及拟合曲线Fig.5 Stabilities of Compd.1(a),Compd.2(b),trans-[RuCl4(DMSO)(2-MeIm)][2-MeImH](c)and NAMI-A(d)(0.30 mmol·L-1)in physiological saline(pH 5~6,0.15 mol·L-1NaCl,50 ℃)and fitted lines
表3中化合物1,2的脱氯、脱DMSO水解速率与NAMI-A相差不多,但将推电子甲基引入NAMIA的咪唑环的2位明显加快脱氯、脱DMSO反应速率,且对溶液稳定性影响明显。 而将甲基吡啶环替换咪唑环后对化合物的水解反应及稳定性影响不大。化合物2(4-Mepy)的溶液稳定性较化合物1和NAMI-A稍差。化合物溶液在酸性条件下更稳定。
2.5 电化学研究
电化学测定(图6)数据列于表4。两化合物的氧化、还原电位几乎相同;化合物溶液在60 min后的氧化、还原电位变化可归结为水解反应(由氢谱可证明)。
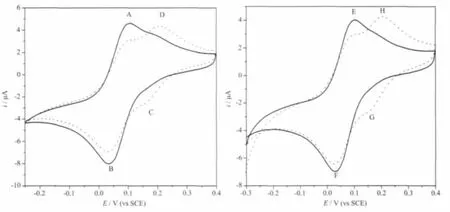
图6 化合物 1(左)及化合物 2(右)(0.50 mmol.L-1)在水溶液(0.15 mol·L-1NaCl,37 ℃)中的循环伏安图。初始循环伏安曲线(实线),60 min后循环伏安曲线(虚线)Fig.6 Cyclic voltammograms of Compd.1(left)and Compd.2(right)(0.50 mmol·L-1)in(0.15 mol·L-1NaCl,37 ℃).Scanned after 0 min(curve),60 min(…)

表 4 化合物 1、化合物 2与 NAMI-A(0.50 mmol·L-1)在生理盐水溶液(0.15 mol·L-1NaCl,50℃)中的氧化电位、还原电位及标准电位Table 4 Oxidation,reduction and formal electrode potential of Compd.1,Compd.2 and NAMI-A(0.50 mmol·L-1)in physiological saline(0.15 mol·L-1NaCl)at 50 ℃
2.6 核磁测定
化合物1的核磁测定图谱见图7。化合物2的氢谱与化合物1相似(图略)。2个化合物的核磁谱相对峰面积随水解时间的变化见图8。
图8中,游离DMSO浓度随时间上升,配位DMSO浓度下降;游离碱基的浓度上升,配位碱基的浓度下降,表明化合物在D2O中不仅DMSO水解,碱基也明显水解。2个化合物的碱基水解程度不同。化合物2的碱基配体水解速率比化合物1略快,其脱DMSO水解速率也比化合物1快。因此总反应速率化合物2>化合物1,与表3中2个化合物的溶液稳定性顺序相符。因为脱DMSO水解和脱碱基水解都影响药效,准确测定各水解反应有助于初步预测其抗肿瘤转移药效。

图7 化合物1在50℃,D2O中的1H NMR图谱Fig.7 Stack plot of the1H NMR spectra of Compd.1 inD2O recorded in 0~75 min interval at 50 ℃

图8 化合物1(左图),化合物2(右图)水解的600 MHZ氢核磁谱(D2O,50℃)Fig.8 600 MHZ1H NMR spectra of hydrolysis of Compd.1(left)and Compd.2(right)in D2O recorded at 50 ℃
3 结 论
化合物1、化合物2与NAMI-A在生理盐水溶液中的氧化还原电位相差不大,两个化合物的水解产物的电位也基本未见明显差异,见表4及图6。
NAMI-A的Ⅰ氯、Ⅱ氯水解产物在体外能与模拟靶点蛋白配位结合[9-10];其脱DMSO的水解产物(肿瘤组织的低pH环境)能与模拟靶点DNA分子结合[8]。化合物1和化合物2的脱氯、脱DMSO水解机理与NAMI-A相似。研究NAMI-A衍生物的体外作用机理,比较衍生物的Ⅰ氯、Ⅱ氯水解、及DMSO水解反应机理、速率、半衰期,即各活性中间产物在生理溶液中的存在状态、时间是预测化合物的稳定性及药效的重要依据。相同条件下NAMI-A的Ⅰ氯、Ⅱ氯水解反应半衰期(t1/2)与化合物1、2的相应水解反应速率相差不大(表3),表明用甲基吡啶环取代咪唑环,对NAMI-A衍生物的Ⅰ氯、Ⅱ氯水解反应速率影响较小,但在咪唑环的2位引入推电子基则明显加速化合物的Ⅰ氯、Ⅱ氯及DMSO水解反应速率。化合物1、2在酸性溶液中的稳定性明显高于中性溶液。预计化合物1、2有与NAMI-A相似的抗肺癌或乳腺癌转移作用。
[1]Sava G,Dyson P J.Dalton Trans.,2006:1929-1933
[2]Bouma M,Nuijen B,Jansen M T,et al.Int.J.Pharm.,2002,248(1/2):239-246
[3]Bergamo A,Gava B,Alessio E,et al.Int.J.Oncol.,2002,21(6):1331-1338
[4]Kostova I.Curr.Med.Chem.,2006,13(9):1085-1107
[5]Rademaker-Lakhai J M,van den Bongard D,Pluim D,et al.Clin.Cancer Res.,2004,10(11):3717-3727
[6]Casini A,Mastrobuoni G,Terenghi M,et al.J.Biol.Inorg.Chem.,2007,12(8):1107-1117
[7]Bratsos I,Bergamo A,Sava G,et al.J.Inorg.Biochem.,2008,102(4):606-617
[8]Bacac M,Hotze A C,van der Schilden K,et al.J.Inorg.Biochem.,2004,98(2):402-412
[9]Messori L,Orioli P,Vullo D,et al.Eur.J.Biochem.,2000,267(4):1206-1213
[10]Frausin F,Scarcia V,Cocchietto M,et al.J.Pharmacol.Exp.Ther.,2005,313(1):227-233
[11]Sava G,Bergamo A,Zorzet S,et al.Eur.J.Cancer,2002,38(3):427-435
[12]Alessio E,Mestroni G,Bergamo A,et al.Curr.Top Med.Chem.,2004,4(15):1525-1535
[13]Chen J,Chen L,Liao S,et al.J.Phys.Chem.B,2007,111(27):7862-7869
[14]Besker N,Coletti C,Marrone A,et al.J.Phys.Chem.B,2008,112(13):3871-3875
[15]Vargiu A V,Robertazzi A,Magistrato A,et al.J.Phys.Chem.B,2008,112(14):4401-4409
[16]Delferro M,Marchio L,Tegoni M,et al.Dalton Trans.,2009(19):3766-3773
[17]Frasca D,Ciampa J,Emerson J,et al.Met.-Based Drugs,1996,3(4):197-209
[18]Brown J M,Giaccia A J.Cancer Res.,1998,58(7):1408-1416
[19]Ravera M,Baracco S,Cassino C,et al.Dalton Trans.,2004(15):2347-2351
[20]Reisner E,Arion V B,Keppler B K,et al.Inorg.Chim.Acta,2008,361:1569-1583
[21]Tannock I F,Rotin D.Cancer Res.,1989,49(16):4373-4384
[22]Mestroni G,Allesio E,Sava G.United States Patent,6,221,905 B1,2001-04-24
[23]Sava G,Pacor S,Bergamo A,et al.Chem.Biol.Interact.,1995,95(1/2):109-126
[24]Vaupel P,Kallinowski F,Okunieff P.Cancer Res.,1989,49(23):6449-6465
[25]Boyer M J,Tannock I F.Cancer Res.,1992,52(16):4441-4447
[26]Alessio E,Balducci G,Calligaris M,et al.Inorg.Chem.,1991,30:609-618
[27]LIANG Yao-Hua(梁曜华),LIANG Guo-Gang(梁国刚).J.Macau Univ.Sci.Technol.(Aomen Keji Daxue Xuebao),2008,2(1):36-42
[28]CHEN Yu(陈 禹),DU Ke-Jie(杜 可 杰),CHAO Hui(巢 晖),et al.Prog.Chem.(Huaxue Jinzhan),2009,21(5):836-844
[29]Bouma M,Nuijen B,Jansen M T,et al.J.Pharm.Biomed.Anal.,2003,31(2):215-228
[30]LIANG Yao-Hua(梁曜华),LIANG Guo-Gang(梁国刚).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24(12):1983-1988
[31]LIU Jie(刘杰),JI Niang-Lian(计亮年).P.R.China Patent,200610122701.8,2007-03-21
[32]Bouma M,Nuijen B,Challa Eric E,et al.J.Oncol.Pharm.Pract.,2004,10(1):7-15
Preparation and Mechanism-Kinetics of Antimetastasis of NAMI-A Derivatives Containing Pyridine
LIANG Yao-Hua1,2BI Wei2LIANG Guo-Gang*,1,2
(1Macau Institute for Applied Research in Medicine and Health,Macau University of Science and Technology,Macau,China)(2Institute of Chinese Material Medica,China Academy of Chinese Medical Science,Beijing 100700,China)
Objective To study the influence of ligand structure on the hydrolysis rate of anti-metastasis NAMI-A derivatives trans-[RuCl4(DMSO)(3-MePy)][(3-MePy)H](3-MePy=3-methypyridine,Compd.1)and trans-[RuCl4(DMSO)(4-MePy)][(4-MePy)H](4-MePy=4-methypyridine,Compd.2).Method Hydrolytic mechanism,kinetics,stability and electrochemistry of Compd.1 and Compd.2 were studied by UV-Vis,NMR and CV.Result The complexes undergo two well-separated steps of chloride hydrolysis at pH 7.40;while dimethyl sulfoxide(DMSO)hydrolyzed in pH 5.00 buffer solution.The Kobsand t1/2for each reaction were determined.Conclusion Very similar to NAMI-A,the compounds loses 1stand 2ndchloride in two separated steps at pH 7.40;and loses DMSO in pH 5.00 buffer solution.The hydrolytic rate of the compounds including two chlorides and DMSO hydrolysis were similar to that of NAMI-A,which demonstrated that the influence of replacing imidazole by methyl pyridine on the hydrolysis rate of NAMI-A derivatives is not remarkable.The stability of the compounds in acidic solution is much more stable than that of in neutral solution.
ruthenium complexes;anti-metastasis;hydrolytic kinetics;stabilities
O614.82+1
:A
:1001-4861(2011)04-0595-09
2010-09-06。收修改稿日期:2010-11-07。
澳门科技发展基金(No.012/2009/A1)、国家科技部国际合作基金(No.2005DFA30990)和中国中医科学院基本科研业务费自主选题项目(No.ZZ2006120,Z02089)资助。
*通讯联系人。 E-mail:Lguogang200@126.com;Tel:+0086-010-84033375
