1例国内罕见的输入性卵形疟的实验室检测*
2011-08-21师永霞黄吉城苏锦坤李小波幸芦琴郭波旋
师永霞,黄吉城,苏锦坤,李小波,幸芦琴,郑 夔,洪 烨,郭波旋
1例国内罕见的输入性卵形疟的实验室检测*
师永霞,黄吉城,苏锦坤,李小波,幸芦琴,郑 夔,洪 烨,郭波旋
目的 对1例输入性疑似疟疾患者的血样进行实验室检测。方法 制备疑似疟疾患者血样的血涂片,吉姆萨染色后进行疟原虫的镜检观察。利用实验室自行研制的疟原虫属特异性(通用型)和4种疟原虫种特异性的巢式PCR和实时荧光PCR检测方法,对该血样进行疟疾检测及分型。将PCR扩增片段进行序列测定,并与已知的卵形疟序列进行blast比对分析。结合血样的分子生物学检测结果,重新对镜检结果进行复核。结果 血样初次镜检为疟疾阴性。使用疟原虫巢式PCR通用引物对血样的DNA进行PCR检测,扩增出了预期大小约240bp的条带;巢式PCR分型检测表明,血样仅扩增出预期大小约450bp的卵形疟条带,无对应大小的恶性疟、间日疟和三日疟扩增条带产生。疟原虫通用型和卵形疟特异性的荧光PCR检测结果均为典型的S形阳性曲线,卵形疟扩增片段的熔解温度为72.5℃。序列分析表明,扩增片段长度为434bp,blast比对发现去除引物后的393个碱基与GenBank DQ845247等卵形疟的SSU rRNA对应部分的基因序列同源性为100%。重新对血涂片进行镜检复核,结果在薄血膜中发现了卵形疟的环状滋养体,被寄生的红细胞为椭圆形,边缘呈伞矢状。结论 使用巢式PCR、实时荧光PCR、序列分析和镜检等方法,证实该例输入性的疑似疟疾患者为卵形疟原虫感染。
输入性卵形疟;镜检;巢式PCR;实时荧光PCR;序列分析
卵形疟原虫感染经常发生在中东、西非和印度尼西亚等地,在东南亚泰缅边界和孟加拉国境内也有卵形疟的发病报道[1-3]。我国本土疟疾以间日疟为主,其次是恶性疟,三日疟偶尔可见,卵形疟已无报告。卵形疟原虫感染者血中虫体数量少,在厚血膜中易与间日疟和三日疟原虫混淆,不易识别,仅有薄血片可用于形态学诊断,所以使用传统的吉姆萨染色观察法进行镜检时易对卵形疟原虫感染漏检[4]。本研究将传统镜检法与巢式PCR和实时荧光PCR等分子生物学检测技术相结合,对一例国内罕见的输入性卵形疟原虫感染进行了实验室检测。
1 材料与方法
1.1 材料
1.1.1 样本来源 入境旅客卞某的EDTA抗凝血样,4℃保存。该旅客在赤道几内亚国家工作两年,期间染疟疾,曾多次反复发作,入境时查体为38.3℃。
1.1.2 主要试剂 核酸提取试剂盒(QIAamp DNA Blood Extraction Minikit)和SYBR荧光PCR试剂(QuantiTect SYBR Green PCR Kit)购自 Qiagen公司,探针法荧光PCR试剂(TaqMan○RFast U-niversal PCR Master Mix(2×)购自ABI公司,Taq酶购自Roche公司,100bp DNA Ladder Marker和琼脂糖购自TaKaRa公司,吉姆萨染色液购自珠海贝索生物公司。
1.2 方法
1.2.1 引物和探针设计 根据疟原虫的小亚单位核糖体核糖核酸 (small subunit ribosomal RNA,SSU rRNA)基因序列[5],设计了疟原虫属特异性和四种疟原虫种特异性引物和探针,序列见表1,用于疟疾巢式PCR和实时荧光PCR检测及分型。合成上下游引物间的DNA片段作为PCR扩增时的阳性对照。引物、探针和DNA片段委托上海生工生物技术有限公司合成。

表1 疟原虫检测的引物和探针Table 1 Primers and probes used to detect Plasmodium
1.2.2 巢式PCR 设反应总体系25μL,PCR第1次扩增体系包括 PCR buffer 2.5μL、10μmol/L dNTP 0.5μL、10μmol/L 引 物 rPLUout-FP 和rPLUout-RP各0.5μL、Taq酶0.25μL、无菌双蒸水15.75μL、DNA模板5μL,混匀后进行PCR反应。PCR反应程序为:94℃2min;94℃1min,52℃1min,72℃2min,35个循环;72℃ 10min;4℃。巢式PCR第2次扩增体系包括PCR buffer 2.5μL、10μmol/L dNTP 0.5μL、10μmol/L 通用型上下游引物rPLUin-FP、rPLUin-RP各0.5μL或4种疟原虫特异性上下游引物各0.5μL、Taq酶0.25μL、无菌双蒸水18.75μL以及2μL第1次PCR产物;同时设立阴性和阳性对照,阴性对照使用无菌水,阳性对照使用合成的疟疾DNA片段。PCR反应程序为:94℃2min;94℃1min,58℃1 min,72℃1min,35个循环;72℃10min;4℃。
1.2.3 实时荧光PCR检测 疟原虫通用荧光PCR检测采用探针法进行,反应总体积20μL,包括Master Mix 10μL、10μmol/L 引 物 Plas-FP 和Plas-RP各 1μL、5μmol/L 探针 Plas-Pro 1μL、DNA 7μL,同时分别以DEPC H2O和DNA阳性模板作为阴性和阳性对照。扩增和检测在ABI 7900HT Fast荧光定量PCR仪器上进行,反应程序为:95℃20s;95℃1s,58℃20s(收集荧光),40个循环。采用染料掺入法进行卵形疟的实时荧光PCR检测,反应体系为25μL,包括2×PCR buffer 12.5μL、10μmol/L上下游引物OVA-FP和OVARP各0.75μL、DEPC H2O 9μL以及疟原虫模板DNA 2μL。实时荧光PCR反应程序为:95℃15 min;94℃15s,50℃30s,72℃30s(收集荧光),40个循环;最后对PCR产物进行熔解曲线分析。
1.2.4 扩增产物电泳分析 取5μL扩增产物经1.5%琼脂糖凝胶电泳,GelGreen染色,凝胶成像系统观察结果并拍照。
1.2.5 序列测定和分析 扩增的PCR片段由上海英骏生物技术有限公司进行序列测定,再对碱基组成进行blast比较分析。使用DNASTAR软件对该序列与其他卵形疟序列进行比对并进行进化树分析。
2 结 果
2.1 血样的镜检分析 制备血样的厚血膜和薄血膜涂片,吉姆萨染色后进行油镜观察。初次镜检判断为阴性,复核时在薄血膜中发现了卵形疟的环状滋养体,被寄生的红细胞为椭圆形,边缘呈伞矢状(图1)。
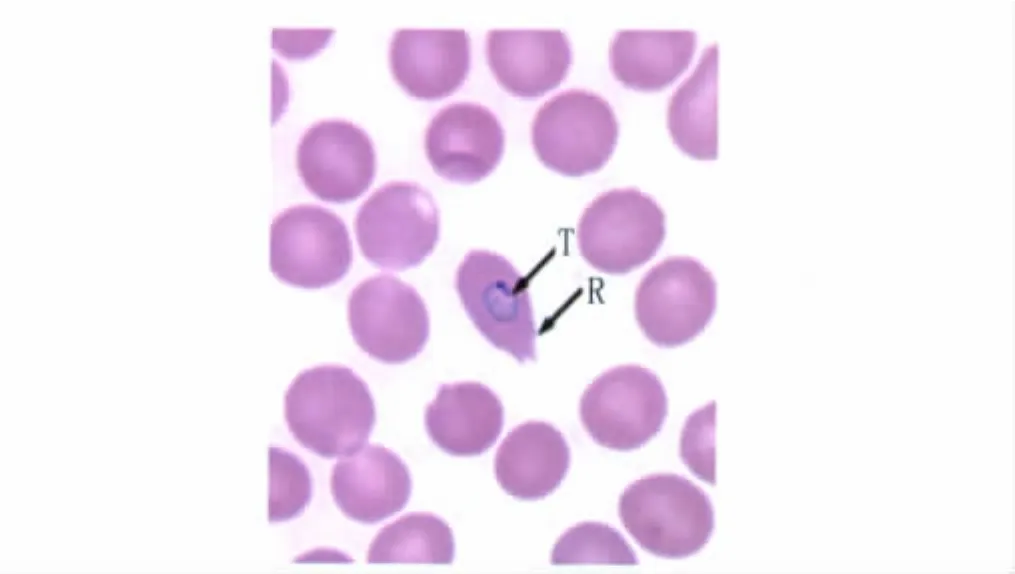
图1 血涂片吉姆萨染色镜检观察Fig.1 Microscopic observation of Giemsa stained blood smears.
2.2 血样的巢式PCR检测 提取血样的DNA进行疟疾的通用型和特异性的巢式PCR检测,结果如图2和图3。使用疟疾的通用引物PCR扩增出了预期大小约240bp的条带(图2),使用卵形疟的特异性引物PCR扩增出了预期大小约450bp的条带(图3),恶性疟、间日疟和三日疟引物对没有扩增条带产生。
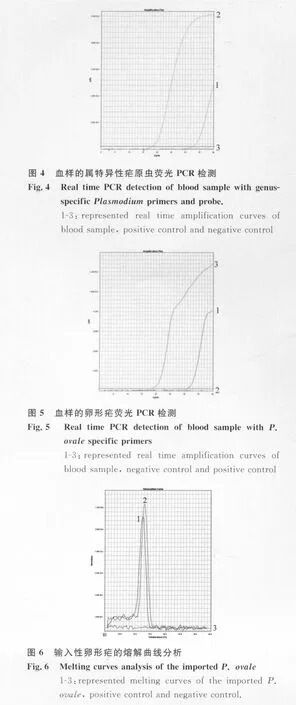
2.3 血样的实时荧光PCR检测 疟原虫属特异性的荧光PCR检测结果显示(见图4),血样扩增出了典型的S形曲线,为疟疾阳性。进一步的疟原虫特异性荧光PCR检测结果表明,该患者为卵形疟感染(图5),扩增片段的Tm值为72.5℃(图6)。

2.4 扩增片段的序列分析 将输入性卵形疟的巢式PCR扩增片段送去测序。序列分析表明,扩增片段长度为434bp,将该序列递交到GenBank上,GenBank登录号为JF505386。blast比对发现去除引物后的393bp扩增片段与卵形疟SSU rRNA(GenBank 登 录 号 为 DQ845247、AB182491、AB182492、AB182493、AJ001527和 X99790)对应部分的基因序列同源性为100%。
3 讨 论
为了响应联合国千年发展目标高级别会议提出的在全球根除疟疾的倡议,卫生部制定和颁布了“中国消除疟疾行动计划(2010-2020年)”,但在我国,周边的缅甸、老挝等东南亚国家和与我国直航的非洲等传统疟疾高发地区带来的输入性疟疾疫情为我国疟疾防治工作带来日益严重的威胁。目前疟疾诊断以镜检为主,它不但需要操作者具有丰富的经验,而且有一定的局限性。当血中原虫密度较低(<50个/μL)时,靠镜检难以查到原虫,容易出现漏诊[7];由于国内少见三日疟和卵形疟,容易将两者误判为形态和临床症状相似的间日疟和恶性疟[1-2];当发生疟原虫混合感染时,容易出现误诊[8-10];镜检耗时,不适用于大量人群的筛查。
本研究对一例来自非洲赤道几内亚国家的入境、疑似疟疾旅客的血样进行了实验室检测。血涂片初次镜检结果为疟疾阴性,但该血样的属特异性巢式PCR和属特异性的实时荧光PCR检测均为疟原虫核酸阳性。进一步的种特异性巢式PCR检测发现,血样扩增出了卵形疟预期大小约450bp的条带,无其它种类疟原虫混合感染。利用染料掺入法进行卵形疟的特异性实时荧光PCR检测,血样的检测结果为卵形疟阳性,扩增片段特异性好,Tm为72.5℃。序列分析表明,虽然用于PCR扩增的上游引物和下游引物的序列与GenBank DQ845247、AB182491等卵形疟对应部分分别有3个和1个碱基不同,但去除引物后的扩增片段碱基组成与上述卵形疟的序列完全相同,这证实了该例疟疾为输入性卵形疟,说明在非洲中西部国家有卵形疟的分布。随后,我们对血涂片进行复核,结果在薄血膜中发现了卵形疟的环状滋养体,形态与间日疟相似;被寄生的红细胞为椭圆形,边缘呈伞矢状。这表明使用传统的镜检法易对卵形疟原虫感染漏检,与Win等研究结果相似[1]。
[1]Win TT,Lin K,Mizuno S,et al.Wide distribution ofPlasmodiumovalein Myanmar[J].Trop Med Int Health,2002,7(3):231-239.
[2]Zhou M,Liu Q,Wongsrichanalai C,et al.High prevalence ofPlasmodiummalariaeandPlasmodiumovalein malaria patients along the Thai-Myanmar border,as revealed by acridine orange staining and PCR-based diagnoses[J].Trop Med Int Health,1998,3(4):304-312.
[3]Fuehrer HP,Starzengruber P,Swoboda P,et al.IndigenousPlasmodiumovalemalaria in Bangladesh[J].Am J Trop Med Hyg,2010,83(1):75-78.
[4]黄兴周,赵春星,周高云.卵形疟1例报告[J].中国寄生虫病防治杂志,1994,7(2):103.
[5]Rougemont M,Van Saanen M,Sahli R,et al.Detection of fourPlasmodiumspecies in blood from humans by 18SrRNA gene subunit-based and species-specific real-time PCR assays[J].J Clini Microbiol,2004,42(12):5636-5643.
[6]师永霞,苏锦坤,洪烨,等.疟疾的实时荧光PCR快速检测方法[J].中国卫生检验杂志,2011,21(3):625-627.
[7]Gama BE,Silva-Pires Fdo E,Lopes MN,et al.Real-time PCR versus conventional PCR for malaria parasite detection in lowgrade parasitemia[J].Exp Parasitol,2007,116(4):427-432.
[8]Swan H,Sloan L,Muyombwe A,et al.Evaluation of a realtime polymerase chain reaction assay for the diagnosis of malaria in patients from Thailand[J].Am J Trop Med Hyg,2005,73(5):850-854.
[9]Ndao M,Bandyayera E,Kokoskin E,et al.Comparison of blood smear,antigen detection,and nested-PCR methods for screening refugees from regions where malaria is endemic after a malaria outbreak in Quebec,Canada[J].J Clin Microbiol,2004,42(6):2694-2700.
[10]Perandin F,Manca N,Piccolo G,et al.Identification ofPlasmodiumfalciparum,P.vivax,P.ovaleandP.malariaeand detection of mixed infection in patients with imported malaria in Italy[J].New Microbiol,2003,26(1):91-100.
Laboratory diagnosis of a suspected case of importedPlasmodiumovaleinfection
SHI Yong-xia,HUANG Ji-cheng,SU Jin-kun,LI Xiao-bo,XING Lu-qin,ZHENG Kui,HONG Ye,GUO Bo-xuan
(HealthQuarantineLab,GuangdongInspectionandQuarantineTechnologyCenter,GuangdongEntry-ExitInspectionandQuarantineBureau,Guangzhou510700,China)
Blood smear of suspected imported malaria patient was prepared and observed by microscopy after Giemsa staining.Initial microscopy of the blood sample was negative for malaria.Nested PCR and real-time PCR methods of genusspecificPlasmodiumand four species-specificPlasmodiumwere performed to detect and differentiate the parasites using inhouse designed primers and probes.Nested PCR with the genus-specific primers ofPlasmodiumshowed that the blood sample produced an expected band of about 240bp in size.Plasmodiumclassification demonstrated that the blood sample only produced an expected amplification band of about 450bp ofP.ovalein size and no bands ofP.falciparum,P.vivaxandP.malarie.Real time PCR with bothPlasmodiumand specificP.ovaledisplayed typical S-shaped positive curves.Sequence analysis showed that the amplified fragment was composed of 434bases and 393bases removing PCR primers showed 100%homology to the corresponding part ofP.ovaleSSU rRNA gene of GenBank accession number DQ845247.Blood smear was reviewed by microscopy.The ring trophozoites ofP.ovalewere founded in thin blood film and the parasitized cell was oval in shape with fimbriated edges.The suspected case of imported malaria patient was confirmed to infectP.ovaleby nested PCR,real-time PCR,sequence analysis and microscopic examination.
importedPlasmodiumovale;microscopic examination;nested PCR;real time PCR;sequence analysis
R382.3
A
1002-2694(2011)10-0914-04
*广东出入境检验检疫局科技计划项目(No.2007GDK32)
师永霞,Email:syx0817@yahoo.com.cn
广东出入境检验检疫局检验检疫技术中心卫生检疫实验室,广州 510700
2011-06-21;
2011-08-03
