激活素A及卵泡抑素基因在糖尿病大鼠肾脏表达的实验研究*
2011-05-15任小军关广聚
任小军 柳 刚 关广聚
1 山西省人民医院肾内科,山西省太原市 030012; 2 山东大学第二医院肾内科
糖尿病肾病(diabetic nephropathy,DN)过去一直被认为是一种肾小球疾病,而新近的研究表明,小管损伤和进行性间质纤维化与DN的预后关系更为密切[1]。DN小管间质病变的核心是细胞外基质(extracellular matrix,ECM)在损伤区的过量堆积[2]。多种细胞因子和生长因子参与了ECM的生成和降解,其中转化生长因子-β(transforming growth factor-beta,TGF-β)超家族成员发挥了重要作用。根据结构和分子生物学差异,TGF-β超家族可以细分为三个主要家族:TGF-β、骨形成蛋白(bone morphogenetic protein,BMP)和激活素(activin,ACT)[3]。TGF-β是公认的最强的促纤维化因子,BMP7可对抗TGF-β的作用。而ACT是否参与了DN小管间质纤维化,目前还未见相关报道。ACT是由两个β亚单位借二硫键构成的二聚体蛋白,按照β亚基构成的不同,ACT分为三种形式:ACT-A(βAβA)、ACT-B(βBβB)、ACT-AB(βAβB),目前研究最多的是ACT-A[4]。卵泡抑素(follistatin,FS)是ACT的天然结合蛋白,二者共同构成一个维持组织器官正常生长和代谢的自动平衡系统[5]。本实验通过体内链脲佐菌素(STZ)诱导的DM动物模型,探讨ACT-A及FS基因在糖尿病大鼠肾脏的表达,从而为进一步阐明DN的发病机制及临床防治提供新的思路。
1 材料和方法
1.1 实验材料
1.1.1 实验动物:清洁级雄性Wistar大鼠,6周龄,体重(200±20)g之间,由山东大学实验动物中心提供。
1.1.2 主要试剂:STZ购自美国Sigma公司;尿白蛋白试剂盒购自北京福瑞公司;反转录和荧光定量PCR试剂盒购自日本Takara公司。
1.1.3 引物设计:引物均由上海生物工程公司合成。见表1。
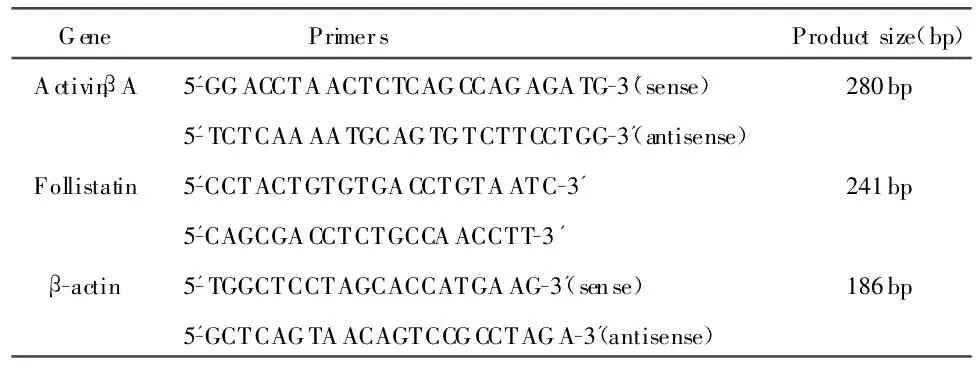
表1 引物序列
1.2 实验方法
1.2.1 动物模型和分组:将雄性Wistar大鼠随机分成糖尿病组(DM)和对照组(NC)。DM 组在禁食12h后一次性腹腔注射STZ 60mg/kg(临用前溶于0.1mo1/L柠檬酸缓冲液,1∶50稀释,pH4.4),NC组给予相同剂量的溶媒。给药72h后尾静脉采血测随机血糖(BS)>16.7mmo1/L为糖尿病大鼠。所有大鼠标准饲料饲养,自由饮水。各组分别于造模后4、8、12、16周处死大鼠 6只。处死前 1d,大鼠称重后单只置于代谢笼中,准确收集24h尿液。腹主动脉取血后分离左肾,置液氮待做PCR检测。
1.2.2 生化指标:尿白蛋白排泄率(AER)检测采用放免法。肾脏肥大指数用左肾重/体重(KW/BW)表示。BS、血肌酐(Scr)及尿肌酐(Ucr)用 HITACH-7150自动生化分析仪检测,肌酐清除率(Ccr)按公式:Ucr×每分钟尿量(ml)/Scr计算,并以体重校正。
1.2.3 real time-PCR检测:取全肾组织约50mg左右,按照经典方法用 Trizol试剂、氯仿和异丙醇进行抽提mRNA。检测纯度,按反转录试剂盒的说明进行反转录,引物由上海生工合成。采用ABI PRISM 7000 HT进行real-time PCR,获得Ct值。根据公式:Folds=2-ΔΔCt进行各组间比较分析。
2 结果
2.1 一般生化指标的变化 DM组大鼠腹腔注射STZ后,BG 明显升高,呈消瘦、多饮、多食、多尿、自主活动减少等典型的糖尿病症状。实验第8周,NC组大鼠体重明显增加,DM组大鼠体重增加缓慢,DM组大鼠肾脏肥大指数(KW/BW)与NC组相比明显增加,差异有统计学意义(P<0.01)。与NC组相比,DM组大鼠AER及Ccr从第8周开始呈逐渐增高趋势,差异有统计学意义(P<0.01);DM组内16周末与8周末比较亦有统计学差别(P<0.01)。见表1。
表2 各组大鼠BS、AER、KW/BW 及Ccr的变化( ±s)
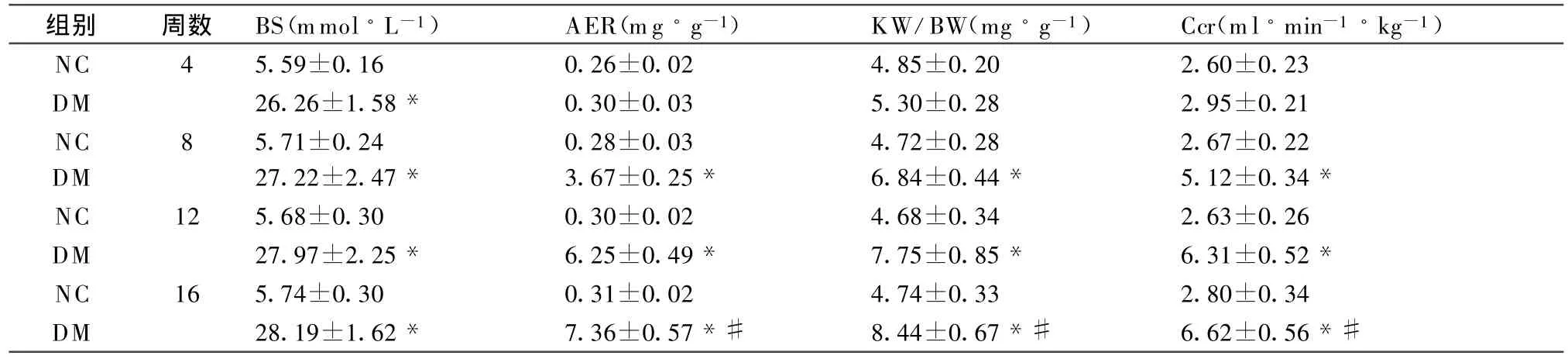
表2 各组大鼠BS、AER、KW/BW 及Ccr的变化( ±s)
注:与NC组同一时间点比较,*P<0.01;DM组内16周末与8周末比较,#P<0.01。
组别 周数 BS(mmol◦L-1) AER(mg◦g-1) KW/BW(mg◦g-1) Ccr(ml◦min-1◦kg-1)NC 4 5.59±0.16 0.26±0.02 4.85±0.20 2.60±0.23 DM 26.26±1.58* 0.30±0.03 5.30±0.28 2.95±0.21 NC 8 5.71±0.24 0.28±0.03 4.72±0.28 2.67±0.22 DM 27.22±2.47* 3.67±0.25* 6.84±0.44* 5.12±0.34*NC 12 5.68±0.30 0.30±0.02 4.68±0.34 2.63±0.26 DM 27.97±2.25* 6.25±0.49* 7.75±0.85* 6.31±0.52*NC 16 5.74±0.30 0.31±0.02 4.74±0.33 2.80±0.34 DM 28.19±1.62* 7.36±0.57*# 8.44±0.67*# 6.62±0.56*#
2.2 肾组织ACTβA及FS mRNA表达的变化ACTβA mRNA在NC组只有极微量表达,而DM组大鼠肾组织ACTβA mRNA从第4周起即明显增加(NC组的3.3倍),于12周时达峰值(NC组的7.7倍),16周时表达量略有下降,但仍明显高于NC组(P<0.01)。与 ACTβA相反,FS mRNA 在NC组各时间点大鼠肾组织大量表达,而在DM组其表达量呈逐渐下降趋势,第4周下降了32.5%,第12周时下降了52.9%,第16周时只能检测到基础量表达。见图1。
3 讨论
ACT最早在性腺发现的糖蛋白激素,因特异性促进垂体细胞合成及分泌卵泡刺激素(FSH)而得名,后来发现它具有多种生物功能,属于TGF-β超家族成员,其作用不仅局限于性腺,而且在组织细胞生长分化、骨形成、胚胎发育、免疫调节、组织损伤修复及炎症反应过程中均发挥了重要作用。目前研究最多的是ACT-A[3]。FS也是由性腺分离的糖蛋白激素,可抑制垂体细胞分泌FSH,还可与ACT-A高度亲和力的结合,阻断ACT-A的生物学效应[6]。类似于TGF-β,ACT-A的适度表达有助于组织损伤修复,但其过度表达可促进组织纤维化的形成。ACT-A表达与肾脏关系密切。胚胎肾脏发育过程中,输尿管芽可以检测到ACT-A。外源性ACT-A可以缩小胚胎肾发育体积,减少肾单位数量[7]。正常成年大鼠肾小管ACT-A几乎检测不到,而FS则大量表达。在肾缺血时,外髓肾小管上皮ACT-A分泌增加,而FS则明显下降。将rh-ACT-A注入肾缺血大鼠体内,可促进肾小管上皮细胞凋亡,抑制肾小管上皮细胞增殖,加重小管损伤[8]。ACT-A在DN小管间质病变中是否发挥一定的作用,目前还未见相关报道。
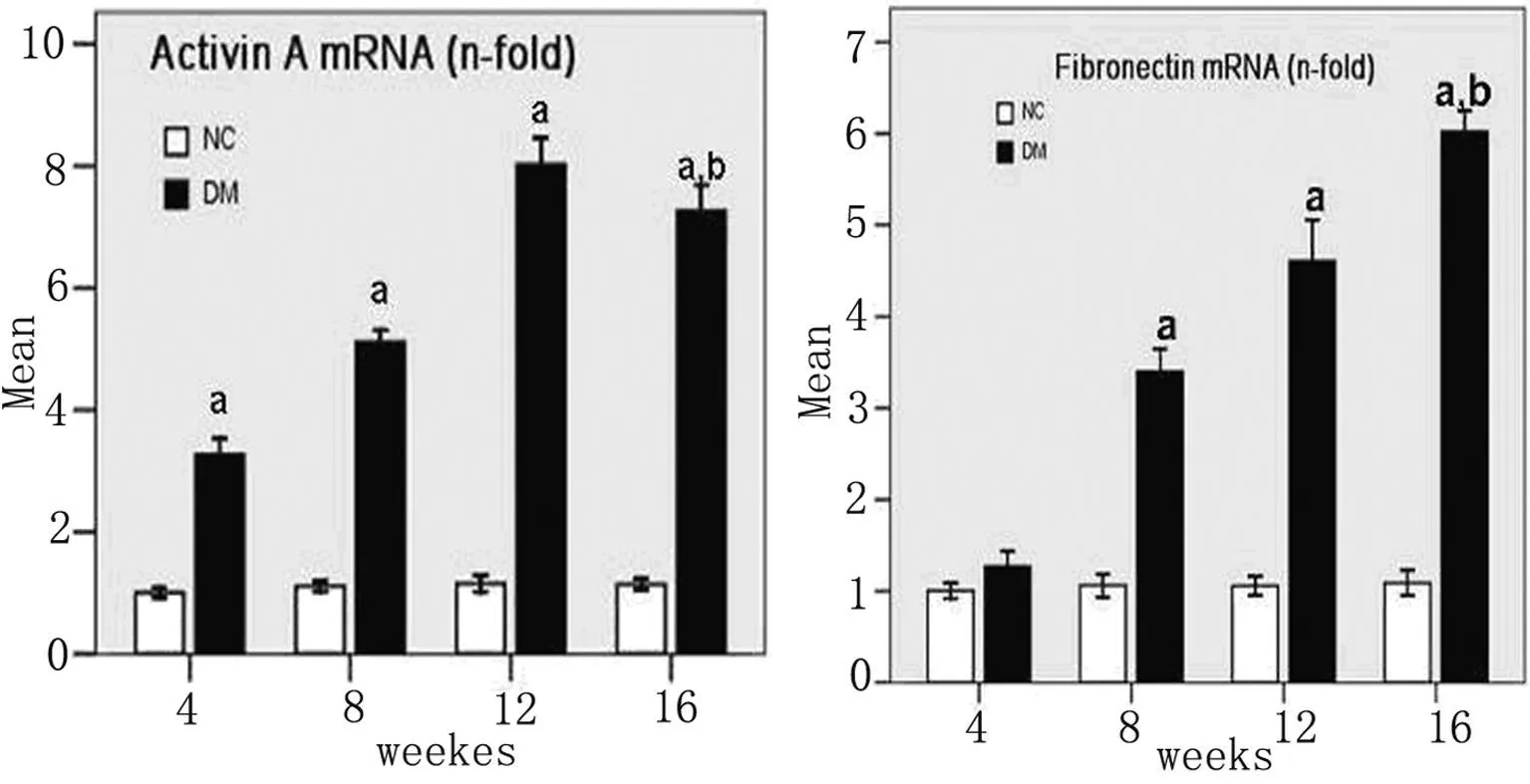
图1 real-time PCR检测ACT A和FN的基因表达
本研究表明,从实验第8周开始,DM组大鼠AER和Ccr表达增加并于16周时达峰值,符合DN早期功能改变。本研究发现,在STZ诱导的DM大鼠,ACT-A基因在实验第4周,肾脏功能损伤缺如时,在肾脏表达即开始上调,并于12周时达峰值;与之相反,ACT-A的拮抗剂FS,在NC组大鼠肾脏大量表达,而在DM组,其表达量逐渐下降,呈时间依赖性。这一结果提示ACT-A/FS表达失衡在糖尿病大鼠肾脏损伤的进行性发展中发挥了重要作用。但ACT-A参与糖尿病肾损伤的具体信号转导机制及外源性补充FS是否可延缓糖尿病肾损伤有待进一步体内外实验证实。
[1] Thomas MC,Burns WC,Cooper M E.Tubular changes in early diabetic nephropathy〔J〕.Adv Chronic Kidney Dis,2005,12:177-186.
[2] Mason RM,Wahab NA.Ex tracellular matrix metabolism in diabetic nephropathy〔J〕.J Am Soc Nephrol,2003,14:1358-1373.
[3] Peng C.T he TGF-beta superfamily and its roles in the human ovary and placenta〔J〕.J Obstet Gynaecol Can,2003,25:834-844.
[4] Welt C,Sidis Y,Keutmann H,et al.Activins,inhibins,and follistatins:from endocrinology to signaling.A paradigm fo r the new millennium〔J〕.Exp Biol Med(Maywood),2002,227:724-752.
[5] T hompson T B,Lerch T F,Cook RW,et al.T he structure of the follistatin:activin complex reveals antagonism of both typeⅠ and type Ⅱ receptor binding〔J〕.Dev Cell,2005,9:535-543.
[6] Hashimoto O,Nakamura T,et al.A novel role of follistatin,an activin-binding protein,in the inhibition of activin action in rat pituitary cells〔J〕 .J Biol Chem,1997,272:13835-13842.
[7] Maeshima A,Nojima Y,Kojima I.The role of the activin-follistatin sy stem in the developmental and regeneration processes of the kidney〔J〕.Cytokine Growth Factor Rev,2001,12:289-298.
[8] Maeshima A,Zhang YQ,Nojima Y,et al.Involvement of the activin-follistatin system in tubular regeneration after renal ischemia in rats〔J〕 .J Am Soc Nephrol,2001,12:1685-1695.
