肝癌特异性启动子调控的双靶位慢病毒载体的构建、鉴定及其在肝癌基因治疗中的应用*
2011-04-12徐震牛坚刘斌
徐震 牛坚 刘斌
(1.徐州医学院研究生院,江苏徐州221002;2.徐州医学院附属医院普外科,江苏徐州221006)
基因治疗是一种新的治疗肿瘤的方法,其难点是效益基因在肿瘤细胞中的靶向性及其高效表达。而survivin基因在成人正常细胞中不表达,在肝癌细胞中表达其启动子具有良好的靶向性。胰岛素样生长因子1类受体表达与肿瘤发生关系密切。
本实验通过构建AFP-PRIME-miR30-shRNA-IGF1R慢病毒,探讨其对肝癌细胞生物学行为影响,为肝癌基因治疗拓展新的思路。
1 资料与方法
1.1 主要试剂
兔抗人 IGF1R多克隆抗体:Sant Cruze公司;Lipofectamin2000:Invitrogen公司;限制性内切酶ScaI、ClaⅠ、SpeI、PmeI、XhoⅠ、EcoRⅠ、ApaI和 NheI,T4 DNA连接酶,购于大连宝生物公司;CCK-8试剂盒:DOJINDO公司;质粒提取试剂盒、回收试剂盒购于上海生物工程有限公司;PCR引物和其他试剂购于博亚公司。
1.2 主要材料
1.3 包膜质粒pMD2G-anti-AFP-scFv质粒的构建
以表达anti-AFP-scFv的质粒pMON-scFv为模板,设计两端含SacⅠ和ClaⅠ的酶切位点的引物。

将anti-AFP-scFv基因片段插入包膜质粒pMD2G的SacⅠ和ClaⅠ位点,构建pMD2G-anti-AFP-scFv质粒。
1.4 穿梭质粒pPRIME-miR30-shRNA-IGF1R的构建
从NCBI里找到人IGF1R基因的cDNA序列全长,genbank号为NM_00875。利用网上的设计工具(genesil等)进行siRNA片段的筛选,将选出合适的目标序列进行合成,并引入XhoⅠ、EcoRⅠ酶切位点。

形成穿梭质粒pPRIME-miR30-shRNA-IGF1R。酶切电泳鉴定及测序鉴定。
1.5 survivin-CMV肝癌特异性启动子的克隆
以含survivin-CMV肝癌特异性启动子的pBluescriptII-survivin-CMV为模板,设计上游含apaI和下游含NheI的酶切位点的引物。

1.6 穿梭质粒survivin-CMV-pPRIME-miR30-shRNA-IGF1R的构建
survivin-CMV启动子PCR扩增产物以ApaI和 NheI双酶切,连接至同样双酶切的pPRIME-miR30-shRNA-IGF1R,替换穿梭质粒pPRIME中的CMV启动子,转化大肠杆菌DH5α,扩增,提取质粒,用ApaI和NheI双酶切鉴定,测序,提取质粒名为sur-CMV-pPRIME-miR30-shRNA-IGF1R。
1.7 病毒的包装、鉴定和扩增纯化
1.7.1 病毒的包装、鉴定 将质粒(pPRIME、pMD2G、psPAX2)、(sur-CMV-pPRIME-miR30-shRNA-IGF1R、pMD2G-anti-AFP-scFv、psPAX2)分别通过Lipofectamin2000共转染293T细胞,经过病毒空斑纯化,包装成完整病毒颗粒。提取重组病毒DNA,PCR分析、测序鉴定正确者,即为目的病毒PRIME、AFP-PRIME-miR30-shRNA-IGF1R。
1.7.2 病毒的扩增及滴度测定 取96孔板,每孔加293T细胞1×104个,加液量200μL,孵箱培养24h后更换无血清培养液;待测病毒用DMEM完全培养液稀释10-1、10-2、10-3、10-4、10-5、10-6等稀释度。每一浓度设3复孔,每孔每一浓度取病毒溶液200μL,同时设培养液对照;在37℃、5%CO2孵箱中继续培养36~48h。镜检观察CEP现象,按公式计算出病毒滴度:病毒滴度(pfu/mL)=每孔细胞数×病毒稀释倍数×10/加入的病毒溶液量(mL)。
煤成说学代表者有郭则华(1981年)、陈安定等(2004年)认为:沥青煤是石油烃类的衍生矿物,石油的演化是形成沥青煤的主要机理。这种沥青煤实际上就是碳沥青。其成因为古油藏遭受破坏而形成,即油气散失过程中,在油气逸散通道中,由于重质成分不断残存、充填,最终完全堵塞了裂缝和孔洞而形成的。
1.8 RT-PCR检测IGF1R在mRNA水平的变化
将L-02、SMMC7721细胞低密度铺于6孔板,一天后用MOI=10的PRIME、AFP-PRIME-miR30-shRNA-IGF1R感染细胞,未处理的细胞作为对照组。48h后Trizol法提取各组细胞的总RNA,逆转录反应使用随机引物OligdTs合成第一链(严格按照厂家说明书进行),在20μL反应体系中加入2μg总cDNA。IGF1RmRNA检测引物序列为:上游:5'-GGAGGCTGAATACCGCAAAGTC-3',下游:5'-AAAGACGAAGTTGGAGGCGCT-3',扩增产物为 398bp;内参照 β-actin,上游:5'-GTGAAGGTGACAGCAGTCGGTT-3',下游:5'-CAGTGTACAGGTAAGCCCTG-3'。退火温度均为55℃。在同一条件下,每次PCR以β-actin为内参照,PCR产物经2%琼脂糖凝胶电泳,凝胶成像仪扫描成像,表达丰度以特异基因条带亮度与内参照的比值表示。
1.9 Western-blot鉴定IGF1R的表达
将L-02、SMMC7721细胞铺于6孔板,一天后用MOI=10.0的PRIME、AFP-PRIME-miR30-shRNA-IGF1R感染细胞,未处理的细胞作为对照组。48h后提取核蛋白,取40μg细胞裂解液与上样缓冲液混合,煮沸10min后上样,进行SDS-聚丙烯酰胺凝胶电泳。电泳条件:60伏,30min;160伏,1.5h。电泳结束后,电转移法将蛋白从凝胶中转移到PVDF膜上,甲醇固定PVDF膜后,用含5%脱脂奶粉的封闭液40℃孵育过夜。一抗10mL(1∶1000稀释)室温孵育2h,二抗10mL(1∶5000稀释)室温孵育2h后,PVDF膜用ECL化学发光试剂盒处理并在暗室显影。
1.10 竞争性抑制试验
选择AFP阳性率的SMMC7721细胞株为观察对象,在细胞感染慢病毒前6h事先加入抗AFP单抗,然后加入慢病毒共同培养48h,观察绿色荧光细胞数量的变化。
1.11 CCK-8法检测细胞生长
参照DOJINDO的Cell Count Kit-8,具体操作如下,分别取对数生长期的各组细胞,以每孔4×104~5×104个细胞接种于96孔板中,每孔体积为200μL;24h后换不含胎牛血清的DMEM培养液,继续培养24h使细胞静止;将MOI=10的 PRIME、 AFP-PRIME-miR30-shRNA-IGF1R感染SMMC7721细胞,感染48h后,吸尽待测孔内培养上清液;在酶联免疫分析仪上测定各孔光吸收值(OD)绘制生长曲线,观察各组细胞连续7d的细胞的增殖情况。每孔设3个复孔。
1.12 统计学处理
数据以均数±标准差表示,经SAS6.12统计软件进行t检验分析,P<0.05为差异有显著意义。
2 结果
2.1 anti-AFP-scFv基因片段PCR及电泳结果
以表达anti-AFP-scFv的质粒pMON-scFv为模板,设计两端含SacⅠ和ClaⅠ的酶切位点的引物。ScFv基因由696bp构成,包含312bp中的VL和339bp的VH和两者之间有45bp的连接序列,扩增片段696bp(图1)。与预期结果吻合,测序正确。

图1 VH、VL和ScFv基因PCR扩增产物凝胶电泳
2.2 穿梭质粒pPRIME-miR30-shRNA-IGF1R的鉴定
将pPRIME-miR30-shRNA-IGF1R行XhoⅠ、EcoRⅠ酶切鉴定(图2),鉴定结果与预期相符。片段大小为96bp左右,但因为片段太小不易观察到,电泳结果示:pPRIME-miR30-shRNA-IGF1R与对照组pPRIME酶切相比,未见1100bp左右的带型,且后面的带位于同一条线上,结果与预期相符。此时命名慢病毒重组载体为pPRIME-miR30-shRNA-IGF1R。

图2 pPRIME-m iR30-shRNA-IGF1R的双酶切鉴定
2.3 survivin-CMV嵌合启动子的鉴定
以含survivin-CMV肝癌特异性启动子的pBluescriptII-sur vivin-CMV为模板,PCR扩增产物经ApaI和NheI、双酶切,连接至同样双酶切的pPRIME-miR30-shRNA-IGF1R,转化大肠杆菌DH5α,挑取重组阳性克隆,经ApaI和NheI双酶切鉴定(图3),片段大小为860bp左右,结果与预期相符。测序测序结果表明合成的surn-CMV嵌合启动子插入正确,此时命名慢病毒重组载体为sur-CMV-pPRIME-miR30-shRNA-IGF1R。

图3 survivin-CMV嵌合启动子的双酶切鉴定
2.4 转染293T细胞的效应
表达质粒共转染293T细胞,细胞部分融合,多核复合体出现,随着病毒增殖,细胞内可见多量病毒颗粒,并逐渐从壁上脱落,出现细胞病理效应。病毒滴度测定结果显示重组慢病毒表达克隆的滴度为4.58×l09pfu/L。
2.5 RT-PCR结果
RT-PCR产物经2%琼脂糖凝胶电泳,398bp可见特异性IGF1R目标条带(图4),AFP-PRIME-miR30-shRNA-IGF1R中IGF1R的表达较对照组明显减低,经灰度扫描及与内参照比较分析,干扰组IGF1RmRNA的表达量仅为对照组的4%(P<0.05),而转染正常胎肝细胞L-02后IGF1R的表达与对照组比较无明显变化。

图4 RT-PCR检测感染慢病毒AFP-sur-CMV-PRIME-miR30-shRNA-IGF1R后IGFIRmRNA的表达
2.6 Western blot检测结果
实验发现慢病毒AFP-sur-CMV-PRIME-miR30-shRNA-IGF1R转染SMMC7721细胞,48h后细胞内的IGF1R的表达与对照组比较明显下降,约为对照组的9%(P<0.05),而转染正常胎肝细胞L-02后,IGF1R蛋白的表达与对照组比较无明显变化。见图5。
2.7 竞争性抑制试验
选择AFP阳性率的SMMC7721细胞株为观察对象,在细胞感染慢病毒前6h事先加入抗AFP单抗,然后加入慢病毒共同培养48h,加单抗为(7.5±0.4)%,未加单抗为(76±1.2)%(P<0.05),见图6。
2.8 AFP-PRIME-miR30-shRNA-IGF1R对SMMC7721细胞增殖的影响
从实验组和对照组的细胞生长曲线(图7)可以看出,实验组细胞的生长明显慢于对照组(P<0.05)。

图5 Western-blot检测感染AFP-sur-CMV-PRIME-m iR30-shRNA-IGF1R后IGFIR蛋白的表达
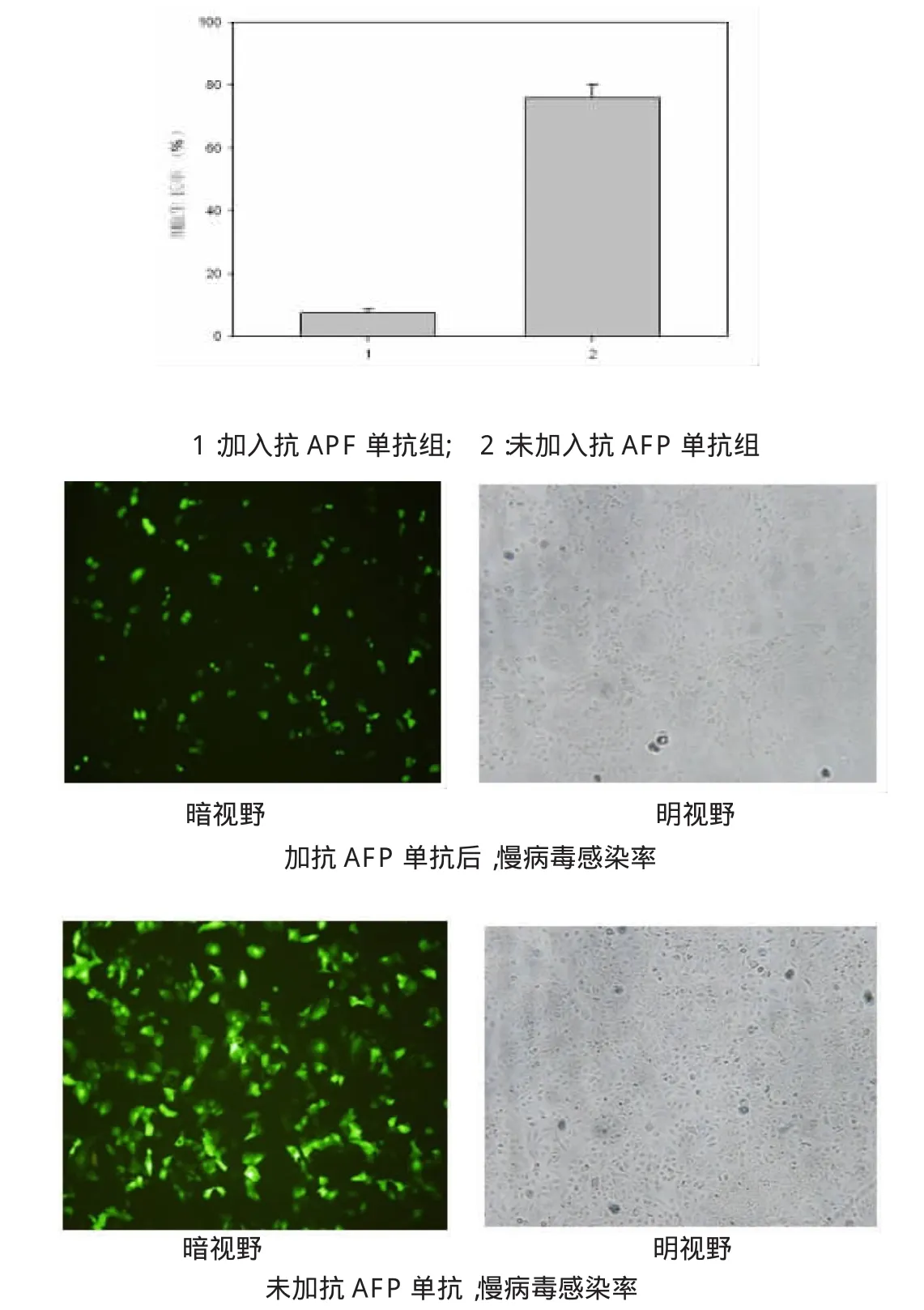
图6 竞争性抑制试验结果
3 讨论
肿瘤的基因治疗中,表达基因的靶向性和高效表达是关键。survivin的组织分布特征具有明显的细胞选择性[1],在终末分化的成人组织中不表达(除胸腺、生殖腺外),而在绝大多数肿瘤组织,包括淋巴瘤、肝癌、结肠癌、胃癌等呈高表达[2]。研究表明,survivin启动子较CMV启动子,可以在肿瘤细胞中特异性表达,具有良好的靶向性,在肿瘤的基因治疗中具有良好的前景[3]。Van Houdt等[4]克隆了survivin基因起始密码子上游第-230~+30位和第-1430~+30位两个survivin启动子基因片段,证实两者在转录活性、杀灭肿瘤细胞效果、体内抑瘤效果等方面没有显著差异。在实验构建的载体中,重组入的片段过长会使载体的结构发生变化,可能影响预期功能的完成。而survivin全长的启动子已达1.5kb左右,若要完成预期作用则启动子后面的功能基因片段长度则可能受到限制,有时无法满足实验的需要。Li等[5]报道survivin基因起始密码子上游第-268~+1位片段已具备启动子功能。本实验构利用高活性的巨细胞病毒早期基因增强子(CMVE)[6]增强启动子的活性,构成了860bp左右的sur vivin-CMV特异性启动子,提高survivin启动子的活性,并成功表达。

图7 细胞生长曲线
慢病毒载体具有可以长时间表达外源基因,容量大,感染细胞种类多而且高效,可以感染体内、体外分裂细胞与非分裂细胞,滴度高,低免疫原性,安全性高[7,8]等优点,成为肝癌基因治疗的理想载体。
AFP是目前肝癌生物治疗和诊断中用得较多的靶抗原,抗AFP的ScFv在原发性肝癌的生物治疗和诊断中都具有重要的作用[9]。
IGF1R是一种跨膜酪氨酸蛋白激酶,在多种肿瘤细胞中有高水平表达[10-12]。但在正常肝组织表达量极少,表皮生长因子(EGF)受体对细胞的有丝分裂作用及转化潜能必须通过IGF1R才能发挥,而过表达的IGF1R则不需要EGF受体即可引起细胞转化。研究还表明IGF1R的数量水平在细胞生存中起着决定性作用,只有达到某一水平,才能将细胞由不进行有丝分裂的模式转化为有丝分裂模式[13]。RNA干扰技术是重要的生物学研究工具,在基因治疗中具有良好的前景[14]。针对IGF1R基因的RNA干扰片段装入特定质粒中,再转染入人肝癌细胞株,虽然作用时间有所延长,但维持沉默效应的时间有限[15],因此本实验在载体选择和实验方法上有新的尝试,是一种有意义的探索。
本实验经PCR、测序鉴定证实survivin-CMV肝癌特异性启动子启动的AFP-survivin-CMV-PRIME-miR30-shRNA-IGF1R慢病毒载体构建成功,对肝癌SMMC7721细胞和胎肝L-02细胞进行体外研究表明,AFP-sur-CMV-PRIME-miR30-shRNA-IGF1R能够抑制肝癌SMMC7721细胞的生长,并具有特异性。为肿瘤基因治疗提供了理论依据和新的思路。
[1]Marusawa H,Matsuzawa S,Welsh K,et al.HBXIP functions as a co-fac-tor of survivin in apoptosis suppression[J].EMBO J,2003,22(11):2729-2740.
[2]Ouban A,Muraca P,YeatmanT,et al.Expression and distribution of in-sulin-like growth factor-1 receptor in human carcinomas[J].Hum Pathol,2003,34(8):803-808.
[3] Konopka K,Spain C,Yen A,et al.Correlation between the levels of survivin and survivin promoter-driven gene expression in cancer and non-cancer cells[J].Cell Mol Biol Lett,2009,14(1):70-89.
[4]Van Houdt WJ,Haviv YS,Lu B,et al.The human survivin promoter:a novel transcriptional targeting strategy for treatment of glioma[J].J Neurosurg,2006,104(4):583-592.
[5]Li F,Altieri DC.Transcriptional analysis of human survivin gene expression[J].Biochem J,1999,344(Pt 2):305-311.
[6]Richards CA,Austin EA,HuberB E.Transcriptional regulatory sequences of carcinoembryonic antigen:identification and use with cytosine deaminase for tumor specific gene therapy[J].Hum Gene Ther,1995,6(7):881-893.
[7]Bauer G,Dao MA,Case SS,et al.In vivobiosafety model to assess the risk of adverse events from retroviral and lentiviral vectors[J].Mol Ther,2008,16(7):1308-1315.
[8]Haynes JR,Dokken L,Wiley JA,et al.Influenzapseudotyped Gag virus-like particle vaccines provide broad protection against highly pathogenic avian influenza challenge[J].Vaccine,2009,27(4):530-541.
[9] 黄建生,郭秋明.基因工程抗体[M].广州:华南理工大学出版社,1997:56-70.
[10]Okada E,Murai Y,Matsui K,et al.Survivin expression in tumor cell nuclei is predictive of a favorable prognosis in gastric cancer patients[J].Cancer Lett,2001,163(1):109-116.
[11]Wang YH,Wang ZX,Qiu Y,et al.Lentivirus-mediated RNAi knockdown of insulin-like growth factor-1 receptor inhibits growth,reduces invasion,and enhances radiosensitivity in human osteosarcoma cells[J].Mol Cell Biochem,2009,327(1-2):257-266.
[12]Ma Z,Dong A,Kong M,et al.Silencing of the type 1 insulin-like growth factor receptor increases the sensitivity to apoptosis and inhibits invasion in human lung adenocarcinoma A549 cells[J].Cell Mol Biol Lett,2007,12(4):556-572.
[13]Bauer G,Dao MA,Case SS,et al.In vivobiosafety model to assess the risk of adverse events from retroviral and lentiviral vectors[J]. Mol Ther,2008,16(7):1308-1315.
[14]Ren K,Jin H,Bian C,et al.MR-1 modulates proliferation and migration of human hepatoma HepG2 cells through MLC2/FAK/Akt signaling pathway[J].J Biol Chem,2008,283(51):35598-35605.
[15]牛坚,钱海鑫,黄健,等.RNA干涉胰岛素样生长因子1类受体的研究[J].中华实验外科杂志,2006,23(7):872-873.
