植物乳杆菌内源性质粒序列分析及其表达载体的构建
2020-03-11方来杉钟泽民黄毓茂
方来杉,赖 强,钟泽民,黄毓茂,*
(1.华南农业大学兽医学院,广东 广州 510642;2.广州沃德生物技术有限公司,广东 广州 510663)
乳酸菌在自然环境中广泛存在,在人类胃肠道健康中发挥着重要作用[1-3]。乳酸菌可以促进人体胃肠道对乳糖的消化吸收,减少胃肠功能紊乱,增强细胞免疫力,有助于预防结肠癌[4-6],与人类饮食和健康息息相关。是现代食品、医疗制药、农牧等行业中具有重要经济价值的益生菌。
多数乳酸杆菌携带有数个质粒,大小不一,其中多数质粒为隐蔽性质粒,少数质粒具有某些特殊功能[7]。目前,已有许多乳杆菌质粒被测序,并用于构建质粒载体,如副干酪乳杆菌的质粒pCD01和pCD02[8]、干酪乳杆菌的质粒pLC494[9]和pMC11[10]、植物乳杆菌质粒pD403[11]和pM4[12]等。乳酸杆菌质粒复制方式为滚环复制和θ复制,通常较小的质粒(<12 kb)通过滚环方式进行复制[13]。通过对乳酸菌质粒的测序、分析,得到乳酸菌质粒的复制子是构建质粒载体的关键。国内开展的乳酸菌天然质粒的分离及功能分析的研究较少,导致利用基因工程手段对乳酸杆菌的改良受到严重限制。由于乳酸菌是食品级的益生菌,其携带的质粒也是食品级的[14],不存在食品安全问题。
因此,本研究对从酸菜中分离的植物乳杆菌LP3中的内源性质粒pLP3进行全序列测定及功能分析,并利用该质粒的复制子构建大肠杆菌-乳酸菌穿梭质粒D-pLP3,并研究该质粒的宿主范围、转化效率和稳定性。在穿梭质粒pLP3的基础上加上启动子PslpA和绿色荧光蛋白(green fl uorescent protein,eGFP)基因,进一步构建乳酸菌表达载体D-pLP3-PslpA-eGFP,并将其转化至植物乳杆菌,获得荧光蛋白的表达。该质粒可为乳酸菌基因操作提供新的工具,为构建具有自主知识产权的乳酸杆菌的表达载体提供基础资料。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
大肠杆菌感受态细胞DH5α、植物乳杆菌LP1、植物乳杆菌LP3、鼠李糖杆菌R1、发酵乳杆菌G1、戊糖片球菌ZQ4、乳酸乳球菌NZ9000、嗜酸乳杆菌(ATCC4356)、表达载体pSCPSP均由所在实验室构建和保存。
1.1.2 试剂
质粒小量提取试剂盒、胶回收试剂盒、DNA纯化试剂盒 美国Omega公司;预染蛋白质分子质量标准(11~180 kDa) 中科瑞泰(北京)生物科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)扩增酶及基因克隆试剂 大连TaKaRa公司;MRS培养基 青岛海博生物技术有限公司;其余生化及分析纯试剂 北京鼎国昌盛生物技术有限公司。
1.2 仪器与设备
Mini-PROTEAN型蛋白电泳仪、核酸凝胶成像系统、TC-4000型PCR扩增仪 美国Bio-Rad Laboratories公司;HC-3018R型高速冷冻离心机 安徽中科中佳科学仪器公司;ECLIPSE Ts2R型倒置荧光显微镜 日本Nikon公司。
1.3 方法
1.3.1 引物设计与合成
质粒pLP3、大肠杆菌-乳酸菌穿梭质粒D-pLP3及表达质粒D-pLP3-PslpA的构建过程中涉及的主要引物及其序列,引物信息见表1。引物由生工生物工程(上海)股份有限公司合成。

表1 引物信息Table 1 Primer sequences used in this study
1.3.2 质粒的分离
离心收集植物乳杆菌LP3的菌体,用质粒提取试剂盒提取质粒。不同于说明书的步骤是:用含有60 mg/mL溶菌酶的solution I溶液重新悬浮菌体,并在37 ℃温育1 h,以破坏植物乳杆菌细胞壁的肽聚糖层。
1.3.3 测序载体的构建
经预实验确定植物乳杆菌LP3质粒具有EcoRI酶切位点。对该质粒和载体质粒pUC57使用EcoRI进行酶切,并将酶切产物用T4 DNA连接酶连接。连接产物转化至大肠杆菌DH5α感受态细胞,进行蓝白斑筛选,培养18 h后挑取白色菌落培养并提取质粒。经PCR验证后,送生工生物工程(上海)股份有限公司测序。
1.3.4 质粒序列注释
将测序完成的DNA序列用DNAMAN(6.0)软件进行人工拼接,利用NCBI等国际核苷酸、蛋白质数据库以及DNAMAN(6.0)、SnapGene(4.0)等生物学软件对质粒的核苷酸及氨基酸序列进行分析,预测质粒的开放框。将比对完成的DNA序列进行注释,初步确定质粒复制相关蛋白。再根据现今公布的质粒复制蛋白(Rep)的同源性,构建系统发育树,推定质粒复制方式。
1.3.5 大肠杆菌-乳酸菌穿梭载体的构建
用引物pUC19-F/R扩增pUC19质粒上的大肠杆菌复制子Ori的DNA片段,在引物pUC19-F的5’端引入PshAI限制性内切酶。引物CmR-F/R扩增pSCPSP质粒上的氯霉素抗性基因CmR片段,在引物CmR-R的5’端引入NheI限制性内切酶。用融合PCR方法(SOE)将两段DNA片段组合在一起,纯化回收融合产物OCR。
PshAI、NheI限制性内切酶对pLP3质粒进行双酶切反应,纯化回收酶切产物。将融合产物OCR和pLP3酶切产物进行连接反应,将连接产物转化至大肠杆菌DH5α感受态细胞,挑取转化子酶切验证得到正确的重组质粒,命名为D-pLP3。
1.3.6 乳酸菌感受态制备及电转
参照Mason等[15]的方法制备乳酸菌感受态细胞:将10 μL的穿梭载体D-pLP3和100 μL的乳酸菌感受态细胞混匀,然后以Bio-Rad电转仪进行电击转化。电转参数1.8 kV、200 Ω、25 μF[16],脉冲时间约4.0 ms。电转后以900 μL预冷的SMRS液重悬,冰浴20 min后,置37 ℃孵育3 h。孵育后离心,预留80 μL上清液,重悬菌体,涂布MRS平板(含25 μg/mL氯霉素),37 ℃培养1~2 d。
1.3.7 穿梭质粒宿主范围、转化效率和稳定性测定
取500 ng穿梭质粒与各种乳酸菌的感受态细胞混匀,严格按照质粒转化乳酸菌的方案,将穿梭质粒电转化至各种乳酸菌感受态细胞内,待转化子37 ℃静置3 h活化后,涂布于含氯霉素的MRS平板上。37 ℃培养48~72 h,观察MRS抗性平板是否有穿梭质粒的转化子菌落。通过计算每微克穿梭质粒的转化子,测量其转化效率。
为确定穿梭质粒的稳定性,采用Alvarez-Martín等[17]的方法,具体步骤如下:挑取在含氯霉素的MRS固体平板上的菌落到新鲜的含氯霉素的液体MRS培养基中,过夜培养。按1%接种量接种到新鲜不含氯霉素的MRS培养基中,37 ℃培养12 h。再次按1%接种量接种到新鲜的MRS培养基中,培养12 h,传代培养直至60 代。稀释培养好的菌液分别涂布含氯霉素的MRS平板和不含氯霉素的MRS的平板。根据两平板上面的菌落数计算质粒的稳定性。
1.3.8 乳酸菌表达载体的构建
PCR获取嗜酸乳杆菌(ATCC 4356)的S层蛋白的启动子PslpA和信号肽Sig片段,转录终止子来源于质粒pMG36e的终止子。在信号肽Sig的引物Sig-R的5'端引入MluI、ScaI、SacII三个限制性内切酶位点,构成多克隆位点结构。用SOE PCR[18]连接构成了外源蛋白表达所需要的基本元件。为验证该蛋白表达体系是否能表达异源蛋白,选择增强型eGFP为标靶蛋白。
1.3.9 荧光显微镜观察和蛋白SDS-PAGE鉴定
挑取转化后的阳性重组菌D-pLP3-PslpA-eGFP和含空载体D-pLP3的植物乳杆菌LP1接种于MRS液体培养基(含25 μg/mL氯霉素)培养过夜。再将上述过夜培养的菌液按2%的比例接种于适量MRS培养液中,37 ℃培养16 h后,取其菌体制作水浸片,用荧光显微镜观察,x=485 nm、y=533 nm的条件下检测样品的荧光强度。37 ℃培养24 h后取其上清液,表达上清液中的蛋白经60%饱和硫酸铵溶液,6 000 r/min离心10 min,所得沉淀用0.02 mol/L磷酸盐缓冲液重悬浓缩100 倍左右。加入5×蛋白上样缓冲液,沸水中煮10 min,待蛋白充分变性冷却至室温,取适量上清液加至十二烷基硫酸钠-聚丙稀酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶加样孔内,进行常规电泳。
1.4 数据图像的处理
以Primer Premier 5.0的引物设计软件进行相关引物的设计,以Tanon 1600全自动数码凝胶成像系统对DNA电泳凝胶、蛋白电泳胶图像进行采集及分析。以WinPlas 2.7质粒绘图软件绘制质粒的图谱,并以MEGA 6.0构建质粒的系统发育树。以Nikon NIS-Elements BR专业图像分析软件对eGFP蛋白的荧光图像进行采集与处理。
2 结果与分析
2.1 质粒分离和单酶切图谱
电泳结果显示植物乳杆菌LP3的质粒提取液有3 条带(图1),提示该菌株携带多个质粒。其中一个质粒大小在2 kb左右,另外2 个质粒大小在15 kb以上。将小质粒(2 kb左右)进行纯化回收,并命名为pLP3。对pLP3质粒分别采用限制性内切酶EcoRI、XhoI、AvrII、SpeI进行酶切分析,最终发现该质粒经EcoRI、XhoI、AvrII、SpeI酶切均获得线性化质粒,而且是唯一的线状质粒DNA条带,不存在其他大小的DNA条带(图2)。
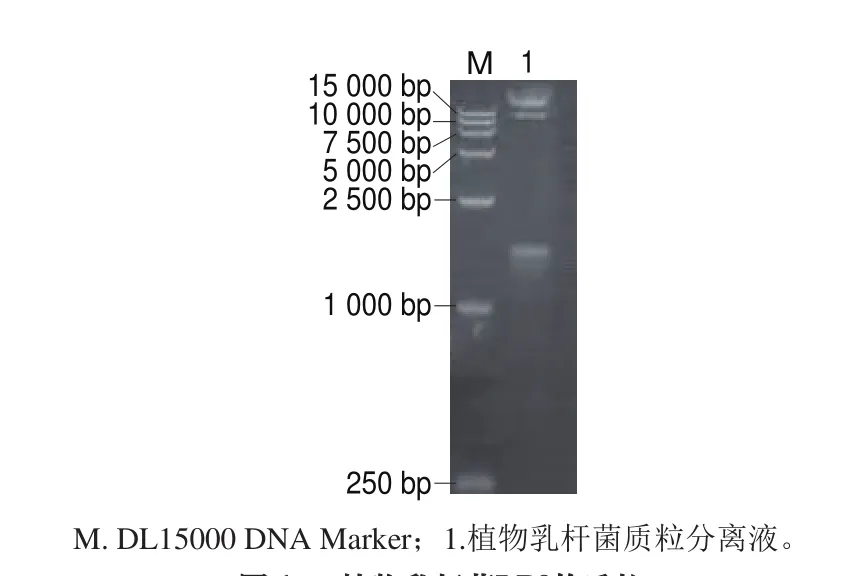
图1 植物乳杆菌LP3的质粒Fig. 1 Plasmid profile of L. plantarum LP3

图2 质粒pLP3酶切结果Fig. 2 Restriction enzyme analysis of pLP3
2.2 质粒序列的验证
构建的重组质粒PUC-pLP3,在EcoRI酶切位点附近设计引物pLP3-F/R,通过PCR验证所测序列是完整的(图3)。

图3 重组质粒PUC-pLP3的PCR鉴定Fig. 3 Identification of PUC-pLP3 by PCR
2.3 质粒注释和复制方式推定
2.3.1 质粒注释
pLP3质粒是双链环状DNA分子,共2 017 bp,GC含量为37.48%。BLAST比对结果显示:该质粒的核苷酸序列与植物乳杆菌KLDS 1.0801中的质粒pLD1(2 112 bp,GenBank:FJ755814.1)、pC30il(2 140 bp,GenBank:J03319.1)最为相似,相似率分别为99%与98%。
通过开放阅读框(open reading frame,ORF)搜索,pLP3有7 个ORF,ORF3编码一个含317 个氨基酸残基的蛋白,位于177 888~18 411 130 bp,应为pLP3质粒的Rep蛋白,该Rep氨基酸序列与Lactobacillus的同源性为100%,与植物乳杆菌的质粒Rep蛋白(NCBI Reference Sequence:WP_012569251.1、WP_010889864.1、WP_010889864.1等)的同源性均为99%,317 个氨基酸中有1 个氨基酸不同。ORF5编码一个含48 个氨基酸残基的蛋白,位于515~661 bp,其与植物乳杆菌(NCBI Reference Sequence:WP_107724356.1)未知功能的假定蛋白相似性为100%。其余ORF在GenBank没有与之相匹配的蛋白。目前为止,由于质粒pLP3除具有与复制相关的蛋白外,未发现具有特定功能的蛋白质,因此质粒pLP3应归为隐蔽性质粒。
ORF3编码质粒的Rep蛋白,在rep基因下游的10 bp处有一段反向重复序列,该序列是rep基因的转录终止信号(transcription termination signal),与pC30il质粒rep基因的转录终止信号序列一致。通过重复序列检索发现pLP3质粒的623~768 bp有9 个重复序列,该重复序列CATGATAATG正向重复了9 次,重复序列可能和质粒的拷贝数有关[19]。在rep基因上游的272 bp处观察到典型的质粒的复制双链起点(dso),该保守序列为5’-CGG TTTCTTCTTATCTTGATACTATTAGCAACAAC-3’,与RCR质粒pC194家族的dso同源[20]。该质粒的复制单链起点(sso)为ssoA类型,其保守序列为TAGCGA/T[21]位于489~494 bp。
2.3.2 质粒复制方式推定

图4 pLP3质粒图谱Fig. 4 Physical map of pLP3
将比对完成的DNA序列进行注释,初步确定质粒复制相关蛋白(图4)。用植物乳杆菌质粒复制起始相关蛋白RepA和RepB与己公布的质粒复制相关蛋白同源性制作系统发育树(图5)。
由植物乳杆菌质粒复制相关蛋白同源性的系统进化树可知,推测pLP3质粒属于植物乳杆菌编码Rep质粒家族1。Rep-1蛋白家族质粒和质粒pC194的Rep均含有3 个保守的Motifs[22],而且Motifs已被证明是pC194家族质粒复制起始的关键[23-24]。经过对pLP3质粒序列分析,发现该质粒的sso、dso位点以及Rep蛋白的Motifs与pC194家族的特征吻合(表2)。因此,推定pLP3的复制方式为滚环复制,属于pC194家族。

图5 pLP3质粒编码的Rep蛋白系统发育树Fig. 5 Phylogenetic tree of pLP3 encoded replication proteins

表2 pLP3质粒Rep蛋白Motifs保守序列的比对Table 2 Alignment of protein motifs of pLP3
2.4 穿梭载体的构建及其宿主范围、转化效率和稳定性
以克隆载体pUC19为模板,用引物pUC19-F/R扩增pUC19质粒上的大肠杆菌复制子Ori的DNA片段。以pSCPSP质粒为模板,用引物CmR-F/R扩增pSCPSP质粒上的氯霉素抗性基因CmR片段。用SOE-PCR将Ori片段与CmR片段连接构成OCR片段,利用PshAI、NheI两个限制性内切酶将OCR片段融合在pLP3质粒载体上,将重组质粒转化至大肠杆菌DH5α感受态细胞,挑取转化子酶切验证得到正确的重组质粒,命名为D-pLP3。

表3 穿梭质粒D-pLP3在不同乳酸菌宿主中的转化效率和稳定性Table 3 Transformation ef fi ciency and stability of shuttle vector D-pLP3 in different hosts
为确定穿梭质粒D-pLP3的宿主范围,将穿梭质粒电转化至各种乳酸菌感受态细胞内,并计算其在各种乳酸菌的转化效率和质粒的稳定性。表3表明:穿梭质粒D-pLP3均可在植物乳杆菌LP1和LP3、鼠李糖杆菌R1等乳酸杆菌和乳酸乳球菌NZ9000内成功电转,获得相应的转化子。但在发酵乳杆菌G1、戊糖片球菌ZQ4未能获得重组质粒的转化子。穿梭质粒转化效率介于0.3h102~1.0h103CFU/μg(DNA质量计)之间,比普通的乳酸菌质粒转化效率略低。
重组质粒在植物乳杆菌LP1、LP3的宿主菌的丢失率约为30%,在乳酸乳球菌NZ9000中丢失率为37%。重组质粒在鼠李糖杆菌R1中经过60 代连续传代培养后,重组质粒丢失率几乎达到100%。重组质粒D-pLP3在不同乳酸菌感受态细胞电转化效率和质粒稳定性的差异,可能与质粒不相容性有关。
2.5 表达质粒构建和荧光蛋白检测结果
本实验设计3 对引物分别PCR扩增嗜酸乳杆菌S层蛋白的slpA启动子、Sig信号肽、pMG36e上的转录终止子,根据SOE-PCR的原理将3 个外源基因表达原件,克隆至穿梭质粒D-pLP3,成功构建乳酸菌表达质粒D-pLP3-PslpA(图6)。依据eGFP蛋白能在蓝光的激发下显示绿色荧光的特性,因此,选eGFP蛋白作为表达质粒的靶标蛋白。

图6 构建穿梭质粒D-pLP3和表达质粒D-pLP3-PslpA的流程图Fig. 6 Schematic illustration of construction of shuttle vector D-pLP3 and expression vector D-pLP3-PslpA
重组质粒D-pLP3-PslpA-eGFP电转至植物乳杆菌,挑取转化后的阳性重组菌D-pLP3-PslpA-eGFP-LP1和空载体D-pLP3-LP1接种于MRS液体培养基培养过夜,先取16 h重组植物乳杆菌的菌体进行荧光显微镜观察,在蓝光激发下,可以观察到绿色荧光(图7)。然后取24 h重组植物乳杆菌的表达上清液,经60%硫酸铵沉淀后100 倍浓缩,SDS-PAGE分析。与空载体D-pLP3-LP1的重组菌相比较,重组菌D-pLP3-PslpA-eGFP-LP1的培养上清液可见27 kDa左右的目的条带(图8)。说明重组菌D-pLP3-PslpA-eGFP-LP1已成功电转至植物乳杆菌LP1中,信号肽Sig能够将eGFP蛋白成功分泌到胞外。

图7 重组植物乳杆菌eGFP蛋白的显微镜观察(×100)Fig. 7 GFP expression in recombinant L. plantarum (× 100)

图8 重组植物乳杆菌eGFP蛋白的SDS-PAGE鉴定Fig. 8 SDS-PAGE detection of eGFP from recombinant L. plantarum
3 讨 论
植物乳杆菌益生菌在自然界分布广泛,对多种不同的环境具有高度的适应性[25],可能由于植物乳杆菌具有较大的基因组和携带丰富多样的质粒有关。植物乳杆菌通常含有几个质粒,大小介于2~68 kb之间,植物乳杆菌质粒使其具有某些特殊的功能,如糖、氨基酸及柠檬酸代谢;重金属、抗生素等抗性;细菌素产生与分泌等[26]。随着分子生物学相关技术的不断突破,利用植物乳杆菌的隐蔽性质粒构建乳酸菌质粒载体是其基因改造的研究热点。
本研究从分离自传统发酵酸菜中的植物乳杆菌LP3中得到一个天然质粒pLP3,该质粒大小为2 017 bp,GC含量为37.48%。进一步通过生物信息学分析质粒pLP3,该质粒编码7 个ORF,其中ORF3(317 个氨基酸)为复制起始蛋白(RepA),ORF5(48 个氨基酸)编码一个未知功能的蛋白。其余ORF在GenBank没有与之相匹配的蛋白,因此质粒pLP3应归为隐蔽性质粒。根据Rep蛋白的同源性,及其该质粒的sso、dso位点以及Rep蛋白的Motifs与pC194家族进行比较,发现与pC194家族的特征相吻合,推测该质粒的复制方式为滚环复制,属于pC194家族。乳杆菌RC型复制质粒因具有宽宿主性质,而得到较广泛地应用[27],由于pLP3质粒为RC型复制质粒,因此该质粒具有宽宿主性质,能在不同类型的乳酸菌内进行复制。质粒pLP3来自食品级的乳酸菌,质粒本身较小,RC型复制质粒宽宿主性质,这些特性利于其构建为适宜的乳酸菌工程载体。
以质粒pLP3为载体,同时分别以克隆载体pUC19和植物乳杆菌表达载pSCPSP为模板,PCR分别扩增得到大肠杆菌的复制子和氯霉素抗性基因,将两个基因片段整合至pLP3质粒上,成功构建大肠杆菌-乳酸菌穿梭质粒D-pLP3。将穿梭质粒D-pLP3电转至不同的乳酸菌感受态细胞,发现该质粒均能在乳酸乳球菌和乳酸杆菌内复制。通过质粒转化效率和质粒稳定性实验,发现该穿梭质粒转化的效率介于0.3h102~1.0h103CFU/μg之间,乳酸菌质粒电转化效率一般在10~105CFU/μg左右[28]。穿梭质粒比普通的乳酸菌质粒转化效率略低,可能的原因有:其一,宿主菌株存在的限制修饰系统和CRISPR机制,对未甲基化的外源质粒直接排斥。其二,宿主菌株内可能存在同一不亲和群的质粒[10]。其三,限制转化效率的原因如电压、缓冲液、不同宿主的DNA甲基化水平、感受态细胞状态等。影响穿梭质粒D-pLP3稳定性的原因可能是RC型质粒及其衍生载体在复制过程中产生单链DNA中间体,容易发生质粒基因的重组和损伤,进而引起质粒载体结构和遗传稳定性降低。而且滚环复制型质粒插入外源DNA片段过大,也会导致其衍生载体的结构稳定性降低。该穿梭质粒经过60 代无抗性连续传代培养后,发现相比其他乳酸菌而言,穿梭质粒D-pLP3在植物乳杆菌的转化效率最高、质粒丢失率最低,这可能和质粒的不相容性有关[11]。
乳杆菌S层蛋白启动子PslpA、Usp45和乳糖脱氢酶启动子Pldh等均能在乳酸菌宿主中用于异源蛋白的表达[10,29-30]。在穿梭质粒D-pLP3的基础上加上启动子PslpA和eGFP基因,进一步构建乳酸菌表达载体D-pLP3-PslpA-eGFP,并用其转化至植物乳杆菌,成功获得了荧光蛋白的表达。将重组乳酸菌培养的上清液进行SDS-PAGE检测,在27 kDa左右观察到目的蛋白条带,表明S层蛋白的信号肽Sig能够将eGFP蛋白成功分泌到胞外。乳酸菌外源蛋白的分泌表达,为乳酸菌口服疫苗的制备提供了有力的论据。虽然该表达载体的抗性筛选基因对质粒载体改造方面具有推动作用,但在食品、疫苗等生产方面的应用受到一定程度的限制。选择食品级的筛选标记,构建食品级乳酸菌载体是接下来研究工作的重点。
测得植物乳杆菌LP3内源性质粒pLP3的全序列,该质粒全长为2 017 bp,复制方式为滚环复制,属于pC194家族。基于质粒pLP3的复制子,构建了大肠杆菌-乳酸菌穿梭质粒D-pLP3,且具有宽宿主性质,质粒丢失率低。同时,表达载体D-pLP3-PslpA有潜力作为乳酸菌研究的重要工程载体和黏膜疫苗表达工具,具有良好的应用前景。
