血红素氧合酶在脑膜炎中的差异性表达及SnPP的保护作用
2011-02-03任昊翟效月
任昊,翟效月
(中国医科大学基础医学院组织胚胎学教研室,沈阳 110001)
血红素氧合酶在脑膜炎中的差异性表达及SnPP的保护作用
任昊,翟效月
(中国医科大学基础医学院组织胚胎学教研室,沈阳 110001)
目的研究血红素氧合酶(HO)在脑膜炎大脑中的改变及其与游离铁增加的内在关联,探讨锡原卟啉对脑源性游离铁增加的抑制作用。方法 利用新生Wistar大鼠制作脑膜炎动物模型。采用免疫荧光组织化学检测血红素氧合酶1和2在大脑中的表达及其产物胆红素的分布。采用免疫印迹方法对血红素氧合酶1和2进行定量分析。锡原卟啉皮下注射后利用Ferene-S方法检测脑内游离铁含量变化。结果 与对照组相比,HO-1蛋白水平在感染组中显著上升,且与脑游离铁有共存关系,HO-2表达水平低且保持恒定。锡原卟啉抑制HO-1产物胆红素的产生和游离铁增加。结论大鼠脑膜炎病变过程中脑游离铁的增加是脑源性的,由HO-1分解血红素产生。锡原卟啉能够显著抑制血红素氧合酶活性,从而抑制脑膜炎病变过程中游离铁的产生。
大鼠;游离铁;血红素氧合酶;锡原卟啉
细菌性脑膜炎是威胁发展中国家婴幼儿生命的重大疾病之一[1]。铁是大脑内含量最高的金属元素,参与能量代谢、髓鞘合成等各种生理过程。但是作为一种可变价的过渡金属元素,铁也能够通过芬顿化学反应促进羟自由基的形成而引起组织过氧化损伤[2]。我们的前期研究表明,某些脑损伤,如实验性大鼠肺炎球菌性脑膜炎过程中会释放出游离铁,增加了大脑氧化应激的风险,但该游离铁的来源尚不清楚[3]。血红素氧合酶(hemoxygenase,HO)催化降解细胞内的血红素释放出游离铁和胆绿素[4],胆绿素进而被还原生成胆红素。目前已知的HO有3种:HO-1、HO-2和 HO-3[5]。在大脑中主要是 HO-1和HO-2具有活性。在应激条件下,HO的活性会发生改变[6]。目前在肺炎球菌引起的脑膜炎大脑中尚未见关于HO的报道。锡原卟啉(Sn-protoporphyrin,SnPP)是一种HO的竞争性抑制剂,能够显著抑制酶活性从而阻止游离铁的产生。本研究探讨了HO在脑膜炎大脑中的改变及其与游离铁增加的内在关联,探讨锡原卟啉对脑源性游离铁增加的抑制作用。
1 材料与方法
1.1 动物模型
生后11d的Wistar大鼠(瑞士伯尔尼大学动物中心)40只,随机分为对照组(n=20)和实验组(n=20)。5×106/mL肺炎链球菌(血清型3)在硬膜下感染动物,对照组用等量生理盐水。18h后对仔鼠进行临床分数评估,未感染鼠弃用。动物用戊巴比妥麻醉,冰磷酸盐缓冲液灌流后解剖大脑,立即液氮冻存用于定量分析的半球。
1.2 药物SnPP处理和铁的化学检测
利用二甲基亚砜的水溶液溶解SnPP(1∶1),避光保存。在感染时每8h按60mg/kg皮下注射SnPP溶液,共3次。对照组注射等量的二甲基亚砜水溶液。游离铁的定量测量应用Ferene-S方法[7],使用商用试剂盒(DiaSys,Holzhelm,德国)。冰冻大脑皮质在冰 Tris缓冲液中(100mL,pH 7.4)1∶2.5匀浆,离心。0.25mL上清液与等量Ferene-S溶液在室温孵育20min后,在595nm处测定吸光度,按标准曲线计算游离铁含量。
1.3 免疫组织化学和细胞组织化学检测
用5%牛血清白蛋白封闭去石蜡切片,与亲和纯化的兔抗鼠HO-1和HO-2(Stressgen,BC,加拿大)一抗孵育1h(1∶100),免疫反应用金属增强的链霉素亲和法可视化[8]。胆红素的免疫组化利用小鼠单克隆抗胆红素抗体(24G7,Dojindo,日本)。利用鼠单克隆抗体 GFAP(Chem-icon,CA,美国)检测星形胶质细胞。一抗分别与Alexa-555标记的羊抗鼠二抗(MolecularProbe,OR,美国)进行免疫反应。小胶质细胞的组织化学采用经典的IB4方法[9]。首先用活性剂TritonX-100(0.4%)在室温下孵育脑切片48h,然后用溶解在PBS中的FITC标记的IB4(10μg/mL)孵育切片2h,由荧光显微镜可视化。
1.4 血红素氧合酶的免疫印迹定量分析
液氮冷冻的大脑皮质称质量,按1∶9比例与蛋白酶抑制剂(La Roche,Basel,瑞士)一起匀浆,离心。测定上清蛋白浓度。20μg蛋白上样,利用十二烷基磺酸钠聚丙烯酰胺凝胶(13%)电泳分离。分离的蛋白被转移到聚偏氟乙烯膜,4℃下与HO-1和HO-2一抗(1∶500)进行孵育。二抗使用辣根过氧化物酶标记的兔IgG抗体(1∶10000)。化学发光带可视化后进行定量分析。
1.5 统计学分析
2 结果
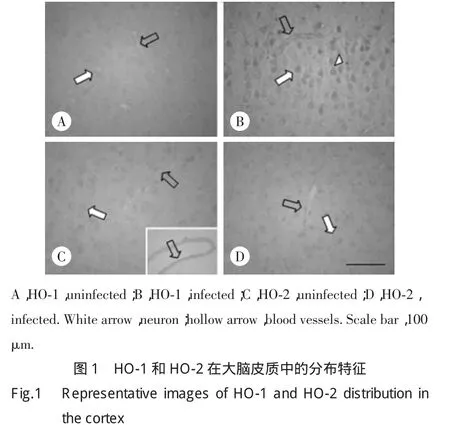
2.1 HO-1和HO-2在脑膜炎大脑的分布特征
免疫组化染色结果表明,正常对照组大脑皮质中HO-1和HO-2信号较弱。感染脑膜炎后,与对照组相比,实验组HO-1表达显著增强,阳性信号位于大脑皮质细胞和血管上;HO-2的表达水平没有显著变化。见图1。
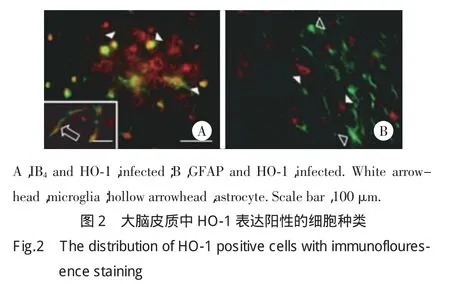
2.2 荧光双标定性HO-1阳性的细胞种类
为了确定HO-1在大脑中是否和游离铁有共存关系,我们利用免疫荧光双标技术进行了研究。结果表明,大脑皮质神经元、小胶质细胞和血管内皮细胞上有双染的黄色荧光信号,表明在这些部位HO-1表达阳性(图2A)。在星形胶质细胞上的绿色荧光和HO-1的红色荧光则无重合(图2B),说明在星形胶质细胞上无HO-1表达。
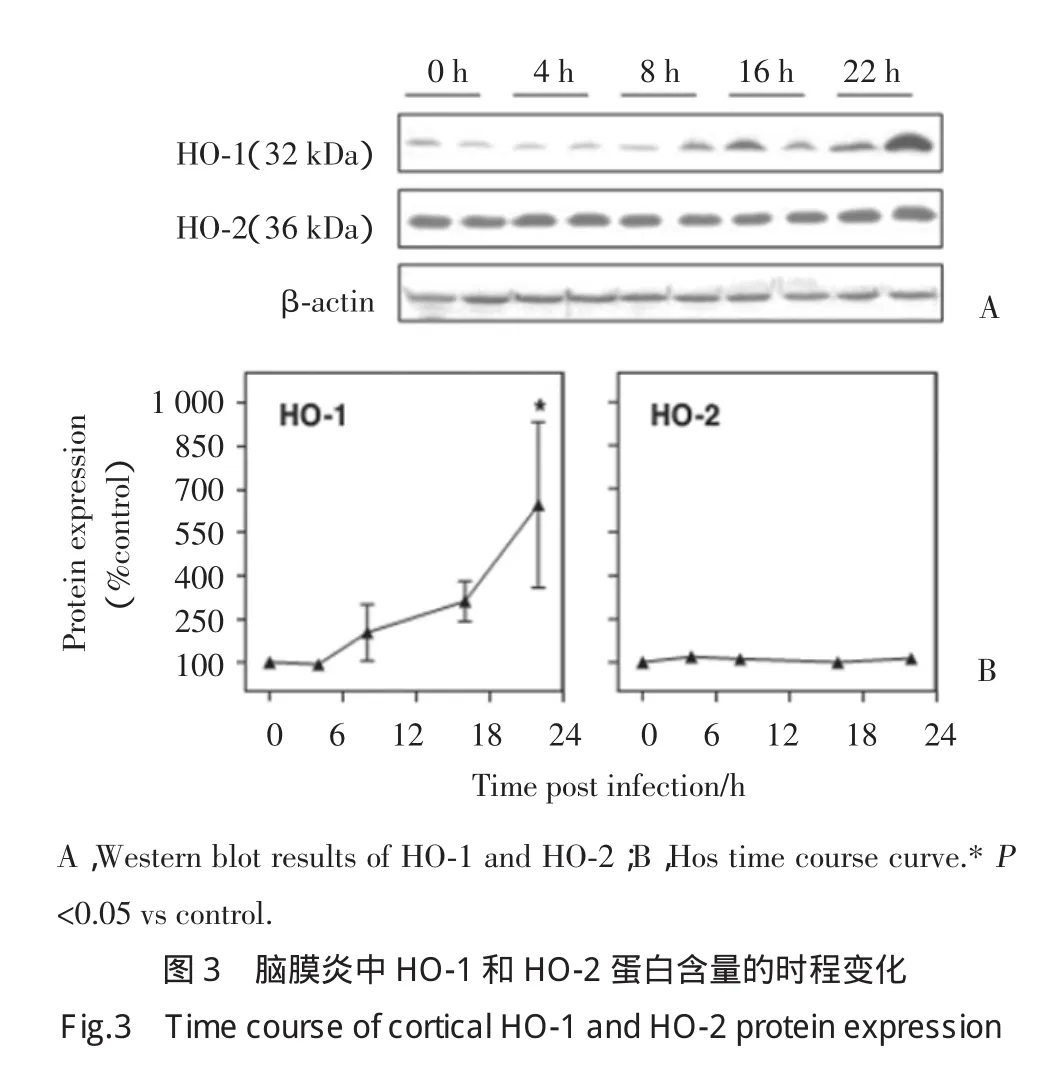
2.3 HO-1和HO-2蛋白表达的时程曲线
为了进一步观察游离铁和2种血红素氧合酶的相关性。本研究利用免疫印迹技术对HO-1和HO-2进行了时程分析。结果表明,在大鼠大脑皮质中HO-1蛋白水平随感染时程而逐步升高,在感染22h后与对照组形成显著差异。而HO-2在这个感染过程中则没有明显改变,始终保持在基础水平。见图3。
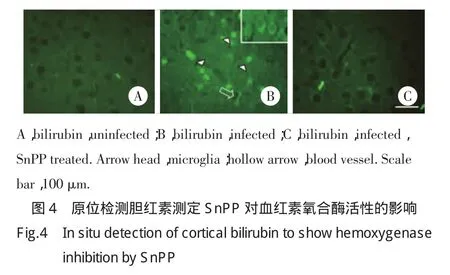
2.4 SnPP对血红素氧合酶活性的抑制作用
血红素氧合酶能够分解血红素而释放出胆红素和游离铁,本研究利用原位检测胆红素表达来确定SnPP对血红素氧合酶的抑制作用。结果显示,SnPP消除了感染组中由于血红素氧合酶活性而产生的胆红素信号(图4B,C),这表明SnPP能够有效抑制该酶活性。
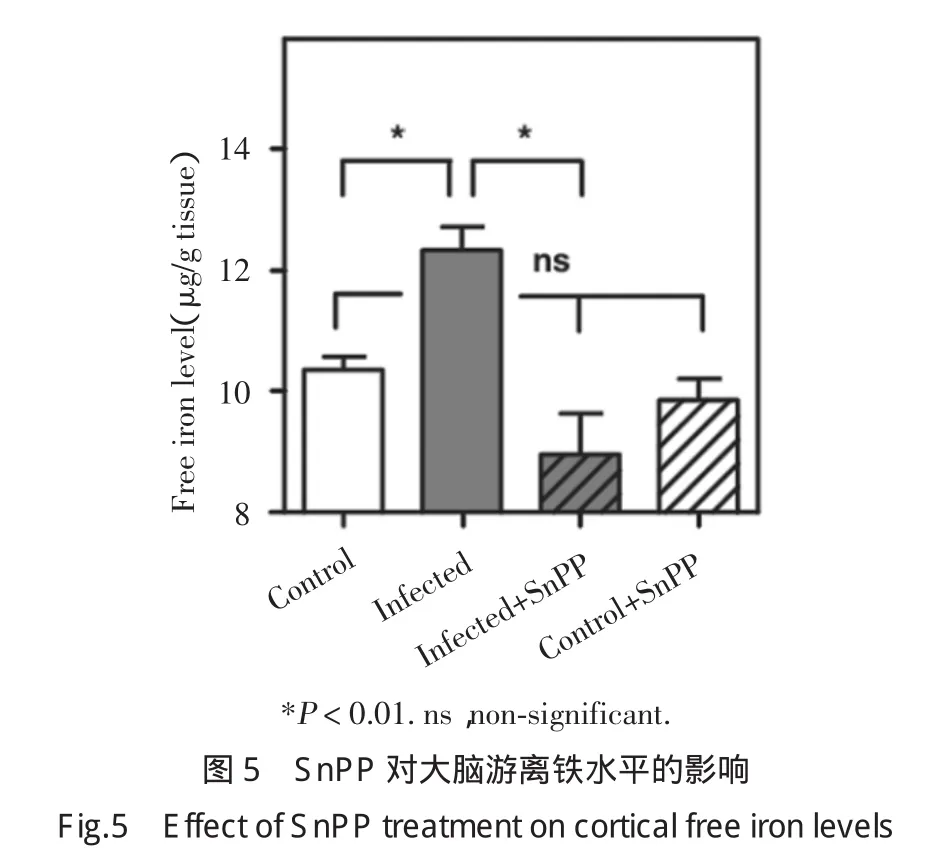
2.5 SnPP对大脑游离铁增高的抑制作用
如图5所示,与对照组未感染大鼠相比,感染后大鼠大脑游离铁水平显著升高,SnPP显著抑制感染组游离铁的增加,同时SnPP对对照组游离铁无影响。
3 讨论
我们的前期研究结果证明,细菌性脑膜炎的病理过程伴随着脑游离铁的增加,但该游离铁的来源尚不清楚。因此,本研究对此进行了深入的研究,结果发现,病变脑组织铁的增加是脑源性的,与HO-1的活性有关。SnPP能够抑制该游离铁的增加而保护大脑免于过氧化损伤。
大脑内储存的铁包括血红素结合铁和铁蛋白结合铁2种[10]。本研究针对血红素结合铁进行研究,发现血红素氧合酶的活性显著增强,HO-1的表达明显上调,而另一种亚型HO-2的表达则保持不变。通过细胞定位发现,HO-1的表达与游离铁的增加确有共存性,在神经元、血管、小胶质细胞上都有阳性表达,而在星形胶质细胞上呈阴性。进一步的定量分析发现,HO-1和游离铁的增加在时程上有相关性,都是逐渐增高并在22h时达高峰(游离铁资料未显示)。以上结果证明,HO-1的酶活性增强是造成脑源性游离铁增加的原因,而HO-2不参与这一过程。
血红素氧合酶能够分解卟啉环释放出游离铁而使游离铁库容量增加[11]。SnPP是该酶的一种竞争性抑制剂。为了探讨SnPP的抑制作用,本研究首先观察了HO的终产物胆红素。结果表明,SnPP能够有效抑制胆红素的产生(图4),继而证明SnPP对游离铁增加的抑制作用确实是由于抑制了HO的活性。
综上所述,本研究结果表明,大鼠脑膜炎病变过程中脑游离铁的增加是脑源性的,由HO-1分解血红素产生。SnPP能够显著抑制血红素氧合酶活性,从而抑制脑膜炎病变过程中游离铁的产生。SnPP对大脑过氧化损伤具有潜在的保护作用,值得我们进行更深入的研究。
[1]Leib SL,Clements J,Leppert D,et al.Inhibition of matrix metalloproteinases and tumour necrosis factor alpha converting enzyme as adjuvant therapy in pneumococcal meningitis [J].Brain,2001,124(9):1734-1742.
[2]Perron NR,Brumaghim JL.A review of the antioxidant mechanisms of polyphenol compounds related to iron binding [J].Cell Biochem Biophys,2009,53(2),75-100.
[3]Bottcher T,Ren H,Goiny M,et al.Clindamycin is neuroprotective in experimental Streptococcus pneumoniae meningitis compared with ceftriaxone[J].Neurochemistry,2004,91(6):1450-1460.
[4]FernandesA,BritesD.Contributionofinflammatoryprocesses to nerve cell toxicity by bilirubin and efficacy of potential therapeutic agents[J].Curr Pharm Des,2009,15(25):2915-2926.
[5]Ewing JF,Maines MD.Rapid induction of heme oxygenase 1mRNA and protein by hyperthermia in rat brain:heme oxygenase 2is not a heat shock protein [J].Proc Natl Acad Sci,1991,88(12):5364-5368.
[6]Fukuda K,Richmon JD,Noble LJ.Induction of heme oxygenase-1(HO-1)in glia after traumatic brain injury[J].Brain Res,1996,736(1):68-75.
[7]Higgins T.Novel chromogen for serum iron determinations [J].Clin Chem,1981,27(9):1619-1620.
[8]Schaper M,Gergely S,Christen S.Cerebral vasculature is the major target of oxidative protein alterations in bacterial meningitis[J].Neuropathol Exp Neurol,2002,61(7):605-613.
[9]Pennell NA,Hurley SD,Streit WJ.Lectin staining of sheep microglia[J].Histochemistry,1994,102(6):483-486.
[10]Ogihara T,Hirano K,Ogihara H,et al.Non-protein-bound transition metals and hydroxyl radical generation in cerebrospinal fluid of newborn infants with hypoxic ischemic encephalopathy[J].Pediatr Res,2003,53(4):594-599.
[11]Chen-Roetling J,Li Z,Regan RF.Heme oxygenase activity and hemoglobin neurotoxicity are attenuated by inhibitors of the MEK/ERK pathway[J].Neuropharmacology,2009,56(5):922-928.
(编辑王又冬,英文编辑刘宝林)
The Differiential Expression of Hemoxygenases and the Protection of SnPP in Experimental Meningitis
REN Hao,ZHAI Xiao-yue
(Department of Histology and Embryology,College of Basic Medical Sciences,China Medical University,Shenyang 110001,China)
ObjectiveTo study the relationship between heme degrading enzyme hemoxygenase activity and free iron increase during brain meningitis,and to investigate the protective effect of Sn-protoporphyrin(SnPP)in the inhibition of free iron release.MethodsWistar pups were used for meningitis brain models.Heme oxygenase(HO)-1and-2expression was measured by Western blot quantitatively and immunohistochemistry.SnPP was injected subcutaneously and free iron was measured with Ferene-S method.Bilirubin was detected by immunohistochemical method to examine hemoxygenase activities.ResultsCompared with control group,HO-1level in the infected brain was significantly increased along with the free iron increase.HO-1expression colocalized with free iron in neurons and glial cells.HO-2level remained low and unchanged.SnPP significantly reduced the free iron release and bilirubin formation.ConclusionPneumococcal meningitis was associated with an increase of free iron in the brain which was originated from HO-1activity increase but not HO-2,SnPP was able to prevent the free iron increase and supposed to be brain protective to oxidative damage.
rat;free iron;hemoxygenase;SnPP
R329.1
A
0258-4646(2011)05-0397-04
doiCNKI:21-1227/R.20110523.1816.027
http://www.cnki.net/kcms/detail/21.1227.R.20110523.1816.027.html
高等学校博士学科点专项科研基金资助项目(200801590016)
任昊(1974-),男,副教授,博士.
翟效月,E-mail:zhaixy@mail.cmu.edu.cn
2010-11-18
网络出版时间:2011-05-1815:25
