白斑症病毒(WSSV)对克氏原螯虾血细胞的感染规律*
2010-01-08王轶南战文斌唐小千
王轶南,战文斌,唐小千,邢 婧
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
白斑症病毒(WSSV)对克氏原螯虾血细胞的感染规律*
王轶南,战文斌**,唐小千,邢 婧
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
用WSSV粗提液注射感染克氏原螯虾,感染后每24 h采集螯虾血细胞。血细胞经与抗WSSV单克隆抗体及FITC标记的羊抗鼠抗体结合反应后,应用流式细胞仪检测WSSV对血细胞的感染,同时记录螯虾累积死亡率及血细胞密度。结果表明,感染WSSV后螯虾1~7 d的累积死亡率分别为3.3%,13.3%,16.7%,36.7%,70.0%,90%和100%;1~5 d血细胞被感染比例分别为6.47%,6.93%,10.65%,26.08%和4.94%;1~5 d被感染细胞的平均荧光强度分别为10.7,10.89,11.71,13.77和15.47;1~6 d血细胞密度分别为(7.56±0.30),(5.60±0.24),(4.21±0.30),(1.45±0.26),(1.21±0.21)和(1.14±0.18)×106个/mL,阴性对照组螯虾血细胞密度为(5.34±0.22)×106个/mL。可见,感染WSSV后螯虾血细胞密度呈现先升后降的趋势,至感染后第6天血细胞密度仅为对照组的21.3%;被感染血细胞内的病毒量始终呈上升趋势、达到最高感染率时螯虾处于濒死状态,表明血细胞的WSSV感染与螯虾死亡密切相关。
克氏原螯虾;血细胞;对虾白斑症病毒
对虾白斑症病毒(WSSV)病流行广泛、危害严重,自暴发以来的近20 a一直倍受关注[1-2]。目前,探明WSSV致病机理、寻找预防和控制该病已逐渐成为研究的热点[3-4]。已有研究表明血细胞是WSSV侵染的主要靶细胞,并在病毒对各组织器官的感染中起重要作用[5-6],因此研究WSSV对宿主血细胞的感染特性及其与宿主死亡的关系,对了解WSSV致病机理具有重要意义。研究发现斑节对虾(Penaeus monodon)、凡纳滨对虾(Litopenaeus vannamei)、墨吉对虾(Penaeus merguiensis)、宽大太平螯虾(Pacif astacus leniusculus)以及印度对虾(Penaeus indicus)等感染WSSV后血细胞数量均发生变化[5-9],并且不同类型血细胞对WSSV的易感性存在差异[7,10],此外,感染WSSV后的斑节对虾和印度对虾血细胞具有明显的细胞程序性坏死现象[9]。本研究的前期成果是应用抗WSSV的单克隆抗体和FITC标记的羊抗鼠抗体的免疫荧光技术及流式细胞仪检测了24 h内WSSV对克氏原螯虾(Procambarus clarkia)血细胞的感染及感染强度,建立了螯虾血细胞内病毒感染的检测方法[11]。在此基础上,本文研究了克氏原螯虾血细胞被WSSV感染到濒死之间的感染规律及与螯虾死亡的关系,以期为进一步探明WSSV的致病机理提供参考。
1 材料与方法
1.1 材料及试剂
600尾健康克氏原螯虾购于青岛南山水产品市场,体长8~10 cm,体质量20~25 g,经PCR检测为WSSV阴性,实验前经5 d暂养。自然感染WSSV的对虾取自乳山对虾养殖场,于-80℃保存。抗WSSV单克隆抗体为本实验室研制[12]。异硫氰酸荧光素(FITC)标记的羊抗小鼠Ig购自Sigma公司。
1.2 螯虾的人工感染
将螯虾分为感染观察组及感染流式检测取样组,并分别设WSSV感染组与对照组。将自然感染WSSV对虾的鳃与0.01 mol/L磷酸盐缓冲液(PBS,p H=7.4)体积比按1∶10匀浆,匀浆液经差速离心(400×g,15 min,4℃;800×g,15 min,4℃)后,取上清用无菌PBS稀释1 000倍,经0.45μm微孔滤膜过滤除菌,经螯虾的腹部皮下注射感染,每尾50μL,阴性对照组注射同体积无菌PBS,空白对照不注射(见表1)。
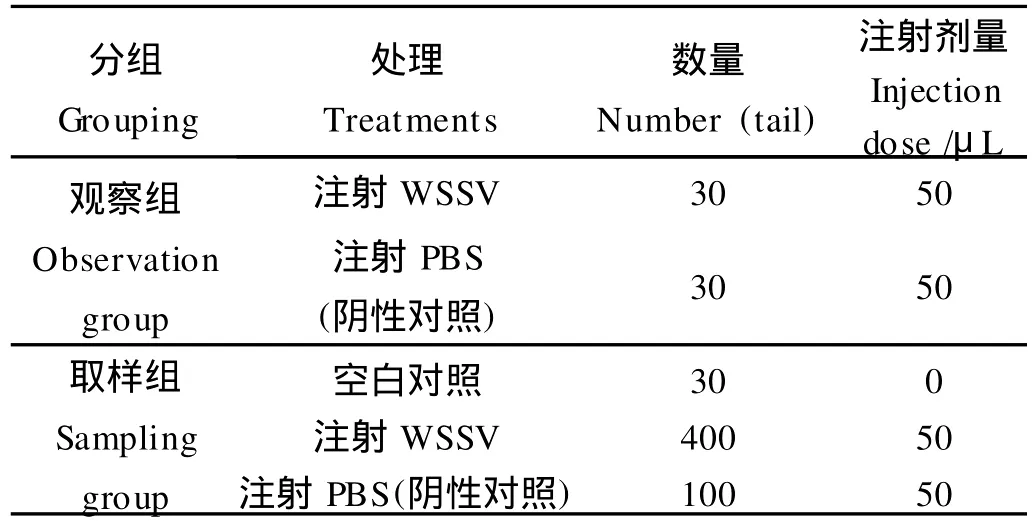
表1 人工感染及实验分组Table 1 Artificial infection and experiment groups
1.3 螯虾感染程度观测
人工感染后,每24 h记录观察组螯虾的死亡情况、绘制累积死亡率曲线。取死亡螯虾的鳃丝冰冻包埋后,制备冰冻切片,以正常螯虾鳃为阴性对照。在螯虾鳃的冰冻切片上滴加15μL抗WSSV混合单克隆抗体,置37℃湿盒中孵育45 min;PBS洗涤3次,每次5 min。洗涤后滴加15μL FITC标记的羊抗鼠Ig抗体(1∶256),37℃湿盒中孵育45 min;同上洗涤。甘油封片后荧光显微镜下观察拍照。
1.4 血细胞感染程度检测
人工感染后,每24 h从感染组中随机取15只螯虾,用装有预冷提取液(抗凝剂:8%多聚甲醛=3∶1)的10 mL注射器抽取血淋巴[11],混合血淋巴后使用血球计数板显微计数,计算血细胞密度,每个样本重复3次计数,取平均值。同样从阴性对照组中每24 h随机取10尾螯虾,抽取血淋巴作为对照。
上述血细胞样品于4℃放置20 min后离心(600 r/min,15 min,4℃),用提取液重悬沉淀,调整细胞密度至5×106个/mL。取2 mL血细胞悬液(约1×107个血细胞)再次离心,沉淀用0.1%Triton-X100重悬,4℃通透10 min;PBS离心洗涤1次后用2%牛血清白蛋白(BSA)4℃封闭30 min;PBS离心洗涤3次后加入0.5 mL抗WSSV的混合单抗,4℃孵育45 min;PBS离心洗涤3次后加入0.5 mL FITC标记的羊抗鼠Ig抗体(1∶256),4℃孵育45 min,同上洗涤,最后用PBS重悬血细胞,调整密度至1×106个/mL,使用Coulter EPICS XL流式细胞仪及软件FCS Express3进行检测分析,以全部血细胞为对象(对主细胞群设门,圈入95%以上细胞)做流式FL1直方图,以阴性对照螯虾血细胞为对照,分析感染后各取样时间点的病毒感染情况,包括被感染细胞百分率(Percent of gated cells)及平均荧光强度(Mean fluorescence intensity,MFI)[11]。
2 结果
2.1 螯虾感染死亡情况及WSSV的感染检测
人工感染1 d后螯虾开始出现死亡,感染7 d后全部死亡;同时,感染初期,螯虾死亡较为缓慢,感染4 d后,螯虾死亡率明显加快。随着感染时间延长,螯虾累积死亡率分别为3.3%(1 d),13.3%(2 d),16.7%(3 d),36.7%(4 d),70%(5 d),90%(6 d),100%(7 d)(见图1)。感染组的死亡螯虾鳃经免疫荧光检测,呈现点状特异性绿色荧光,为WSSV感染阳性(见图2A)。阴性对照及空白对照均有1尾死亡,经间接免疫荧光检测为WSSV感染阴性(见图2B)。
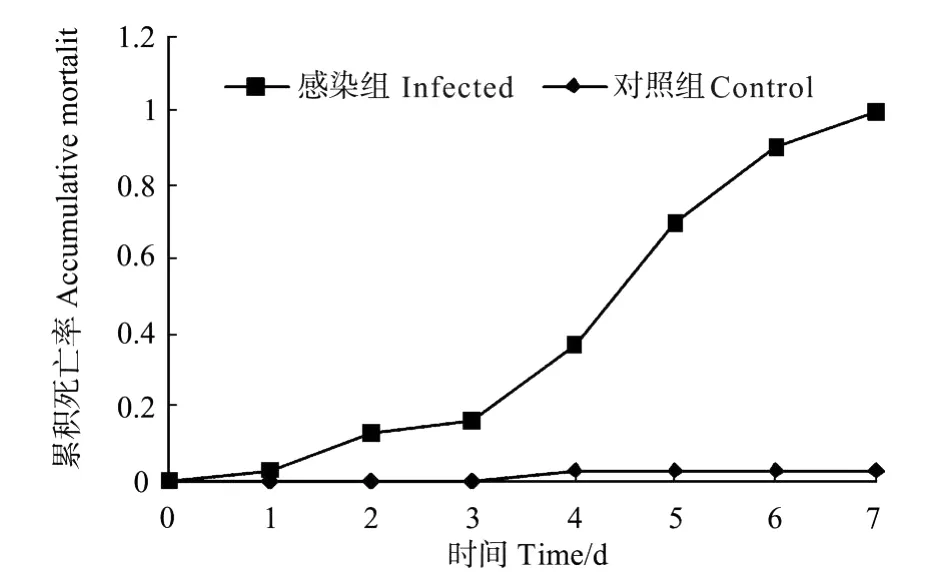
图1 螯虾感染WSSV后累积死亡率的变化Fig.1 Variety of accumulative mortality of crayfish after WSSV infected
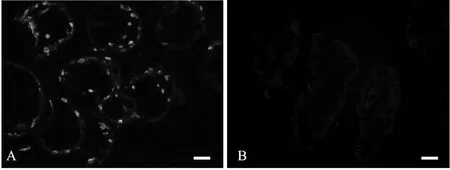
图2 螯虾鳃的WSSV间接免疫荧光检测Fig.2 Immunofluorescence assay of WSSV infection of crayfish gill
2.2 血细胞的数量及感染强度变化
显微计数观察结果显示,阴性对照组螯虾的血细胞密度约为(5.34±0.22)×106个/mL,在感染WSSV后第1、2天,血细胞密度出现初始的升高,分别为(7.56±0.30)和(5.60±0.24)×106个/mL,然后从第3天起血细胞密度急剧下降,分别为(4.21±0.30),(1.45±0.26),(1.21±0.21)和(1.14±0.18)×106个/mL,感染后第6天血细胞密度仅为阴性对照组的21.3%(见图3)。
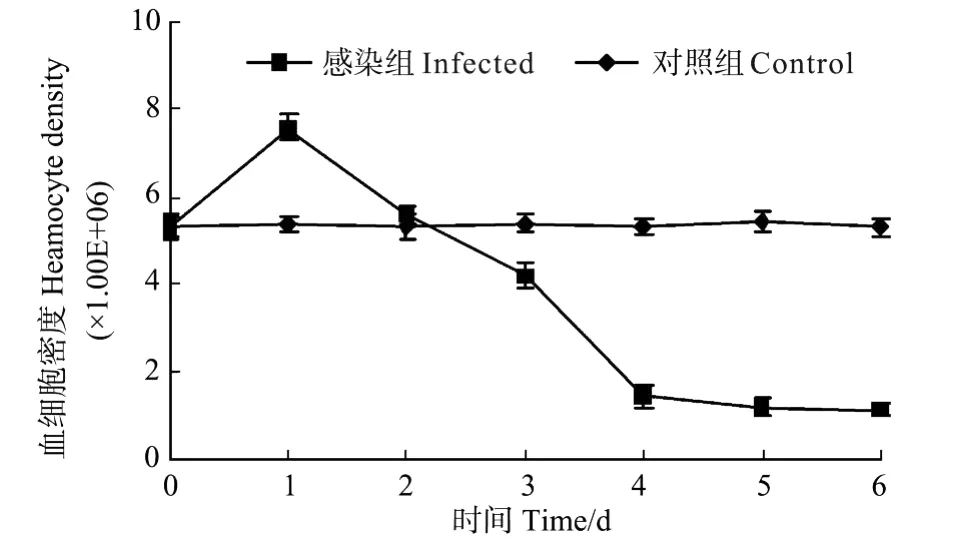
图3 螯虾感染WSSV后血细胞密度的变化Fig.3 Variety of haemocyte indensity of crayfish infected with WSSV
流式检测得出的直方图显示,螯虾在感染WSSV后,被感染血细胞的比例在1~3 d内增加缓慢,分别为:6.47%,6.93%和10.65%,3 d后急剧增多,在第4天达到高峰,感染率为26.08%,之后急剧降低,感染后第5天血细胞感染率仅为4.94%(见图4,图5)。

图4 感染WSSV后螯虾血细胞的流式检测Fig.4 FCM analysis of haemocytes of WSSV infected crayfish
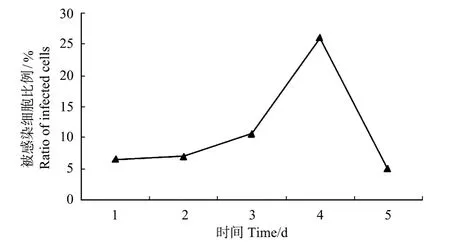
图5 螯虾感染WSSV后被感染血细胞比例的变化Fig.5 Variety of infected rate of haemocytes after WSSV infected
血细胞荧光信号的流式检测数据显示,被感染血细胞的平均荧光强度逐渐升高,感染后1~5 d分别为10.7,10.89,11.71,13.77,15.47,表明被感染细胞的病毒数量持续升高,且上升速度在3 d后加快(见图6)。
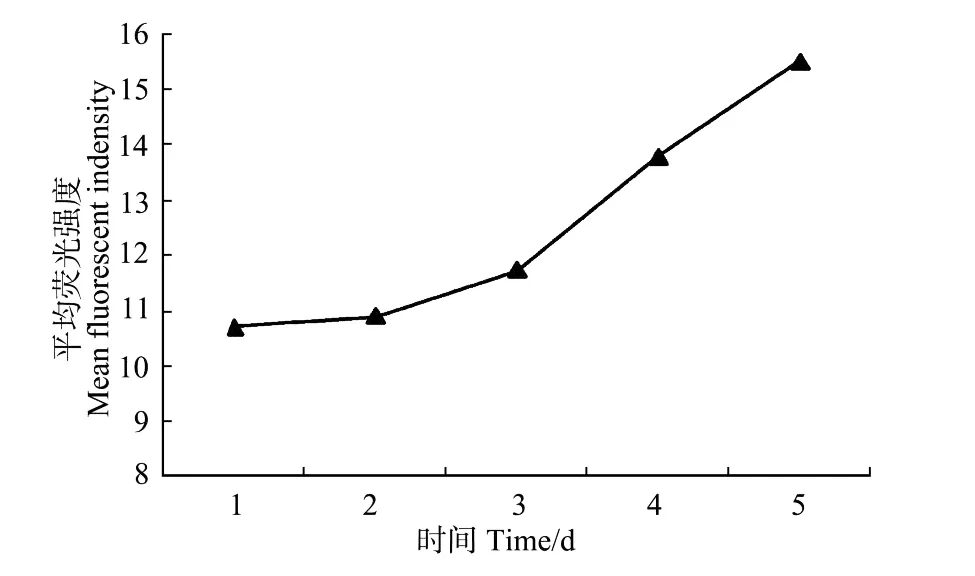
图6 被感染血细胞平均荧光强度的变化Fig.6 Variety of mean fluorescence intensity of the infected haemocytes
3 讨论
人工感染WSSV后,随时间延长螯虾的累积死亡率逐渐上升。为探明血细胞的病毒感染规律,本研究采取了以下措施来确保实验数据的准确性:第一,取活螯虾的血细胞进行检测分析;第二,保证足量的取样基数;第三,设立螯虾感染观察组,以与血细胞的病毒感染情况进行比较。另外,感染6 d后螯虾累积死亡率已达到90%,因而停止流式采样与检测。
已有多项研究表明,宿主感染WSSV后血细胞数量较感染前明显降低[5-9];也有研究发现凡纳滨对虾及宽大太平螯虾随WSSV感染时间延长,血细胞数量呈现先升高后降低的趋势[6,8]。本研究显示,感染WSSV后第1天,克氏原螯虾的血细胞数量较感染前出现明显升高,之后开始降低。从第3天开始,下降速度明显加快。其原因分析为:在WSSV感染克氏原螯虾的初期,WSSV刺激造血组织加速产生血细胞,此时血细胞因病毒感染而产生的崩解滞后于血细胞的产生速度,使得血细胞密度高于感染前[6];随着感染程度的加深,血细胞被感染率增加,WSSV在血细胞中高强度的增殖直接导致血细胞的崩解死亡,同时,宿主为防御病毒而引发的细胞凋亡也是导致宿主血细胞数量急剧减少的主要原因[9]。另外,数据显示,感染后期克氏原螯虾的血细胞密度仅为阴性对照组的21.3%,而Sahul Hameed等的研究结果表明斑节对虾和印度对虾感染WSSV后,濒死时血细胞的总数仍不低于未感染时总数的1/2[9],两者数量变化的差异,推测是宿主和感染方式不同造成的。
本文结果显示,感染WSSV后螯虾被感染血细胞的比例在1~3 d内缓慢增加,其后急剧增多、并在第4天时达到高峰后骤降。作者认为,病毒对血细胞的感染率可直接反映宿主体内病毒的增殖程度。本试验中,血细胞的最高感染比例约为26%,此时螯虾的累积死亡率不到40%;之后螯虾死亡率升高,但血细胞的病毒感染比例下降,当螯虾累积死亡率达到70%时,血细胞感染率仅为4.94%。综合螯虾死亡率与血细胞感染率的变化可以推测,血细胞感染比例达到26%后,WSSV在螯虾体内的增殖已接近其致死的临界点,因而此后螯虾开始死亡,并且,由于被感染细胞的大量崩解死亡,血细胞感染率随之急剧降低。本文采用流式细胞仪检测的样品均为活螯虾的血细胞、并以完整细胞为对象,实验结果表明血细胞被WSSV感染的程度与螯虾死亡密切相关。
[1] Lo C F,Ho C H,Peng S E,et al.White spot syndrome baculovirus(WSBV)detected in cultured and captured shrimp,crabs and other arthropods[J].Diseases of Aquatic Organisms,1996,27:215-222.
[2] Tsai J M,Wang H C,Leu J H,et al.Identification of the nucleocapsid,tegument,and envelope proteins of the shrimp white spot syndrome virus virion[J].Journal of Virology,2006,80(6):3021-3029.
[3] Wu W,Wang L,Zhang X.Identification of white spot syndrome virus(WSSV)envelope proteins involved in shrimp infection[J].Virology,2005,332:578-583.
[4] 罗展,黄倢,周丽.抗白斑综合征病毒(WSSV)感染途径研究进展[J].海洋水产研究,2007,28(5):116-122.
[5] van de Braak C B T,Botterblom M H A,Huisman E A,et al.Preliminary study on haemocyte response to white spot syndrome virus infection in black tiger shrimpPenaeus monodon[J].Diseases of Aquatic Organisms,2002,51:149-155.
[6] 张志栋,战文斌,薛艳红,等.凡纳滨对虾(Litopenaeus vannamei)感染白斑症病毒(WSSV)后大颗粒血细胞的变化[J].海洋与湖沼,2005,36(1):67-71.
[7] Wang Y T,Liu W,Seah J N,et al.White spot syndrome virus(WSSV)infects specific hemocytes of the shrimpFenneropenaeus merguiensis[J].Diseases of Aquatic Organisms,2002,52:249-259.
[8] Jiravanichpaisal P,Bangyeekhun E,S˚derh?ll K,et al.Experimental infection of White Spot Syndrome virus in freshwater crayfishPacif astacus leniuculus[J].Diseases of Aquatic Organisms,2001,47:151-157.
[9] Sahul Hameed A S,Sarathi M,Sudhakaran R,et al.Quantitative assessment of apoptotic hemocytes in white spot syndrome virus(WSSV)-infected penaeid shrimp,Penaeus monodonandPenaeus indicus,by flow cytometri analysis[J].Aquaculture,2006,256:111-120.
[10] Jiravanichpaisal P,Sricharoen S,S˚derh?ll I,et al.White spot syndrome virus(WSSV)interaction with crayfish haemocytes[J].Fish&Shellfish Immunology,2006,20:718-727.
[11] 王轶南,战文斌.流式细胞术检测对虾白斑症病毒(WSSV)对克氏原螯虾血细胞的感染[J].中国海洋大学学报:自然科学版,2008,38(3):384-388.
[12] Zhan W B,Wang Y H,Fryer J L,et al.Production of monoclonal antibodies(Mabs)against white spot syndrome virus(WSSV)[J].Journal of Aquatic Animal Health,1999,1:17-22.
Infection Process of WSSV in Haemocytes of Procambarus clarkii
WANG Yi-Nan,ZHAN Wen-Bin,TANG Xiao-Qian,XINGJing
(The Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China)
Procambarus clarkiiwere injected with WSSV and then haemocytes were collected every 24 h.After reacted with WSSV specific monoclonal antibodies and secondary antibody conjugated with FITC,the haemocytes were detected for WSSV infection using a flow cytometer.Meanwhile,the accumulative mortalities and the haemocyte densities were also recorded.Results showed that after WSSV infection,the accumulative mortalities ofProcambarus clarkiiwere 3.3%,13.3%,16.7%,36.7%and 70.0%,respectively,from day 1 to day 7;the infected rates of haemocyte were 6.47%,6.93%,10.65%,26.08%and 4.94%,respectively,from day 1 to day 5;the mean fluorescence intensities of infected haemocytes were 10.7,10.89,11.71,13.77 and 15.47,respectively,from day 1 to day 5;the haemocyte densities were(7.56±0.30),(5.60±0.24),(4.21±0.30),(1.45±0.26),(1.21±0.21)and(1.14±0.18)×106cells/mL,respectively,from day 1 to day 6,while the haemocyte density of negative control was(5.34±0.22)×106cells/mL.The results indicated that afterProcambarus clarkiiinfected with WSSV,the density of haemocytes in haemolymph rose at first and then declined,and till day 6 the value was only 21.3%of that in control;and the WSSV amount in the infected haemocytes kept rising;the infected rate of haemocyte increased to the highest value whenProcambarus clarkiiwent into moribund stage,which revealed that the WSSV infection degree of haemocytes inProcambarus clarkiihas a close relationship with its mortality.
Procambarus clarkii;haemocytes;WSSV
S917
A
1672-5174(2010)09-056-05
国家重点基础研究发展计划项目(2006CB101806);国家高技术研究发展计划项目(2006AA100312)资助
2009-11-27;
2010-04-26
王轶南(1980-),女,助理研究员,主要从事水产动物病害与免疫学研究,现于大连海洋大学工作。E-mail:wisteriayn@gmail.com
**通讯作者:E-mail:wbzhan@ouc.edu.cn
责任编辑 于 卫
