孕前超重/肥胖孕妇胎盘中长链非编码RNA肺腺癌转移相关转录本1对母婴代谢的影响研究
2024-06-17张瑾张蕊池晶晶李亚白文佩
张瑾 张蕊 池晶晶 李亚 白文佩
【摘要】 背景 孕前肥胖会给母体及胎儿带来一系列影响,其机制可能与母胎代谢异常有关,因此,探讨其机制对于改善胎儿预后至关重要。目的 探讨孕前不同BMI孕妇胎盘中与肥胖及血糖代谢相关因子的改变。方法 选取2019年在首都医科大学附属北京世纪坛医院分娩的单胎孕妇100例为研究对象,通过电子病历系统收集研究对象的临床资料,将孕妇按体质量分为孕前低体质量/正常体质量组(57例)和孕前超重/肥胖组(43例)。采用反转录-聚合酶链反应检测孕妇胎盘组织长链非编码RNA肺腺癌转移相关转录本1(LncRNA MALAT1)、血液淀粉样抗原3
(SAA3)、白介素6(IL-6)mRNA表达。结果 研究对象年龄22~43岁,平均年龄(32.7±4.2)岁;其中初产妇61例,妊娠期糖尿病(GDM)患者21例,低体质量14例,正常体质量43例,超重26例,肥胖17例。孕前超重/肥胖组GDM比例、新生儿体质量高于孕前低体质量/正常体质量组,妊娠期增重低于孕前低体质量/正常体质量组(P<0.05)。孕前超重/肥胖组孕妇胎盘组织LncRNA MALAT1 mRNA表达量高于孕前低体质量/正常体质量组(P<0.05)。孕前肥胖孕妇胎盘组织中LncRNA MALAT1、SAA3、IL-6的mRNA表达量高于孕前正常体质量孕妇(P<0.05)。结论 孕前过高的BMI对妊娠期母婴的影响更大,掩盖了妊娠期控制体质量增加的效果。在肥胖孕妇中,LncRNA MALAT1可能通过SAA3、IL-6调节葡萄糖和脂肪稳态,涉及炎症变化和氧化应激,从而影响胎儿代谢,值得进行更深入的探索。
【关键词】 妊娠期肥胖;糖尿病,妊娠;长链非编码RNA肺腺癌转移相关转录本1;回顾性研究
【中图分类号】 R 714.2 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0461
Impact of LncRNA MALAT1 in the Placentas of Pre-pregnancy Overweight/Obese Women on Maternal and Infant Metabolism
ZHANG Jin,ZHANG Rui,CHI Jingjing,LI Ya,BAI Wenpei*
Department of Obstetrics and Gynecology,Beijing Shijitan Hospital,Capital Medical University,Beijing 100038,China
*Corresponding author:BAI Wenpei,Chief physician/Doctoral supervisor;E-mail:baiwp@bjsjth.cn
【Abstract】 Background Pre-pregnancy obesity can have a range of effects on both the mother and the fetus,possibly due to abnormalities in maternal-fetal metabolism. Therefore,exploring the mechanisms is essential to improve fetal prognosis. Objective To investigate the alterations of factors associated with obesity and glucose metabolism in the placentas of pregnant women with different BMI levels before pregnancy. Methods A total of 100 singleton pregnant women who delivered in Beijing Shijitan Hospital,Capital Medical University in 2019 were selected as the study subjects. The clinical data were collected based on the electronic medical record system. The subjects were divided into the low/normal body mass group(n=57)and overweight/obese group(n=43)based on their pre-pregnancy body mass. The expression of long non-coding RNA metastasis-associated Lung adenocarcinoma transcript 1(LncRNA MALAT1),serum amyloid A3(SAA3),and interleukin 6(IL-6)mRNA in placental tissue were measured using reverse transcription-polymerase chain reaction. Results The age of the subjects ranged from 22 to 43 years,with an average age of(32.7±4.2)years,including 61 primiparas,21 with gestational diabetes mellitus(GDM),14 with low body mass,43 with normal body mass,26 with overweight,and 17 with obese. The proportion of GDM and neonatal body mass in the overweight/obese group was higher than that in the low/normal body mass group,and the weight gain during pregnancy was lower than that in the low/normal body mass group,with statistically significant differences(P<0.05). The expression of LncRNA MALAT1 mRNA in placental tissue was higher in the overweight/obese group than the low/normal body mass group,with a statistically significant difference(P<0.05). The mRNA expression of LncRNA MALAT1,SAA3,and IL-6 mRNA in the placental tissue of obese pregnant women were higher than those of normal pre-pregnancy body mass,with statistically significant difference(P<0.05). Conclusion Excessive pre-pregnancy BMI has a more significant impact on mother and child during pregnancy,overshadowing the effects of controlling weight gain during pregnancy. In obese pregnant women,LncRNA MALAT1 may regulate glucose and lipid homeostasis through SAA3 and IL-6,involving inflammatory changes and oxidative stress,thereby affecting fetal metabolism,which deserves more in-depth exploration.
【Key words】 Obesity,maternal;Diabetes,gestational;LncRNA MALAT1;Retrospective studies
目前全球超重和肥胖人群日益增多,妊娠期女性的精细化体质量管理已经越来越受到重视[1]。妊娠期肥胖会对母体及胎儿带来一系列影响,诸多研究显示,妊娠期母体超重或肥胖会引起子代肥胖率及相关慢性代谢性疾病发生率升高[2-4]。究其机制,可能与母胎之间双向代谢、循环、内分泌等因素有关,其平衡状态有助于胎盘微环境的稳定[5]。因此,推测妊娠期肥胖导致的一系列母胎问题与某些胎盘因子相关。为解释该问题,本研究对肥胖相关的胎盘因子进行探索。
长链非编码RNA肺腺癌转移相关转录本1(LncRNA MALAT1)是一种长度约6.5 kb的长链非蛋白质编码RNA,在糖尿病中有较多研究,已有报道证实LncRNA MALAT1表达失调参与糖尿病相关微血管疾病和糖尿病视网膜病变的病理过程[6-7],血液淀粉样抗原3(SAA3)是LncRNA MALAT1的直接靶点,炎症级联调节因子白介素6(IL-6)和肿瘤坏死因子α(TNF-α)也起着重要作用。亦有报道LncRNA MALAT1参与脂质代谢[8],在动物实验及肥胖人群研究中均显示,MALAT1通过调节脂质转录因子的表达,促进细胞脂质积累[9]。
因此,本研究对于孕前不同BMI孕妇胎盘中LncRNA MALAT1、SAA3及IL-6的表达进行检测及分析,目的是筛查胎盘中可能与肥胖及母胎代谢异常相关的因子,结合分娩结局,探讨其对母婴代谢的影响及作用机制,以期对孕前肥胖孕妇进行更加精准的妊娠期管理。
1 对象与方法
1.1 研究对象
选取2019年在首都医科大学附属北京世纪坛医院分娩符合纳入标准的单胎孕妇100例为研究对象。纳入标准:单胎妊娠;足月分娩并在首都医科大学附属北京世纪坛医院规律产检的孕妇;无宫内感染;无合并内、外科疾病;无前置胎盘;自愿留取胎盘组织者。排除标准:双胎或多胎妊娠;28周前流产;宫内感染;胎死宫内;合并内、外科疾病者;前置胎盘;未规律产检者。本研究通过首都医科大学附属北京世纪坛医院伦理委员会批准[sjtkyll-lx-2021(11)]。研究对象均签署知情同意书。
1.2 研究方法
通过电子病历系统收集研究对象的临床资料,包括一般状况(年龄、身高、体质量、受教育程度、工作状况,并计算BMI),产次,是否瘢痕子宫,是否子宫肌瘤,妊娠期增重(定义为分娩前最后记录的孕妇体质量与妊娠前体质量的差异),孕早期空腹胰岛素,孕早期空腹血糖,孕产妇结局[包括剖宫产、难产(阴道助产及肩难产)、妊娠期糖尿病(GDM)、产后出血],新生儿结局[新生儿出生体质量、巨大儿(出生体质量≥4 000 g)、小于胎龄儿(出生体质量<同孕龄平均体质量第10百分位数)和胎儿宫内窘迫]。
1.3 分组
根据2009年美国医学研究所(Institute of Medicine,IOM)给出的定义[10],孕前低体质量定义为BMI<18.5 kg/m2,正常体质量定义为18.5 kg/m2≤BMI<25.0 kg/m2,超重定义为25.0 kg/m2≤BMI<30.0 kg/m2,肥胖定义为BMI≥30.0 kg/m2。将孕妇分为孕前低体质量/正常体质量组(57例)和孕前超重/肥胖组(43例)。
1.4 反转录-聚合酶链反应(RT-PCR)检测孕妇胎盘组织LncRNA MALAT1、SAA3、IL-6 mRNA表达
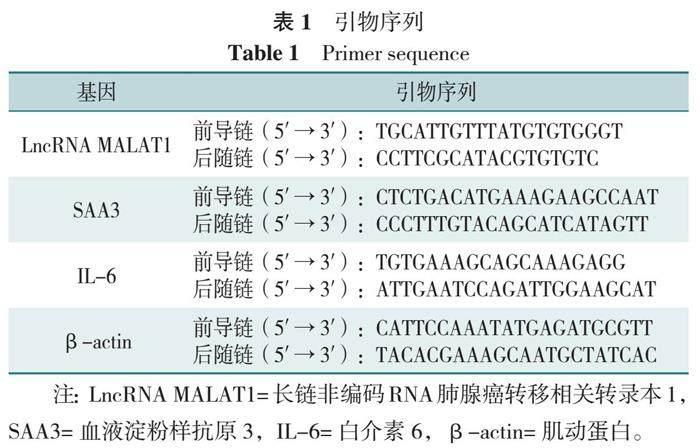
参照说明书制备反转录反应体系[0.5 μg RNA+2 μL 5×TransScript AⅡ-in-One First-Strand cDNA Synthesis SuperMIX for qPCR(北京全式金生物技术有限公司)+0.5 μL gDNA去除剂],反应在GeneAmp?PCR系统9700(美国应用生物系统公司)中进行,反应条件:42 ℃,15 min,85 ℃,5 s,随后将反应体系在无核酸酶水中稀释10倍,将cDNA置于-20 ℃保存。配置PCR反应体系[1 μL cDNA+5 μL 2×perfectStartTM Green qPCR SuperMix(北京全式金生物技术有限公司)+0.2 μL正向引物+0.2 μL反向引物+3.6μL无核酸酶水],反应在384孔光学板(瑞士罗氏)中于94 ℃孵育30 s,随后在94 ℃孵育5 s,60 ℃孵育30 s。以肌动蛋白(β-actin)为内参蛋白,采用2-ΔCt法计算mRNA的相对表达量,引物序列见表1。
1.5 统计学方法
采用SPSS 22.0统计学软件进行数据分析,符合正态分布的计量资料以(x-±s)表示,两组间比较采用独立样本t检验;计数资料以相对数表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象临床资料
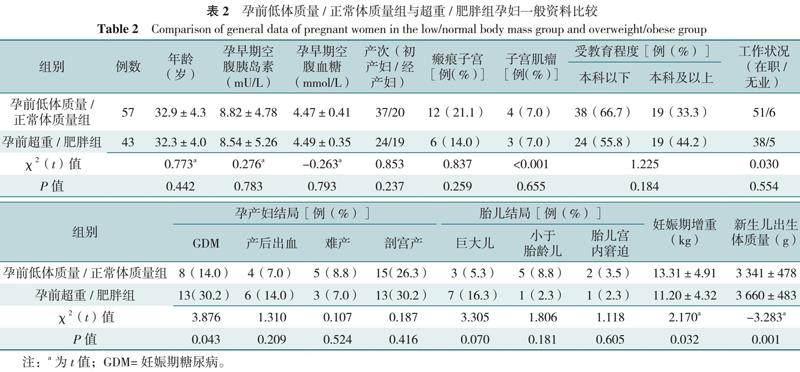
研究对象年龄22~43岁,平均年龄(32.7±4.2)岁;其中初产妇61例,GDM患者21例,低体质量14例,正常体质量43例,超重26例,肥胖17例。
孕前超重/肥胖组GDM比例、新生儿出生体质量高于孕前低体质量/正常体质量组,妊娠期增重低于孕前低体质量/正常体质量组,差异有统计学意义(P<0.05),两组年龄、孕早期空腹胰岛素、孕早期空腹血糖、产次、瘢痕子宫比例、子宫肌瘤比例、受教育程度(本科及以上)、工作状况、产后出血、难产、剖宫产比例及胎儿结局比较,差异无统计学意义(P>0.05),见表2。
2.2 孕妇胎盘组织LncRNA MALAT1、SAA3、IL-6 mRNA表达情况
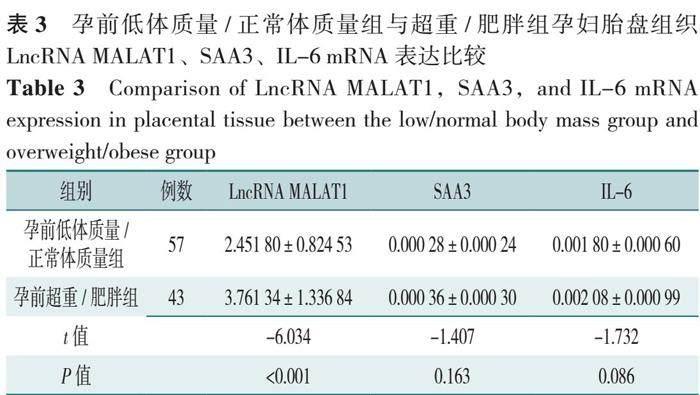
孕前超重/肥胖组孕妇胎盘组织LncRNA MALAT1 mRNA表达量高于孕前低体质量/正常体质量组,差异有统计学意义(P<0.05);两组SAA3、IL-6 mRNA表达量比较,差异无统计学意义(P>0.05),见表3。
进一步分析孕前正常体质量孕妇和孕前肥胖孕妇胎盘组织LncRNA MALAT1、SAA3、IL-6 mRNA表达情况,孕前肥胖孕妇胎盘组织中LncRNA MALAT1(4.281 99±1.37443比2.531 54±0.85462,t=-5.963,P<0.001)、SAA3(0.000 43±0.000 36比0.000 27±0.000 23,t=-2.111,P=0.039)、IL-6(0.002 34±0.001 13比0.001 81±0.000 61,t=-2.336,P=0.023)的mRNA表达量高于孕前正常体质量孕妇,差异有统计学意义(P<0.05)。
3 讨论
既往研究表明,孕前肥胖的母亲,子代肥胖发生率显著升高,不仅新生儿出生体质量明显增高,儿童期及青春期肥胖发生率也会升高,并且更易合并高血脂、高血糖等代谢性疾病[11-13]。此外,肥胖产妇难产和手术助产的概率也会升高,因其胎儿偏大,产妇软组织增厚,容易发生宫缩乏力、产程进展缓慢及胎位异常[14-15]。
本研究分析了孕前不同BMI孕妇的分娩结局,发现与孕前低体质量/正常体质量孕妇相比,虽然超重/肥胖孕妇妊娠期增重明显降低,但新生儿出生体质量仍然偏高,并且孕前过高的BMI增加了母体GDM的发生率,考虑相比妊娠期体质量管理而言,孕前BMI对妊娠期母体及胎儿的影响更大,并且掩盖了妊娠期控制体质量增加的效果,推测其机制与胎盘异常因子分泌导致母胎之间代谢异常有关。
妊娠时母体激素水平波动,可能会激活某些炎症信号通路,加重胎盘炎症反应。肥胖孕妇激素变化更加明显,可能出现氧化应激,甚至影响胎盘功能[16-17]。本研究发现孕前超重/肥胖孕妇胎盘中LncRNA MALAT1的表达显著高于孕前低体质量/正常体质量孕妇,炎症级联调节因子SAA3及IL-6的表达也显著升高,GDM孕妇胎盘中LncRNA MALAT1的表达显著升高。
既往研究表明,LncRNA MALAT1及全身性炎症状态影响GDM的疾病进展[18],LncRNA MALAT1与氧化应激诱导和炎性因子的产生有关[19-20],可为GDM的早期预测、妊娠期干预、精准治疗提供新的靶点[21]。PUTHANVEETIL等[6]报道高血糖可通过MALAT1刺激人脐静脉内皮细胞中的SAA3蛋白表达,并伴随着IL-6和TNF-α等炎症递质的表达增加,本研究结果与之一致。
YAN等[9]发现LncRNA MALAT1在高脂诱导的小鼠肝细胞和肥胖小鼠的肝脏中表达增加,LncRNA MALAT1与细胞核中甾醇调节元件结合蛋白(SREBP)-1c蛋白结合抑制了其泛素化,该蛋白由胰岛素激活,在肝细胞中大量表达,为调节肝脏脂肪生成的关键转录因子,因此增加了细胞脂质积累;敲低LncRNA MALAT1后显著下调了SREBP-1c的表达,并逆转了肥胖小鼠的肝脏脂质积累和胰岛素抵抗。另有研究显示,在糖尿病小鼠的胰岛细胞中,LncRNA MALAT1的表达增加,抑制胰岛素分泌,诱导β细胞功能障碍[22],LncRNA MALAT1缺失小鼠对胰岛素的敏感性提高[23],高脂肪饮食小鼠肌肉中LncRNA MALAT1表达显著增加,与胰岛素抵抗和葡萄糖稳态途径有关[24]。但亦有报道LncRNA MALAT1在肥胖小鼠的白色脂肪组织中减少,其缺失对饮食诱导的脂肪组织增加和肥胖小鼠的脂质稳态没有影响[25]。在肥胖人群中也有类似研究,PATEL等[26]发现,与体质量正常受试者相比,肥胖受试者脂肪干细胞的外泌体中有多种LncRNA表达差异,其中LncRNA MALAT1表达显著升高。EBRAHIMI等[27]检测了肥胖女性脂肪组织中LncRNA MALAT1的表达,发现LncRNA MALAT1的表达与SREBP-1c、过氧化物酶体增殖物激活受体γ(PPAR-γ)等主要的脂肪生成基因呈正相关,从而在脂质调节中发挥作用。
有报道LncRNA MALAT1调节脂质代谢的机制,MALAT1可调节下丘脑和脂肪组织之间的相互作用,如肥胖小鼠的脂肪细胞分泌含有LncRNA MALAT1的细胞外囊泡,可以通过下丘脑雷帕霉素靶蛋白信号调节下丘脑厌食性促阿片-黑素细胞皮质素原神经元,从而影响身体摄入能量,在体内和体外均得到了证实[28]。在恶性肿瘤患者的研究中也发现,LncRNA MALAT1可以调节PPAR-γ的转录,敲低LncRNA MALAT1可显著下调PPAR-γ,进而抑制脂肪生成过程,而造成脂肪丢失[29]。
本研究分析了不同孕前BMI妊娠期女性的妊娠期增重及分娩结局,发现即使妊娠期增重减少,孕前过高的BMI仍然增加了新生儿体质量,并增加了GDM的发生率,考虑孕前肥胖对妊娠期母体及胎儿的影响更大,掩盖了妊娠期控制体质量增加的效果。在肥胖孕妇中,LncRNA MALAT1可能通过SAA3、IL-6调节炎症变化,调节孕妇的葡萄糖和脂肪稳态,从而影响胎儿代谢。结合查阅文献,考虑LncRNA MALAT1可能通过某种机制调节胎儿下丘脑中的信号通路,调节子代能量摄入,从而对子代产生影响,值得进行更深入的探索和研究。
本研究局限性:(1)样本来自本院建档分娩的孕妇,产检医生不同,孕前宣教及妊娠期体质量管理模式有细微差异,可能对母婴结局有一定影响;(2)肥胖对代谢的影响机制错综复杂,涉及多通路、多途径、多因素,需要进行更全面地分析和讨论;(3)本研究仅在孕前正常体质量及肥胖孕妇中发现了SAA3、IL-6的表达差异,考虑是由于样本量限制。
4 小结
综上所述,相比妊娠期体质量管理而言,孕前肥胖对妊娠期母体及胎儿的影响更大,甚至削减了妊娠期体质量控制的获益,而其机制,可能与LncRNA MALAT1通过SAA3、IL-6调节炎症变化,从而影响胎儿代谢。
作者贡献:张瑾提出主要研究目标,负责研究的构思与设计,数据分析并撰写论文;张蕊和池晶晶负责临床资料的收集与数据统计;李亚负责试验的实施;白文佩负责文章的质量控制与审查,对文章整体负责,监督管理。
本文无利益冲突。
参考文献
AFSHIN A,REITSMA M B,MURRAY C J L. Health effects of overweight and obesity in 195 countries[J]. N Engl J Med,2017,377(15):1496-1497. DOI:10.1056/NEJMc1710026.
SHRESTHA N,EZECHUKWU H C,HOLLAND O J,et al. Developmental programming of peripheral diseases in offspring exposed to maternal obesity during pregnancy[J]. Am J Physiol Regul Integr Comp Physiol,2020,319(5):R507-516. DOI:10.1152/ajpregu.00214.2020.
HSU M H,CHEN Y C,SHEEN J M,et al. Maternal obesity programs offspring development and resveratrol potentially reprograms the effects of maternal obesity[J]. Int J Environ Res Public Health,2020,17(5):1610. DOI:10.3390/ijerph17051610.
BOWMAN C E,ARANY Z,WOLFGANG M J. Regulation of maternal-fetal metabolic communication[J]. Cell Mol Life Sci,2021,78(4):1455-1486. DOI:10.1007/s00018-020-03674-w.
BERTI C,CETIN I,AGOSTONI C,et al. Pregnancy and infants' outcome:nutritional and metabolic implications[J]. Crit Rev Food Sci Nutr,2016,56(1):82-91. DOI:10.1080/10408398.2012.745477.
PUTHANVEETIL P,CHEN S L,FENG B,et al. Long non-coding RNA MALAT1 regulates hyperglycaemia induced inflammatory process in the endothelial cells[J]. J Cell Mol Med,2015,19(6):1418-1425. DOI:10.1111/jcmm.12576.
ABDULLE L E,HAO J L,PANT O P,et al. MALAT1 as a diagnostic and therapeutic target in diabetes-related complications:a promising long-noncoding RNA[J]. Int J Med Sci,2019,16(4):548-555. DOI:10.7150/ijms.30097.
VAN SOLINGEN C,SCACALOSSI K R,MOORE K J. Long noncoding RNAs in lipid metabolism[J]. Curr Opin Lipidol,2018,29(3):224-232. DOI:10.1097/MOL.0000000000000503.
YAN C F,CHEN J F,CHEN N Q. Long noncoding RNA MALAT1 promotes hepatic steatosis and insulin resistance by increasing nuclear SREBP-1c protein stability[J]. Sci Rep,2016,6:22640. DOI:10.1038/srep22640.
Institute of Medicine,National Research Council. Weight gain during pregnancy:reexamining the guidelines[M]. Washington:the National Academies Press,2009:2.
HESLEHURST N,VIEIRA R,AKHTER Z,et al. The association between maternal body mass index and child obesity:a systematic review and meta-analysis[J]. PLoS Med,2019,16(6):e1002817. DOI:10.1371/journal.pmed.1002817.
ADANE A A,TOOTH L R,MISHRA G D. The role of offspring's birthweight on the association between pre-pregnancy obesity and offspring's childhood anthropometrics:a mediation analysis[J]. J Dev Orig Health Dis,2019,10(5):570-577. DOI:10.1017/S2040174418001137.
梁晶晶,胡艳,邢艳菲,等. 母亲孕前体质指数及孕期增重与学龄前儿童超重肥胖的关系研究[J]. 中华流行病学杂志,2019,40(8):976-981. DOI:10.3760/cma.j.issn.0254-6450.2019.08.019.
GANER HERMAN H,DEKALO A,JUBRAN L,et al. Obstetric outcomes and placental findings in gestational diabetes patients according to maternal prepregnancy weight and weight gain[J]. J Matern Fetal Neonatal Med,2019,32(10):1682-1687. DOI:10.1080/14767058.2017.1416078.
赵瑞芬,张为远,周莉. 初产妇孕前体质指数及孕期体质量增加量与产程中行紧急剖宫产术风险的关系[J]. 中华妇产科杂志,2017,52(11):757-764.
KELLY A C,POWELL T L,JANSSON T. Placental function in maternal obesity[J]. Clin Sci,2020,134(8):961-984. DOI:10.1042/CS20190266.
CATALANO P M,SHANKAR K. Obesity and pregnancy:mechanisms of short term and long term adverse consequences for mother and child[J]. BMJ,2017,356:j1. DOI:10.1136/bmj.j1.
ZHANG Y,QU L P,NI H J,et al. Expression and function of lncRNA MALAT1 in gestational diabetes mellitus[J]. Adv Clin Exp Med,2020,29(8):903-910. DOI:10.17219/acem/121524.
YAN B,TAO Z F,LI X M,et al. Aberrant expression of long noncoding RNAs in early diabetic retinopathy[J]. Invest Ophthalmol Vis Sci,2014,55(2):941-951. DOI:10.1167/iovs.13-13221.
LETI F,LEGENDRE C,STILL C D,et al. Altered expression of MALAT1 lncRNA in nonalcoholic steatohepatitis fibrosis regulates CXCL5 in hepatic stellate cells[J]. Transl Res,2017,190:25-39.e21. DOI:10.1016/j.trsl.2017.09.001.
ZHANG Y S,WU H Y,WANG F Y,et al. Long non-coding RNA MALAT1 expression in patients with gestational diabetes mellitus[J]. Int J Gynaecol Obstet,2018,140(2):164-169. DOI:10.1002/ijgo.12384.
DING H X,WANG F J,SHI X L,et al. LncRNA MALAT1 induces the dysfunction of β cells via reducing the histone acetylation of the PDX-1 promoter in type 1 diabetes[J]. Exp Mol Pathol,2020,114:104432. DOI:10.1016/j.yexmp.2020.104432.
CHEN J S,KE S,ZHONG L,et al. Long noncoding RNA MALAT1 regulates generation of reactive oxygen species and the insulin responses in male mice[J]. Biochem Pharmacol,2018,152:94-103. DOI:10.1016/j.bcp.2018.03.019.
KAZEMINASAB F,MARANDI S M,BAHARLOOIE M,et al. Aerobic exercise modulates noncoding RNA network upstream of FNDC5 in the Gastrocnemius muscle of high-fat-diet-induced obese mice[J]. J Physiol Biochem,2021,77(4):589-600. DOI:10.1007/s13105-021-00825-w.
CARTER S,MIARD S,BOIVIN L,et al. Loss of Malat1 does not modify age- or diet-induced adipose tissue accretion and insulin resistance in mice[J]. PLoS One,2018,13(5):e0196603. DOI:10.1371/journal.pone.0196603.
PATEL R S,CARTER G,EL BASSIT G,et al. Adipose-derived stem cells from lean and obese humans show depot specific differences in their stem cell markers,exosome contents and senescence:role of protein kinase C delta (PKCδ) in adipose stem cell niche[J]. Stem Cell Investig,2016,3:2. DOI:10.3978/j.issn.2306-9759.2016.01.02.
EBRAHIMI R,TOOLABI K,JANNAT ALI POUR N,et al. Adipose tissue gene expression of long non-coding RNAs; MALAT1,TUG1 in obesity:is it associated with metabolic profile and lipid homeostasis-related genes expression?[J]. Diabetol Metab Syndr,2020,12:36. DOI:10.1186/s13098-020-00544-0.
GAO J,LI X Y,WANG Y,et al. Adipocyte-derived extracellular vesicles modulate appetite and weight through mTOR signalling in the hypothalamus[J]. Acta Physiol,2020,228(2):e13339. DOI:10.1111/apha.13339.
HAN J,SHEN L,ZHAN Z,et al. The long noncoding RNA MALAT1 modulates adipose loss in cancer-associated cachexia by suppressing adipogenesis through PPAR-γ[J]. Nutr Metab,2021,18(1):27. DOI:10.1186/s12986-021-00557-0.
(本文编辑:邹琳)
*通信作者:白文佩,主任医师/博士生导师;E-mail:baiwp@bjsjth.cn
基金项目:北京市自然科学基金资助项目(7202075);国铁集团医疗卫生专项课题(J2021Z604);国家更年期保健特色专科项目(2019);北京市医院管理中心临床医学发展专项经费资助项目(ZYLX202112)
引用本文:张瑾,张蕊,池晶晶,等. 孕前超重/肥胖孕妇胎盘中长链非编码RNA肺腺癌转移相关转录本1对母婴代谢的影响研究[J]. 中国全科医学,2024,27(27):3383-3387. DOI:10.12114/j.issn.1007-9572.2023.0461. [www.chinagp.net]
ZHANG J,ZHANG R,CHI J J,et al. Impact of LncRNA MALAT1 in the placentas of pre-pregnancy overweight/obese women on maternal and infant metabolism[J]. Chinese General Practice,2024,27(27):3383-3387.
? Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.
