缓控释肥处理下油橄榄土壤微生物多样性特征分析*
2024-04-12秃玉翔胡青辛培尧陆斌郭永清赵敏郝佳波赵川徐亮
秃玉翔,胡青,辛培尧,陆斌,郭永清,赵敏,郝佳波,赵川,徐亮
(1.西南林业大学园林园艺学院,云南 昆明 650224;2.云南省林业和草原科学院,云南 昆明 650201;3.西南林业大学国家林业和草原局西南风景园林工程技术研究中心,云南 昆明 650224;4.西南林业大学西南地区生物多样性保育国家林业和草原局重点实验室,云南 昆明 650224)
油橄榄(OleaeuropaeaLinn.)为木犀科(Oleaceae)木犀榄属(OleaLinn.)的一种常绿小乔木植物,原产在地中海沿岸一带的小亚细亚等地区,与油茶(CamelliaoleiferaAbel.)、棕榈[Trachycarpusfortunei(Hook.) H.Wendl.]和椰子(CocosnuciferaL.)合称世界四大木本油料作物[1]。油橄榄20世纪60年代开始引种至我国,现在云南、甘肃、四川等主产区大规模种植[2]。云南油橄榄种植区大多为黏重酸性土壤,透气性差、易板结、保肥能力差等因素使其生长受到制约,严重阻碍了油橄榄植株的健康生长,导致其产量低[3]。因此,亟需探究适合的肥料和合理的施肥方案以改变土壤环境现状使之更适宜油橄榄生长,提高产量。
高效施肥既能提高肥料利用效率,又能保持土壤长期可持续生产[4]。新型缓控释肥料中的天然活性有机物质具有络合性、吸附性等特点,在进入土壤后能够激发土壤微生物活性,从而促进有机氮(微生物氮)和无机氮的交换[5]。新型缓控释肥料比普通化肥具有更高的利用率,能够减少化肥用量从而保护环境,成为替代传统化肥的最佳作物用肥[6]。土壤微生物是土壤生物中最为活跃的部分,能够运输和供应养分以及调节土壤环境,是植物体生长中不可或缺的部分,其种类和数量能够反映出该环境下其群落的多样性水平,能够表现出土壤微生态的稳定程度[7-8]。土壤微生物的活跃程度与土壤肥力存在一定关联,研究表明土壤微生物丰富程度能够决定土壤品质与作物的适宜程度和对作物的养分供应状况,土壤微生物多样性是影响土壤生产力的重要因素,土壤微环境越复杂,功能就越稳定[9]。
冯军等[10]以栽培方式结合不同施肥水平对比发现,秸秆覆盖+缓释肥减量20%与沟垄覆盖+缓释肥减量20%的方式更利于油菜的土壤微生物生长;任宏芳等[11]对气候变化背景下缓释肥处理的麦田土壤进行微生物测序分析,发现气候环境变化较缓释肥处理对土壤微生物影响更大,进一步认识了影响土壤微生物结构和特征的内外因素;唐亚福[12]发现苹果施加活化腐植酸缓释肥后均能够增加土壤细菌数量及种类,但是会减少真菌及群落结构。这些研究均能说明缓释肥的使用能够显著影响土壤中的微环境变化,且表现出缓释肥在生产中具有良好的使用前景,但国内关于缓释肥对油橄榄土壤微生物多样性的影响还鲜有报道。本研究对6 a生的油橄榄施用不同组合方案的缓控释肥,通过分析不同施肥处理下油橄榄不同土层的微生物多样性,揭示新型缓释肥组合对油橄榄土壤微生物群落结构的影响,以期为油橄榄种植地的土壤质量管理和合理施肥提供参考。
1 材料与方法
1.1 试验区概况
试验区为丽江市玉龙纳西族自治县大具乡田园油橄榄基地(100°15′19″E,27°18′01″N),平均海拔1 724 m。该区域土壤pH 6.9~7.08,含有机质25.46 g/kg、碱解氮132.88 mg/kg、有效磷20.12 mg/kg、速效钾32.15 mg/kg,容重1.21 g/cm2,孔隙度54.05,土质为粉壤土[13]。地处玉龙雪山北麓、金沙江畔的干热河谷区,年降水量600~900 mm,年活动积温5 700℃,7月极高温33.6℃,1月极低温-4℃,年均气温约17℃[14]。
1.2 试验材料
于2021年4月在试验地选取6 a生油橄榄“柯基”(O.europaea‘Koroneiki’)进行施肥试验,肥料为生物质活性半焦矿物肥料和控释肥组合使用。半焦肥为包头市新木集团生产的将生物激素应用于生物肥料的新型肥料;控释肥为精耕天下(深圳)生态科技有限公司出品的大颗粒网络控释肥,商品名为“力浮丸”。
1.3 试验设计
试验设置12个处理组,包括不施肥对照处理(CK);每组重复3次,每组施肥处理6棵树(表1)。施肥采用环状施肥,深度40 cm。试验期间各处理管护措施保持一致,施肥1 a后对土壤进行取样。
1.4 土壤样品采集及测序
于2022年6月进行土样采集。在各试验处理点内,先除去地面枯枝落叶,再依据“S”型取样法在各个取样点分别挖出剖面,分别水平采集0~10 cm土层(a)、10~20 cm土层(b)土壤样品,去除植物碎屑和碎石后,分别将每组取样点中的同一土层样品混合,按顺序将处理组与对应样品编号(表1)后放于冷藏箱内带回试验室保存在-80℃下,后续送样至杭州研趣信息技术有限公司进行土壤微生物DNA提取、PCR扩增及高通量测序。
1.5 数据处理及分析
根据PCR引物和barcode划分样品,使用在线软件FLASH v1.2.11进行Reads拼接,使用UPARSE v7.0.1090软件将大于97%相似度的序列聚类为分类单元(OTUs)并去除嵌合体后得到有效序列数。真菌采用UNITE(Release8.0;https://unite.ut.ee/)ITS数据库、细菌采用SILVA(Release132;http://www.arb-silva.de/)数据库对97%同源性的OTUs代表序列进行物种注释,之后对所有样品做均一化处理,后续分析均使用处理后的数据进行。
采用Excel 2013统计测序数据,使用软件QIIME2(2019.4)绘制出物种结构柱状图,计算Alpha多样性并进行分析,包括Chao1、Sobs、Shannon、Simpson、Pielou—e和Goods—coverage等多样性指数;得到样品内物种OTUs信息后,使用R脚本的VennDiagram包制作花瓣图,Pheatmap包绘制聚类热图,ggplot2包绘制PCA分析的二维排序图。
2 结果与分析
2.1 不同施肥处理下土壤微生物群落差异
不同施肥处理下土壤微生物中共有与特有的OUT信息如图1所示。从细菌OTU花瓣图(图1A)可知,特有的细菌OTU数量最多的是7 a,最少的是8 b。在0~10 cm土层样品中,所有施肥处理的土样中细菌特有OTU数均大于对照样品(a)。在10~20 cm土层中,除了7b其余细菌OTU数均小于对照样品(b)。说明施肥处理后0~10 cm细菌增加,而10~20 cm细菌则被抑制。从真菌OTU花瓣图(图1B)可知,特有的真菌OTU数量最多的是土样2 a,最少的是土样b。在两个土层中,所有施肥处理的土壤样品中真菌特有OTU数均大于对照样品。

图1 不同处理下土壤OTU花瓣图
2.2 不同施肥下土壤微生物α多样性
由表2所示,在细菌群落丰富度方面,0~10 cm土壤中施肥处理后的各样品Chao1指数均高于对照样品(a),处理5、7、8、11a的促进效果更为明显,处理6a与对照样品相比促进效果并不显著。10~20 cm施肥样品的Chao1指数除了处理5b、7b、11b较对照样品(b)高,其中处理7b较为显著,其余各样品均低于对照样品,只有施用少量半焦肥的情况下可以促进一部分细菌生长,但差异并不显著。在多样性方面,施肥处理的0~10 cm土壤中细菌Shannon指数、Simpson指数、Pielou—e指数、Sobs指数和Goods—coverage指数较对照样品均显著升高,表明施肥处理能够提高0~10 cm土壤中细菌多样性。10~20 cm土壤中细菌Shannon指数、Simpson指数、Pielou—e指数、Sobs指数和Goods—coverage指数较对照样品显著降低。

表2 不同施肥处理下土壤细菌α多样性指数
如表3所示,在真菌群落丰富度方面,0~10 cm施肥处理后的各样品Chao1指数均高于对照样品,11a与对照样品a相比促进效果相对较低。10~20 cm土壤施肥处理后的各样品Chao1指数均高于对照样品,4b和5b的促进效果更为明显。11b与对照样品相比促进效果相对较低;在多样性方面,施肥处理后,0~10 cm土壤中真菌除11a外其余各样品的Shannon指数、Simpson指数、Pielou_e指数和Sobs指数显著高于对照样品,而Good’s coverage指数略低。10~20 cm土壤中真菌的Shannon指数、Gini-Simpson指数、Pielou_e指数和Sobs指数较对照样品显著升高,而Good’s coverage指数略微降低。

表3 不同施肥处理下土壤真菌α多样性指数
2.3 不同施肥处理土壤微生物优势种类相对丰度
油橄榄所有土样中共检测出细菌35门111纲268目485科1 087属;真菌14门42纲95目230科431属。由图2可知,所有土样中的丰度前6的优势菌门为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)和芽单胞菌门(Gemmatimonadetes)。与对照样品相比,所有0~10 cm施肥样品的变形菌门丰度降低,酸杆菌门和芽单胞菌门丰度上升;同时所有施肥样品10~20 cm土壤中的变形菌门丰度升高,而绿弯菌门、酸杆菌门和放线菌门丰度降低。
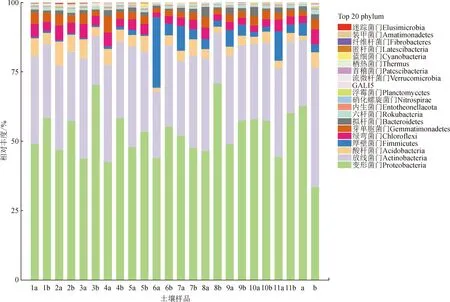
图2 不同施肥处理土壤细菌门水平相对丰度
由图3可知,土壤中真菌主要由子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和被包霉门(Mortreiellomycota)组成。与对照土样相比,所有施肥后0~10 cm样品的子囊菌门的丰度显著降低,担子菌门和被包霉门等均显著增加,处理10号对0~10 cm土壤的子囊菌门、担子菌门和被包霉门丰度影响均不大。10~20 cm的施肥土样与对照土样相比,所有施肥土样的子囊菌门和被包霉门的丰度均显著增加,而担子菌门的丰度急剧减少。

图3 不同施肥处理土壤真菌门水平相对丰度
如表4所示,不同施肥处理分别促进不同的菌群生长。镰刀菌属(Fusarium)在处理10a所占比例最大,为44.03%;无茎真菌属(Acaulium)在处理8b所占比例最大,为30.44%;瓶毛壳属(Lophotrichus)在处理11a所占比例最大,为49.49%;小囊菌属(Microascus)在处理6a所占比例最大,为29.69%;葡孢霉属(Botryotrichum)在处理9a所占比例最大,为28.53%。与0~10 cm对照土样相比,每组施肥处理中半焦肥的增加呈现出一增一减的趋势,所有施肥的土样中镰刀菌属中除了处理6a、11a丰度略微降低,其余均显著升高。无茎真菌属丰度均存在降低趋势,不同处理下呈现出大幅度的无规律变化,处理1a、2a、3a和5a降低最明显。瓶毛壳属丰度在11a中明显升高,其余均显著降低。小囊菌属除了在处理1a和6a中丰度升高,其余显著降低。葡孢霉属在处理5a、8a、9a、10a中丰度大幅度升高,其余均降低。与对照土样相比,所有施肥后的10~20 cm土壤中,镰刀菌属除了处理1b丰度略有降低,其余均明显升高。无茎真菌属除了处理1b、2b、3b、5b、7b和9b丰度显著降低,其余均有明显的上升趋势,但在只施半焦肥的处理中随着半焦肥施用量增加呈现出一升一降的结果。瓶毛壳属除了处理11b升高,其余均明显降低。小囊菌属除了处理2b、4b和8b降低,其余明显升高,其中处理9b最明显。葡孢霉属除了处理1b、2b、3b、4b和7b降低,其余显著升高,并且随半焦肥增加,丰度降低幅度减小。

表4 不同施肥处理下土壤属水平真菌群落相对丰度
如表5所示,假单胞菌属(Pseudomonas)在处理3b所占比例最大,为60.92%;67-14在处理b所占比例最大,为6.20%;索利红杆菌属(Solirubrobacter)在处理3a所占比例最大,为4.31%;Subgroup_6在处理2a中所占比例最大,为3.63%;红色杆菌属(Rubrobacter)在处理b中所占比例最大,为4.05%。与对照土样相比,所有施肥处理后均使0~10 cm土壤中的假单胞菌属和红色杆菌属丰度显著降低,而67-14、索利红杆菌属和Subgroup—6略微增加但并不显著。与对照土样相比,所有施肥处理后均使10~20 cm土壤中的假单胞菌属丰度显著升高,红色杆菌属丰度明显降低,67-14、索利红杆菌属和Subgroup_6的丰度变化并不显著。

表5 不同施肥下土壤属水平细菌群落相对丰度
2.4 不同施肥处理土壤微生物群落的相似性
微生物物种丰度热图可以反映样品之间的物种组成和差异,也可以对物种进行聚类分析。由细菌属水平上的物种丰度热图(图4)可知,处理1a、1b、2b和3a在物种组成上较为相似;处理3b、8b和a在物种组成上较为相似。处理a与2a、2b和3a物种组成上具有较大的差异,处理a的假单胞菌属(Pseudomonas)、土微茵属(Pedomicrobium)、红色杆菌属(Rubrobacter)及游动微菌属(Planomicrobium)组成比例较大,而1、2、4和11处理的0~10 cm土层则较小。
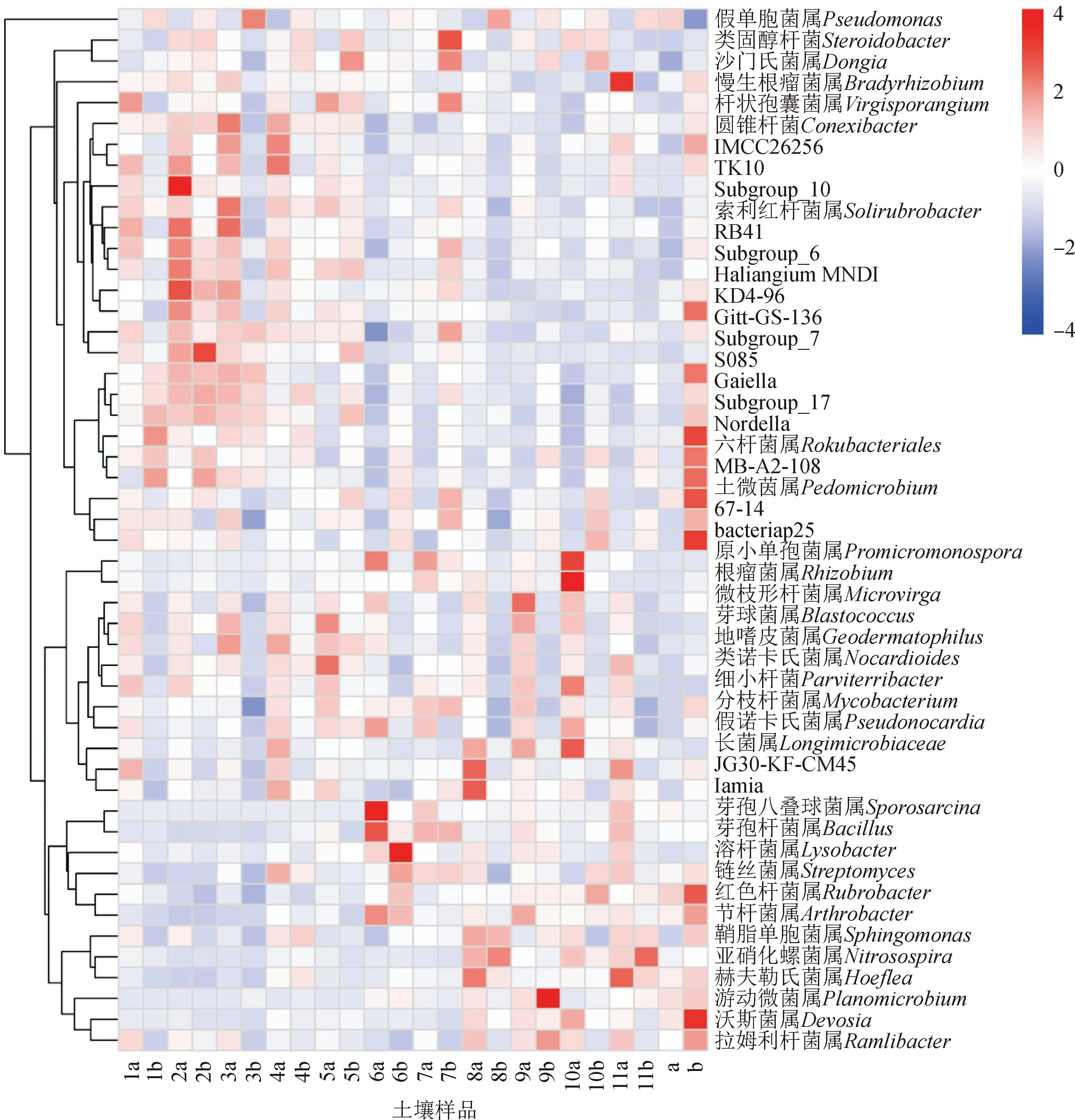
图4 不同施肥处理下土壤细菌群落属水平上的物种丰度热图
如图5所示,土壤真菌在属水平上的热图分析表明,1号与和6号的不同土层之间物种组成差异较大,2处理与12处理(CK)的不同土层之间物种组成差异较小,处理1a和2a在真菌群落组成上较为相似。不同施肥处理的样品在不同深度的土层中优势真菌属存在较为明显的差异,聚类比较分散,说明真菌的群落组成在属水平上与土层相关性较小。

图5 不同施肥处理土壤真菌群落属水平上的物种丰度热图
2.5 不同施肥处理土壤微生物物种差异特征
图6所示,在土壤细菌PCA分析结果中,各样品之间分离均不明显,各处理间的土壤细菌群落结构差异较小。其中:处理a和3a,2b、4b、9b和10b距离最近;处理6a与对照样品a距离较远,分离明显;6处理0~10 cm土壤中细菌群落结构存在明显差异。土壤真菌PCA分析中,样品间分离明显,且与对照处理a和b也存在明显差异。其中:处理10a与对照样品差异最明显;10处理下土壤真菌群落结构差异明显;处理2a与2b,处理11a与11b的距离最近,差异不明显;处理2和11处理对土壤真菌群落结构影响较小。
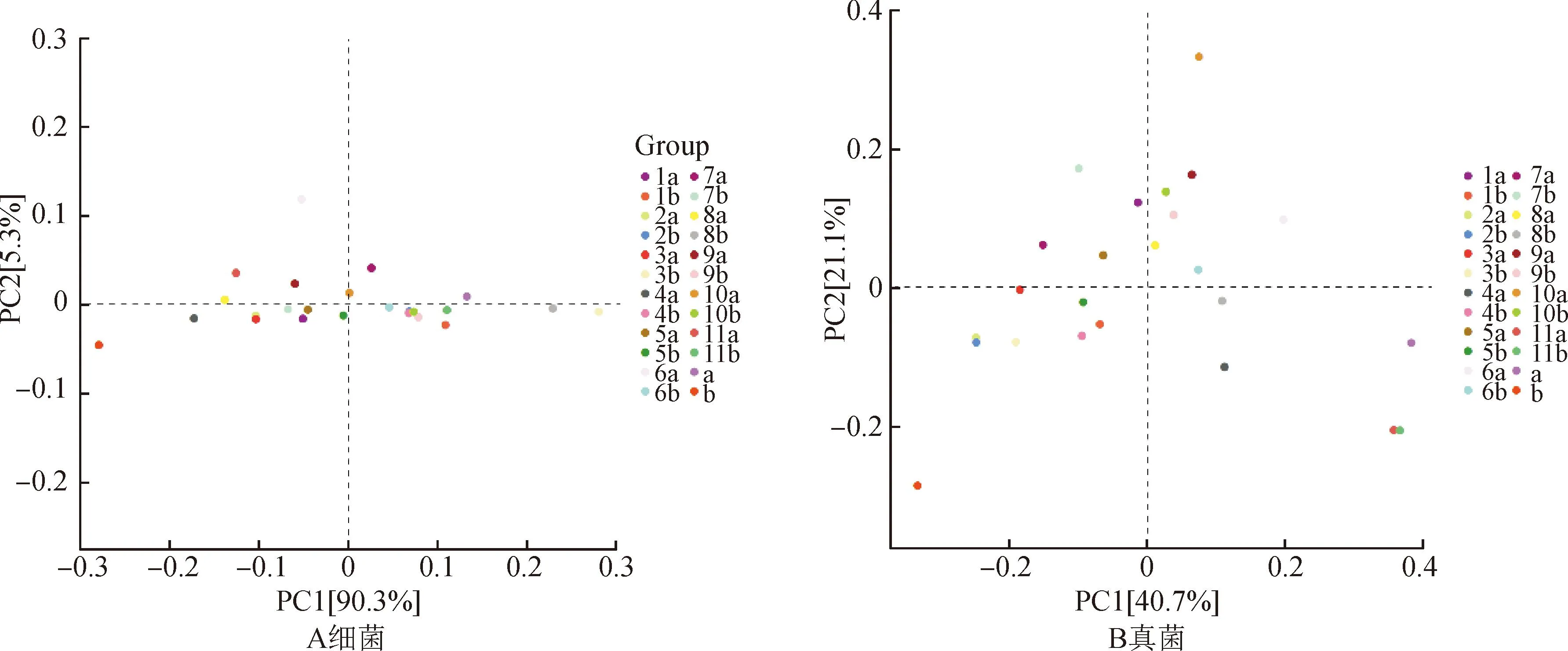
图6 不同处理下土壤微生物群落结构PCA分析
3 讨论与结论
3.1 讨论
本研究结果显示,不同土层中的微生物群落结构及物种多样性方面存在差异。0~10 cm土层微生物多样性指数显著高于10~20 cm土层,此结果与赵彬阳等[15]在研究枯落物输入变化条件下云南松(Pinusyunnanensis)林地土壤特征研究中的微生物数量结果相似。而细菌种类远大于真菌,只是不同微生物种类的丰度变化有所差异,曾维军等[16]在探究菌塘土壤营养变化与其微生物多样性变化时也得出相似的结果。这可能是由于土壤表层部分的物质难以渗入深层土壤,使得土壤表层养分充足,同时有机质的输入能够激发土壤细菌的分解能力,从而促进了其大量生长和繁殖[17]。本研究结果表明,施肥处理后的土壤微生物数量相比不施肥处理都有所增加。这主要是由于施用的肥料中含有的有机物质能使微生物更容易获得养分,从而为土壤微生物提供额外的代谢营养元素[18]。
混合施肥能全面供给作物生长所需养分,改良作物对养分的吸收条件从而提高肥效,增强土壤的可持续利用。马肖[19]发现使用缓释肥与化肥混施的方式能影响土壤菌群中与植物养分吸收有关的菌群来促进植物养分吸收。包明琢等[20]发现在磷肥中加生物炭能够有效改善杉木[Cunninghamialanceolata(Lamb.) Hook.]林分的土壤养分,总体上能够丰富土壤微生物种类。在本试验结果中,混施方案的微生物数量明显优于单施方案,并且能够改善种植地0~10 cm土层土壤细菌群落多样性和10~20 cm土层真菌群落多样性,其中在4号(6 kg半焦肥+8颗力浮丸)方案中体现出最明显的优势,该结果与前人研究结果基本相似。因此,今后在油橄榄生产栽培中可考虑以该方案作为复合缓释肥的开发与推广应用对象,以达到改善土壤性质、增加产量的目的,使其发挥最大效用。同时,该施肥方案会促进镰刀菌属真菌的大量生长,因此在推广该施肥方案时,也需要采取预防和防治苗木产生根腐病害的措施,具体可参考庞跃刚等[21]的防治方法。
土壤中的放线菌可以大量分解土壤中的植物有机残体,还能改善土壤的团粒结构,是生产抗生素和生长调节剂等最实用的资源,已成为植物病害防治、生长环境改善及维持土壤资源持续发展的重要措施之一[22]。有研究发现,土壤中的放线菌对水稻(OryzasativaL.)[23]、番茄(SolanumlycopersicumL.)[24]和金银花(LonicerajaponicaThunb.)[25]等多种植物具有良好的防病与促生作用。本研究经施肥处理后0~10 cm土层土壤中的放线菌丰度显著增加,放线菌丰度增加的原因可能是:一方面,由于在自然条件下,一部分微生物通过产生代谢产物供其他细菌使用,促进土壤中的元素释放,形成化学循环,同时产生放线菌[26];另一方面,由于气温较高,放线菌会形成特殊的代谢机制并产生独特的次生代谢物,这些次生代谢物中含有的有机酸和氨基酸等小分子化合物能够供给放线菌适应环境以维持自身的物种多样性[27]。
镰刀菌属在自然界中分布广泛,作为植株根腐枯萎病主要病原菌,在作物致病源头中扮演重要角色。因其所致病害在如豇豆[Vignaunguiculata(L.) Walp.][28]和花魔芋(AmorphophalluskonjacK.Koch)[29]等农作物以及牛膝(AchyranthesbidentataBlume.)[30]和藏红花(CrocussativusL.)[31]等中药材及其他120多种植物中都有发生。在本试验中,镰刀菌属除了在处理5b、6a、11a丰度略微降低,其余土样均能促进生长,尤以其在处理10a中所占比例最大。这说明其在10号方案(7 kg半焦肥)表层土壤中生长最活跃,因此10号方案(7 kg半焦肥)对作物存在很大的病害隐患,不建议在实际生产中应用。
3.2 结论
缓释肥处理下的油橄榄种植地0~10 cm和10~20 cm土层的土壤微生物多样性较为丰富。6个优势细菌门相互之间表现出的差异不明显,3个优势真菌门表现出在施用缓释肥后会引起不同菌门丰度变化。所有施肥处理均表现为能够促进土壤中0~20 cm土层的真菌和0~10 cm土层的细菌生长,而抑制10~20 cm土层细菌生长。半焦肥+力浮丸组合施用较单独施用可明显提高细菌和真菌多样性。细菌和真菌的群落优势属随施肥的种类和水平变化表现出明显差异,6 kg半焦肥+8颗力浮丸处理在提高油橄榄土壤微生物多样性方面表现最佳。
