共培养条件下肌卫星细胞C2C12对软骨细胞ATDC5活性的影响
2024-04-02陈泽华王毅申震李俊毅欧梁
陈泽华,王毅,申震,李俊毅,欧梁
(1.株洲市中医伤科医院,湖南 株洲 412007;2.广州中医药大学第五临床医学院,广东 广州 510095;3.昆明市中医医院,云南 昆明 650599;4.湖南省中医药研究院,湖南 长沙 410006)
肌卫星细胞是出生后肌肉组织中唯一一类具有分裂能力的肌肉源性干细胞,可通过激活、增殖和分化,参与肌肉再生、重塑和损伤修复[1]。肌卫星细胞在正常情况下保持静止状态,当骨骼肌受到损伤时,肌卫星细胞被激活并增殖,同时表达成肌调节因子,加速其成肌分化,形成新的肌细胞[2]。肌卫星细胞的数量和功能是维持成人骨骼肌质量和功能的关键。肌卫星细胞数量减少和增殖、分化的可塑性下降是导致骨骼肌萎缩的重要原因,同时肌卫星细胞数量减少也被认为是老年人骨骼肌衰减的重要原因[3-4]。研究表明,骨骼肌萎缩(包括肌纤维变细和纤维数量减少)与膝骨关节炎(knee osteoarthritis,KOA)的发生关系密切[5-7]。与健康人群相比,KOA患者股四头肌中肌卫星细胞密度下降,肌纤维类型改变[8]。肌卫星细胞数量减少会阻碍骨骼肌的再生和修复,进一步加重骨骼肌萎缩。然而,骨骼肌萎缩状态下肌卫星细胞增殖活力减弱,是否会影响软骨细胞的活性,目前还不得而知。为此,本研究观察了共培养条件下肌卫星细胞对软骨细胞活性的影响,以期为探索肌肉萎缩与KOA之间的关系,以及通过改善肌肉萎缩治疗KOA提供依据。
1 材料和仪器
C2C12小鼠成肌细胞、ATDC5小鼠成软骨细胞系(上海中乔新舟生物科技有限公司),胎牛血清、青霉素-链霉素双抗溶液(Gibco公司),DMEM高糖培养基(Hyclone公司),孔径8 μm和0.4 μm 的24孔Transwell小室(Corning公司),CCK8试剂(Biosharp公司),地塞米松磷酸钠注射液(天津金耀药业有限公司),BCA蛋白定量试剂盒(Thermo Fisher Scientific公司),二氯二氢荧光素-乙酰乙酸酯(2′,7′-dichlorofluorescin diacetate,DCFH-DA)活性氧荧光探针(北京索莱宝科技有限公司),Varioskan多功能酶标仪(Thermo Fisher Scientific公司),DMi8荧光显微镜(Leica公司)。
2 方 法
2.1 细胞传代培养
C2C12细胞和ATDC5细胞均采用常规培养基(4 mL胎牛血清+400 μL青霉素-链霉素双抗溶液+35.6 mLDMEM高糖培养基)在37 ℃、CO2体积分数5%的恒温细胞培养箱中培养,隔天换液1次,当细胞融合度达到90%时按1∶3传代。取第3代细胞进行后续实验。
2.2 地塞米松对C2C12细胞活性影响的观察
2.2.1地塞米松对C2C12细胞增殖的影响 取C2C12细胞,按照每孔5×103个接种至96孔板中,分为对照组和地塞米松组,每组设5个复孔,采用常规培养基培养(条件、方法同2.1)。待细胞融合度达到50%~60%时,对照组继续以常规培养基培养,地塞米松组改用地塞米松培养基培养(50 μL地塞米松磷酸钠注射液+48 mL常规培养基)。继续培养24 h后,2组均改用检测培养基培养(每孔90 μL常规培养基、10 μL CCK8试剂),设置空白孔,继续培养1 h后采用酶标仪测定OD值(波长为460 nm)。细胞增殖率=(地塞米松组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)×100%。
2.2.2地塞米松对C2C12细胞蛋白合成的影响 取C2C12细胞,按照每孔5×103个接种至6孔板中,分为对照组和地塞米松组,每组设3个复孔,采用常规培养基培养(条件、方法同2.1)。待融合度达到90%时,对照组继续以常规培养基培养,地塞米松组改用地塞米松培养基培养。继续培养24 h后,吸弃培养基,用PBS漂洗1遍,加入100 μL裂解液(RIPA∶PMSF=100∶1),于冰上裂解5 min,刮下细胞转移至1.5 mL EP管中,以12 000 r·min-1离心10 min(离心半径 6 cm)。吸取上清液,稀释6倍,按照BCA试剂盒操作步骤,在酶标仪中测定OD值(波长562 nm)。根据标准品浓度计算公式计算样品的测定浓度,测定浓度的6倍即为原液的蛋白含量。
2.2.3地塞米松对C2C12细胞修复能力的影响 取C2C12细胞,按照每孔1×105个接种至24孔板中,分为对照组和地塞米松组,每组设3个复孔,采用常规培养基培养(条件、方法同2.1)。待融合度达到90%时,用200 μL移液枪垂直划一条直线,用PBS漂洗2次,去除划下的细胞。对照组继续以常规培养基培养,地塞米松组改用地塞米松培养基培养。24 h后拍照观察,采用Image J软件测量划痕面积,计算细胞伤口修复率,修复率=(初始面积-24 h面积)/初始面积×100%。
2.2.4地塞米松对C2C12细胞迁移能力的影响 将孔径为8 μm的Transwell小室置于24孔板中,采用不含胎牛血清的DMEM高糖培养基将C2C12细胞重悬,调整密度,接种至上层小室内(200 μL,约1×105个),分为对照组和地塞米松组,每组设5个复孔。对照组下层小室内加入600 μL常规培养基,地塞米松组下层小室内加入600 μL地塞米松培养基。分别于24 h和48 h后,吸弃下层小室的培养基,用4%多聚甲醛室温固定15 min,PBS漂洗3遍,0.1%的结晶紫室温染色10 min,再用PBS漂洗3遍,镜下每孔随机选取5个视野拍照,计算每个视野内的细胞数量。
2.3 与C2C12细胞共培养对ATDC5细胞活性影响的观察
2.3.1与C2C12细胞共培养对ATDC5细胞增殖的影响 采用孔径为0.4 μm的Transwell小室对C2C12细胞和ATDC5细胞进行共培养。分3组,每组设3个复孔。共培养组和预处理组上层小室内接种C2C12细胞(200 μL,约1×105个),分别以常规培养基和地塞米松培养基培养,培养24 h后弃去培养基,用PBS漂洗2次,然后将Transwell小室转移至接种ATDC5细胞(600 μL,约2×105个)的培养孔中;对照组上层小室内为无细胞的常规培养基。上下层小室内细胞均以常规培养基继续培养24 h后,采用CCK8法检测各组下层小室内ATDC5细胞增殖率,方法同2.2.1。
2.3.2与C2C12细胞共培养对ATDC5细胞内活性氧含量的影响 细胞分组、培养方法同2.3.1。共培养24 h后,吸弃下层小室内的培养基,每孔加入400 μL现配制的DCFH-DA试剂(用PBS稀释1000倍),避光培养30 min后置于荧光显微镜下观察拍照,用 Image J软件分析比较各组的荧光强度。
2.4 数据统计
采用SPSS25.0软件进行数据统计分析。地塞米松组和对照组C2C12细胞增殖率、蛋白含量、伤口修复率、细胞迁移数量的组间比较均采用独立样本t检验;对照组、共培养组、预处理组ATDC5细胞增殖率、细胞内活性氧含量的总体比较均采用单因素方差分析,组间两两比较均采用LSD-t检验。检验水准α=0.05。
3 结 果
3.1 地塞米松干预后C2C12细胞增殖率和蛋白含量测定结果
地塞米松组C2C12细胞增殖率和蛋白含量均低于对照组[(78.402±5.401)%,(100.000±3.096)%,t=8.498,P=0.000;(5 080.367±296.657)μg·mL-1,(5 775.577±150.476)μg·mL-1,t=3.620,P=0.022]。
3.2 地塞米松干预后C2C12细胞伤口修复率测定结果
与对照组相比,地塞米松组C2C12细胞的修复能力下降(图1)。地塞米松组C2C12细胞的24 h伤口修复率低于对照组[(53.173±1.800)%,(79.979±10.176)%,t=4.493,P=0.011]。

图1 2组C2C12细胞24 h修复结果
3.3 地塞米松干预后C2C12细胞迁移数量测定结果
培养24 h和48 h时,地塞米松组C2C12细胞迁移数量均少于对照组[24 h:(24.200±5.630)个,(57.000±2.449)个,t=11.945,P=0.000;48 h:(57.600±8.820)个,(91.000±4.743)个,t=7.457,P=0.000]。见图2。
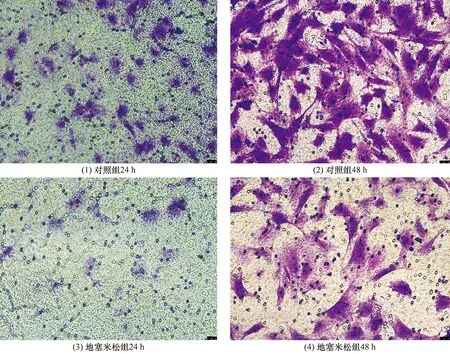
图2 2组C2C12细胞24 h和48 h迁移结果(结晶紫染色 ×400)
3.4 与C2C12细胞共培养条件下ATDC5细胞增殖率测定结果
3组ATDC5细胞增殖率比较,差异有统计学意义。对照组和共培养组ATDC5细胞增殖率均高于预处理组(P=0.037,P=0.006),共培养组ATDC5细胞增殖率高于对照组(P=0.001)。见表1。
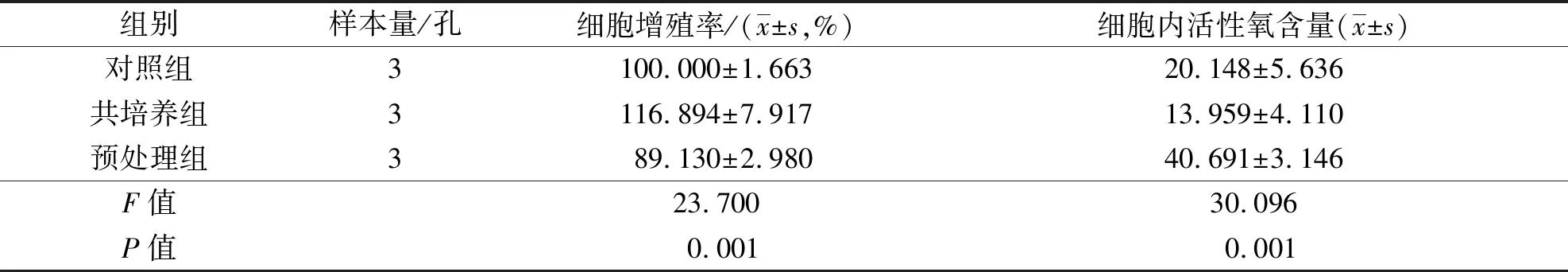
表1 与C2C12细胞共培养条件下ATDC5细胞增殖率和细胞内活性氧含量
3.5 与C2C12细胞共培养条件下ATDC5细胞内活性氧含量测定结果
3组ATDC5细胞内活性氧含量比较,差异有统计学意义。预处理组ATDC5细胞内活性氧含量高于对照组和共培养组(P=0.001,P=0.000),对照组和共培养组ATDC5细胞内活性氧含量的差异无统计学意义(P=0.137)。见图3、表1。

图3 3组与C2C12细胞共培养的ATDC5细胞二氯二氢荧光素-乙酰乙酸酯活性氧荧光染色结果(×200)
4 讨 论
肌卫星细胞的激活、增殖、分化对维持出生后骨骼肌结构与功能起着至关重要的作用。当肌卫星细胞数量减少时,骨骼肌的再生和修复能力下降,其生成和降解平衡遭到破坏,从而导致骨骼肌萎缩。骨骼肌中的肌动蛋白在分子水平上与软骨及骨相互作用,与KOA的发病密切相关[9]。由此可见,“肌肉-软骨”在细胞分子水平的交互作用可能是影响KOA发生、发展的重要原因。
本研究发现,地塞米松可抑制肌卫星细胞增殖和蛋白合成,并能抑制肌卫星细胞的修复和迁移。可见,采用地塞米松对肌卫星细胞进行干预,可体外模拟肌萎缩条件下肌卫星细胞的生长状态。地塞米松抑制肌卫星细胞增殖,也可能是其引起骨骼肌萎缩的重要原因。糖皮质激素对分解代谢有促进作用,可通过减少蛋白质合成和增加蛋白质降解,使肌纤维尺寸缩小、Ⅱ型纤维选择性萎缩,诱导骨骼肌萎缩,并能引起骨骼肌内脂肪堆积,降低肌肉质量,促进肌少症的发生[10]。地塞米松诱导的肌少症与增龄性肌少症都有肌肉量减少,肌力降低,肌纤维蛋白合成减少、分解加快,肌纤维再生能力消失等特点,二者在病理特点上具有较高的相似性,因此地塞米松常被用于肌少症动物模型的构建[11]。同时,采用地塞米松对体外培养且分化成熟的成肌细胞进行干预,可使肌管横径减小,形成肌肉萎缩,这一方法被用于肌肉萎缩的体外细胞建模[12-13]。然而,也有研究发现,地塞米松可促进肌卫星细胞分化,增加肌管的横径和面积[14]。这可能与该研究中使用的地塞米松浓度较低(5~25 nmol·L-1)及干预时间点(肌卫星细胞分化前)不同有关。这说明地塞米松对肌卫星细胞活性的调节作用对药物浓度和干预时间点具有依赖性。
为进一步研究“肌肉-软骨”在细胞水平的相互作用对KOA的影响,本研究构建了肌卫星细胞-软骨细胞共培养体系。研究结果发现,正常状态下,肌卫星细胞与软骨细胞间接共培养时,可促进软骨细胞增殖,这可能与肌卫星细胞产生的代谢产物能影响软骨细胞活性有关。国外研究表明,与肌细胞或肌细胞条件培养基共同培养的软骨细胞对白细胞介素-1β和肿瘤坏死因子α诱导的软骨损伤的抵抗作用增强,且肌细胞释放的细胞因子和生长因子可促进软骨细胞生成胰岛素样生长因子1,调节软骨发育[15];在肌细胞条件培养基中培养,能减轻炎症诱导对人骨髓间充质干细胞来源的软骨细胞的损伤[16]。此外,肌细胞和软骨细胞共培养条件下,Ⅱ型和Ⅸ型胶原的表达也明显增强[17]。可见,正常状态下,肌肉组织中的肌细胞和肌卫星细胞均可对软骨细胞有正向调节作用。同时,本研究还发现,与正常肌细胞共培养的软骨细胞中的活性氧含量明显下降。这可能与肌卫星细胞可增强软骨细胞对损伤的防御作用及减轻软骨损害有关。当活力降低的肌卫星细胞与软骨细胞共培养时,会明显抑制软骨细胞增殖,同时会明显提高软骨细胞中活性氧的水平,增加软骨细胞氧化性损伤。可见,骨骼肌萎缩状态下肌卫星细胞活性降低,可通过“肌肉-软骨”之间的细胞耦合作用加速软骨退变,抑制软骨细胞增殖,并加重其氧化性损伤,从而导致KOA的发生和发展。有研究发现,血管中骨骼肌中免疫细胞释放的细胞因子能减轻关节软骨损伤[18]。由此可见,肌肉组织中细胞产生的生物化学物质可随血液流动至关节。通过调节肌肉萎缩可影响关节软骨的合成与代谢,进而影响KOA的发病及病理进程。从本研究的结果来看,“肌肉-软骨”之间可能存在细胞水平的耦合作用,正常状态下肌细胞对软骨细胞具有促增殖作用,维持肌肉的健康状态对关节软骨有保护作用;当肌肉发生萎缩时,肌卫星细胞活性下降,会降低软骨细胞活力,加重软骨细胞损伤。因此,防治骨骼肌萎缩对保护关节软骨至关重要。
本研究的结果提示,地塞米松可抑制肌卫星细胞C2C12增殖,应用地塞米松干预肌卫星细胞C2C12可体外模拟肌肉萎缩条件下肌卫星细胞的生长状态。正常状态下,肌卫星细胞C2C12的代谢产物可促进软骨细胞ATDC5增殖;肌卫星细胞C2C12活力降低,可抑制软骨细胞ATDC5增殖,同时会增加软骨细胞ATDC5氧化性损伤。
