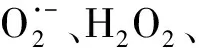污水深度处理中常见固相臭氧催化剂及其催化机理综述
2024-03-22李旭芳沈鹏飞马鲁铭
李旭芳,沈鹏飞,*,马鲁铭
(1.中国铁工投资建设集团有限公司,北京 101300;2.中国中铁生态环境专业研发中心,上海 200331;3.同济大学环境科学与工程学院,上海 200092)
在臭氧(O3)氧化工艺中,催化剂的使用可促进反应过程中·OH的产生,从而克服单独O3氧化的选择性,提高污水深度处理的效果。固相催化剂具有固液分离效果好、二次污染少、可循环使用等优点,在实际应用中有较好的适用性,因此得到学界和工业界的重点关注。固相催化剂的催化效果很大程度上取决于催化剂的种类、催化剂表面活性位点及液相组成与催化剂之间的相互作用。因此,不同催化剂的催化机理存在较大差异,需要分别讨论。
主要的固相催化剂包括金属及金属氧化物、金属及其氧化物的负载和碳基材料及其负载型催化剂[1]。本文仅考虑催化剂有效成分的催化机理,有关金属氧化物负载于其他材料或金属氧化物作为载体负载其他有效成分的催化剂,暂不在本文的重点讨论范围内。因此,本文着重于总结分析金属及其氧化物、碳基材料的催化O3氧化效果及其催化机理。根据目前理论研究进展、材料的易得性及可预见的应用前景,本文重点关注的金属及其氧化物是铁(Fe)、锰(Mn)、铈(Ce)、镍(Ni)、钴(Co)、钛(Ti)及其氧化物,碳基材料是活性炭、碳纳米管和石墨烯。
1 金属氧化物
1.1 铁氧化物
Fe及其氧化物在自然界中丰度较大、易于合成、活性较强且几乎无毒无害,在水处理中应用广泛。Fe及Fe的氧化物包括零价铁(Fe0)、Fe2O3、Fe3O4、FeOOH等,因其具有活泼的化学特性及丰富的反应活性位点,均可以表现出较好的O3催化效果[2]。研究[3]表明,Fe0与O3的耦合工艺能够获得协同效果,在废水处理过程中能够取得更高的TOC、CODCr去除率,同时提高废水的可生化性,同步去除浑浊度、色度等;Wu等[4]将铁刨花应用于印染废水的深度处理,发现在催化O3氧化过程结束后,100%的蛋白质和42%的多糖被降解,废水可生化性大幅提高、生物毒性降低,表明该工艺既能够作为废水处理的最终步骤以满足CODCr的排放需求,又能够为进一步生化处理提供有利条件。
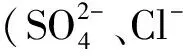
相比之下,Fe2O3和Fe3O4的催化效果较弱。Trapido等[11]对比研究了多种过渡金属氧化物催化O3氧化间二硝基苯的效果,发现Fe2O3能够显著提高间二硝基苯的降解速率,但提高CODCr去除率的能力较其他金属氧化物(Ni2O3等)不明显。Zhu等[2]合成介孔Fe3O4用于催化O3氧化阿特拉津,反应10 min后阿特拉津去除率由单独O3的9%提高至82%;但TOC去除率较低,不足20%。因此,Fe2O3和Fe3O4仅能加速某类物质的降解,而不能实现有机物矿化。
Fe的不同价态及其组成会形成不同的晶体结构,物理化学性质差异较大。如FeO非常不稳定,极易被氧化为Fe2O3或Fe3O4;Fe3O4有极强的磁性,从而提供了额外的回收和固液分离方法;Fe2O3表面有丰富的酸性位点;FeOOH的表面羟基基团密度更大。同时,Fe0是高效还原剂,极易被氧化为Fe(Ⅱ)、Fe(Ⅲ)、Fe(Ⅳ)等多种价态,在价态变化的过程中可实现高效的电子转移,从而可能成为促进O3分解的催化剂。Fe及其氧化物由于自身性质多样、目标污染物差异及试验条件的改变而有不同的催化机制,目前尚未有统一的定论,但各种论点均有两个共同点:一是提高O3传质效率,二是促进·OH的产生。催化过程主要涉及4个方面[12]。
其一是Fe(Ⅱ)/Fe(Ⅲ)的均相催化作用,如式(1)~式(6)。
(1)
(2)
Fe3++O3+H2O→FeO2++·OH+O2+H+
(3)

(4)
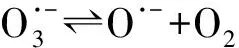
(5)
O·-+H2O·OH+OH-
(6)

其三可能是芬顿反应的贡献,如式(7)和式(8)[15]。
Fe+O2+2H+→Fe2++H2O2
(7)
Fe2++H2O2→Fe3++·OH+OH-
(8)
其四是反应过程中的混凝沉淀作用。铁氧化物溶出的Fe2+/Fe3+在水环境中生成Fe(OH)2或Fe(OH)3絮体,可作为混凝剂,通过混凝沉淀作用去除有机物。
1.2 锰氧化物
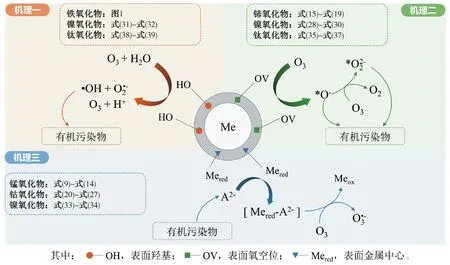
作为O3催化剂的锰氧化物主要包括MnO2和Mn3O4。MnO2是气相O3分解最有效的固相催化剂,因此,锰氧化物在水环境中催化O3的效果也引起了广泛关注。但是不同的研究,结果差异较大。Faria等[16]将合成Mn3O4作为催化剂,其催化O3氧化苯胺和磺胺酸的效果都很显著,TOC去除率相对单独O3分别增加了35%和10%,两者的最终降解产物中均有草酸等小分子酸。Ma等[17]证明,只需极小剂量的Mn(Ⅱ)即可与O3原位生成MnO2以发挥催化作用,显著提高阿特拉津去除率;通过高锰酸氧化Mn(Ⅱ)预先合成的MnO2亦有相似的催化效果;但商用MnO2没有任何催化作用。Trapido等[11]考察了多种过渡金属离子及其氧化物对间二硝基苯的催化O3氧化效果,结果表明,在O3进气质量浓度为12 mg/L时,各种氧化物催化效果排序如下:单独O3≈MnO2≈Cr2O3 在MnO2催化O3过程中,pH和有机物种类是主要的影响因素。Tong等[18]研究了β-MnO2和γ-MnO2的催化效果,发现pH值= 1时磺基水杨酸的TOC去除率相对单独O3均提高了25%,而在pH值=6.8时几乎无催化作用;磺基水杨酸被O3直接氧化可生成草酸,催化O3可有效降解草酸,而单独O3氧化时草酸浓度不断积累;但当有机物为丙酸时,MnO2在任何pH条件下均无催化作用。此外,MnO2的催化作用与其结构性质有一定关系,Nawaz等[19]利用介孔α-MnO2催化O3氧化4-氯酚,TOC去除率相比商用α-MnO2提高了15%;Dong[20]等合成的β-MnO2有较大的比表面积和结构优势,在不吸附有机物的条件下亦可大幅提高苯酚的CODCr去除率。 (9) (10) Mn(Ⅱ)+Mn(Ⅳ)→2Mn(Ⅲ) (11) Mn(Ⅱ)+O3+2H+→Mn(Ⅳ)+O2+H2O (12) 在弱酸性条件下(pH值为4~6),草酸与Mn(Ⅲ)形成双分子或三分子复合物,但该复合物的反应活性远低于单分子复合物;MnO2的加入仅可活化草酸分子,生成更易被氧化的AO-[式(13)];此时O3参与草酸的氧化,且可能生成·OH[式(14)]。 (13) (14) 综上,MnO2在水环境中催化O3氧化有机物时,有机物的降解或自由基的产生均以形成表面复合物为前提。以上机理可较完整地解释MnO2催化O3氧化对有机物的选择性,即是否能与Mn(Ⅲ)生成表面复合物。 作为O3催化剂的铈氧化物主要是CeO2。CeO2是立方萤石结构氧化物,即一个铈原子周围环绕8个氧原子,是最重要的稀土元素氧化物。CeO2中的铈原子有多个价态[Ce(Ⅲ)/Ce(Ⅳ)],在Ce被还原时可形成氧空位来存储和释放氧,常用来作为催化剂、助催化剂及催化剂载体。研究表明,铈氧化物在O3氧化过程中具有较好的催化性能。Orge等[22]研究了CeO2及铈基混合氧化物催化O3氧化羧酸及芳香环类污染物(草酸、苯胺及染料等)的效果,TOC去除率均提高了至少50%,表明CeO2催化O3氧化对有机物种类无选择性。Mena等[23]发现CeO2的催化效果与其形貌及结构特征有较大关系,纳米棒状材料具有更大的比表面积,导致具有更多的表面晶格缺陷和氧空位,催化O3效果更好。Esmalipour等[24]用紫外光预处理CeO2以促进表面氧空位的生成,发现预处理之后的催化剂对水杨酸的催化O3氧化效果提高了3倍,再次证实氧空位的重要性。除此之外,污染物去除效果还与表面Ce(Ⅲ)的百分比有关。一般来讲,Ce(Ⅲ)比Ce(Ⅳ)更稳定,但在CeO2中Ce(Ⅳ)占主导位置;催化反应发生时,Ce(Ⅲ)首先被氧化为较不稳定的Ce(Ⅳ),再被有机物或其他部分的电子还原为Ce(Ⅲ)[25]。Orge等[26]用不同方法合成纳米结构CeO2,发现随着材料表面Ce(Ⅲ)百分比增加,其催化O3矿化草酸的程度越高,催化效果越好。 表面氧空位和氧化还原电对[Ce(Ⅲ)/Ce(Ⅳ)]是CeO2催化O3的主要活性位点[29]。CeO2催化O3的过程可能主要包括4个步骤[24]:一是O3分子吸附于表面氧空位并分解为表面原子氧[式(15)],可氧化吸附于催化剂表面的污染物,同时可被O3继续氧化为表面过氧[式(16)];二是Ce(Ⅲ)作为Lewis酸性位点吸附H2O形成表面羟基,O3通过静电力/氢键与表面羟基基团结合并分解为HO2·、HO3·、·OH等自由基,同时Ce(Ⅲ)被氧化为Ce(Ⅳ)[式(17)];三是为了维持表面电荷平衡,Ce(Ⅳ)被表面晶格氧重新还原为Ce(Ⅲ),氧空位重新产生,增加催化剂表面吸附氧的能力[式(18)];最后,O3接受电子被还原为晶格氧,补偿催化剂表面的氧缺陷[式(19)]。在这一过程中,Ce(Ⅲ)向O3的电子转移导致活性氧物种的产生,表面晶格氧参与完成Ce(Ⅲ)/Ce(Ⅳ)的循环,因此,Ce(Ⅲ)/Ce(Ⅳ)和O2-/O2的氧化还原对及表面静电平衡是提高CeO2催化活性的主要因素。 CeO2+O3→CeO2-O+O2 (15) CeO2-O+O3→CeO2-O2+O2 (16) 2Ce(Ⅲ)-OH+O3→2Ce(Ⅳ)+O2-+2·OH+O2 (17) 4Ce(Ⅳ)+2O2-→4Ce(Ⅲ)+O2 (18) O3+2e-→O2-+O2 (19) 作为O3催化剂的钴氧化物主要包括CoO、Co3O4等。钴氧化物是P型半导体,可将O2吸附在高价金属上生成表面原子氧,在气相O3分解过程中有显著催化作用。Dong等[30]合成Co3O4纳米颗粒用于催化O3氧化苯酚,其催化效果与颗粒粒径有关,粒径越小,比表面积越大、分散性越好、催化效果越好,CODCr去除率由单独O3的36.2%增加至53.3%。Xu等[31]发现合成β-Co(OH)2可大幅促进O3衰减和对氯硝基苯的降解,但随着循环使用次数的增加,催化效果明显降低。钴氧化物对O3氧化有一定的催化效果,但在加入叔丁醇(TBA)作为·OH抑制剂后,草酸去除率和O3衰减速率均未降低,表明·OH作为主要氧化物种的可能性不大。但是,亦有学者指出钴氧化物的催化效果不明显。Gruttadauria等[32]研究了不同结构、形貌和还原特性的钴催化剂(Co3O4、CoO、CoOx-CeO2),发现其催化效果与表面分散Co(Ⅱ)十分相关,但三者的催化效果都不理想,有较多金属溶出的状态下才有一定的催化能力。 (20) (21) (22) (23) Co(Ⅲ)+O3→Co(Ⅲ)-O3 (24) 2Co(Ⅲ)-O3+Co(Ⅱ)(C2O4)→Co3O4+2CO2+O2 (25) Co(Ⅱ)+O3+H2O→Co(Ⅲ)-OH+·OH+O2 (26) (27) NiO+O3→NiO-O3→NiO-O+O2 (28) NiO-O+H2O→NiO+2·OH (29) (30) NiO+H2O→NiO-OH2 (31) NiO-OH2+O3→NiO+HO3·+HO· (32) (33) NiO+-C=C-/-COOH/-C=O→ NiO-C=C-/-COOH/-C=O (34) 作为O3催化剂的钛氧化物主要是TiO2。TiO2广泛应用于光催化、光伏电池、气体传感器、光敏材料及生物材料等,由于其相对廉价易得且毒性较小,在水溶液中催化O3的应用也得到了广泛研究。Molnar等[38]将TiO2应用于催化O3氧化饮用水源水中有机质的去除及消毒副产物的产生,表明催化O3条件下TOC去除率可提高约20%,腐植酸类物质可被完全去除。Betrn等[39]系统研究了TiO2存在条件下O3氧化草酸的化学动力学和影响因素,发现表观反应速率常数可提高约3个数量级。Yang等[40]指出TiO2在中性和酸性条件下可显著提高阿特拉津的去除率;由于阿特拉津自身具有疏水性,几乎不会吸附于催化剂表面,证明有机物的氧化作用主要发生在液相主体。Yang等[41]指出TiO2可催化O3氧化硝基苯,同时抑制试验及EPR[5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)]检测均证明纳米TiO2可促进O3氧化体系中·OH的产生,证实了·OH机理的主导地位。 TiO2催化性能与晶相结构有关。TiO2有4种物质形态:板钛矿(正交晶系)、锐钛矿(四方晶系)、金红石(四方晶系)和TiO2-B(单斜晶系)。Song等[42]研究表明,金红石比锐钛矿有更好的催化性能,单位比表面积有机物去除率与TiO2晶体中金红石的比例成正比。金红石表面因桥氧原子缺失形成五度配位Ti,比锐钛矿中四度配位Ti形成的氧空位更稳定;同时,有机物矿化效果与催化剂表面羟基密度正相关,而金红石表面Ti3+位点更多,氧空位更多,表面羟基密度更大,催化性能更好。TiO2催化性能与晶面表面能相关。就锐钛矿而言,不同晶面的表面能不同,其催化效果差距很大,(001)晶面的催化效果远高于(101)晶面,因为H2O分子可在(001)晶面解离为表面羟基,而在(101)晶面没有反应活性;然而,(101)晶面热力学稳定性更好,多数锐钛矿均以(101)晶面为主,催化效果较差[43]。 TiO2催化性能主要源于晶格中的氧空位。锐钛矿和金红石晶格中均存在氧空位,O3或H2O分子吸附于氧空位后解离为表面氧原子或·OH,氧化溶液或催化剂表面吸附的有机物[44],其催化机制如下[39,45]。(1)表面氧原子作为氧化物种:首先,O3分子通过一端氧原子与TiO2表面结合,被活化后生成表面氧原子,同时释放出O2[式(35)];同时,TiO2表面吸附有机物分子[式(36)],被表面氧原子氧化,反应在表面发生[式(37)]。(2)·OH作为氧化物种:在酸性和中性条件下,O3在催化剂表面解离生成·OH[式(38)],反应发生在催化剂表面或液相主体;碱性条件下没有活性物种生成,TiO2的催化效果较弱[式(39)]。 O3+TiO2↔O=O-O-TiO2↔O-TiO2+O2 (35) TiO2+[Org]↔TiO2-[Org] (36) TiO2-[Org]+O-TiO2↔TiO2+CO2+H2O (37) O3+TiO2+H2O→O3-TiO2-H2O→TiO2+O2+2·OH (38) O3+TiO2+OH-→O3-TiO2-OH-→ (39) 从上述分析可知,金属及其氧化物催化O3的机理大致可分为3类(图2)。 图2 金属及其氧化物催化O3机理 机理二:以表面吸附活性氧原子作为主要氧化剂,如铈氧化物、钛氧化物等。 机理三:表面金属-有机复合产物生成的非自由基机理,如锰氧化物、钴氧化物等。 对某一金属氧化物,以上3种机理可单独作用,亦可同时出现。机理二和机理三统称为非自由基机理。非自由基机理一般发生在催化剂表面有限区域,且对有机物的氧化有一定的选择性,如金属-有机复合物仅在有络合能力的有机物分子(草酸等)与能形成配位化合物的过渡金属之间产生,表面原子氧仅在氧空位产生且仅氧化被吸附的有机物。机理一为自由基机理,对有机物无选择性,具有更强的普适性,应用前景更广泛。常见金属及其氧化物催化O3机理及主要催化位点总结如表1所示。 表1 污水深度处理中常见金属及其氧化物催化O3氧化机理 近年来,活性炭、碳纳米管及石墨烯等多种碳材料均用于催化O3以氧化去除有机物,且都取得了较好的效果。Snchez-Polo等[46]发现加入500 mg/L活性炭后,O3氧化去除硝基咪唑的TOC去除率提高了30%,副产物的生物毒性大幅削减,且此催化效果不受水质条件干扰,在实际水体(地表水、地下水及废水)中也有很好的效果。Beltrn等[47]研究表明活性炭催化O3氧化草酸几乎可实现完全矿化,并排除了单独O3和活性炭吸附的贡献。Gonçalves等[48]在研究碳材料催化O3氧化磺胺甲恶唑时发现,碳纳米管比活性炭的催化效果更好,在矿化有机物的同时可降解反应副产物,降低中间产物的生物毒性。 活性炭是一系列无序交联的芳香碳层状结构,层间距多变以形成孔隙结构;理想的碳纳米管是纳米尺度的石墨烯柱状结构,柱两端以富勒烯封闭,在尾端及侧壁常出现缺陷。由于结构不同,活性炭的比表面积更大,但以微孔结构为主,介孔比表面积小于碳纳米管[49]。活性炭绝大多数(>90%)的表面积均为内表面,不利于O3传质,而且在强氧化环境下缺乏结构稳定性,O3氧化后会导致比表面积和介孔结构受损。与活性炭不同的是,碳纳米管外部比表面积更大,表面更容易改性以产生利于活性物质生成的官能团结构,且结构稳定性更强,因此,催化O3的效果比活性炭更加显著。 图3 碳材料催化O3氧化机理 石墨烯是一种由碳原子以sp2杂化轨道组成的、呈蜂巢晶格的二维碳纳米材料,每个碳原子都贡献一个位于pz轨道的未成键电子,在与平面垂直方向形成π键,因此具有优异的光学、电学和力学性能。原始的石墨烯催化效果较弱,只有通过杂原子掺杂、负载和表面化学改性等手段改变其化学性质,才可以实现更好的催化效果。例如,石墨烯经氧化后形成氧化石墨烯(GO),结构与石墨烯相同,但表面有丰富的含氧基团(包括环氧基团C-O-C、羟基C-OH、羰基C=O和羧基O-C=O),通过共价键与基面原子(C-O-C和C-OH)或边缘(C=O和O-C=O)相连。通过热或电化学方法将GO还原以生成表面含氧基团较少,但仍包含部分氧和晶格缺陷的还原氧化石墨烯(rGO)。Yin等[59]在GO中掺杂了N原子和P原子,改变了碳的sp2杂化形式,同时产生新的活性位点,提高O3氧化磺胺甲恶唑的速率。 以上研究同时指出,石墨烯及其改性材料的催化效果均随着使用次数的增加而显著下降,且再生手段无法完全恢复其催化能力。O3在衰减过程中产生的自由基可对石墨烯材料的物理性质及表面官能团产生影响,主要表现为D-OH和C=O等富电子碱性基团被氧化为O-C=O。Du等[63]对GO在O3环境下物理结构和化学性质的变化做了较为系统的研究:首先,被O3氧化后,GO表面褶皱更多,侧边尺寸减小并且在片状结构中产生了空洞,即GO的基面石墨结构裂解,边缘缩减;其次,石墨碳结构中的双键只能被·OH氧化形成C-OH,此后·OH和O3可继续通过亲电加成或环偶极加成反应使C-OH被氧化为C=O和O-C=O,造成GO基面芳香环的裂解;此外,在原本存在C-OH结构的碳环中,邻位和对位碳被活化,O3通过偶极环加成反应生成C=O或O-C=O。因此,与O3接触后,石墨烯及其改性材料的形貌结构和表面含氧官能团均发生了较大改变,O/C比例显著升高,C=O和O-C=O增加,催化效果减弱。 表2 污水深度处理中常见碳材料催化O3氧化机理 在各类催化剂的催化效果研究中,多数着眼于难降解及痕量有机微污染物(如抗生素、内分泌干扰物等)的去除。其中,草酸分子结构简单且O3单独氧化效率极低,成为催化O3氧化机制研究中最受欢迎的有机物之一。通过文献简要比较[18,39,43,64-66],在草酸物质的量浓度为2~8 mmol/L,催化剂投加量为1~4 g/L时,MnO2、TiO2、NiO、Co3O4、FeOOH等均表现出较好的催化效果,草酸去除率可由10%~20%(单独O3)提高至60%~90%。但由于催化O3氧化体系中变量因素较多,如有机物浓度、催化剂投加量、O3投加量、反应时间、反应器类型、反应形式(连续流试验/序批式试验)等,尚未能统一衡量各类催化剂的催化效果,并结合经济效益分析等内容,形成统一的效果评价体系。 同时,目前催化剂研究和开发应用于实际工程仍有一定限制,主要存在以下问题。其一,过渡金属及其氧化物是有效的催化剂,但目前多数研究限于粉末型催化剂的开发,包括纳米材料、介孔材料等,以期通过改变结构性质来达到更好的催化效果;但此类材料在实际应用中存在如纳米颗粒团聚导致的失活、沉降性能较差等问题,需要更复杂的固液分离手段,甚至存在纳米材料的生物毒性和生态风险等问题。其二,新开发的催化剂大多用复杂的物理化学手段合成,如浸渍、热处理等,尤其是负载型催化剂;但此类催化剂面临有效催化成分流失的问题,催化剂损耗和更换价格十分昂贵。其三,多数研究着眼于难降解及痕量有机微污染物(如抗生素、内分泌干扰物等)的去除、降解途径及其反应动力学;而催化O3的主要目的是实现有机物的完全矿化,以及将难降解污染物转化为小分子有机酸,为后续生物处理提供可能;实际废水成分复杂,判断催化效果的指标应为有机物综合指标。其四,合成催化剂实现催化作用的pH范围较窄,有些反应条件甚至极为苛刻,如锰氧化物仅在pH值<5时才有较可观的催化作用,钛氧化物也是在弱酸性条件下才能发挥最大效能;而实际废水常在pH中性范围且缓冲能力较强,加酸满足催化O3氧化需求后再重新中和的过程药耗较大;且酸性条件下金属离子的溶出显著增加,催化剂损耗过快,出水金属离子也需要额外控制。 因此,在理论研究的基础上,持续明确非均相催化O3氧化的机制、开发适用于工程应用的可持续使用的催化剂、研究其催化机理具有重要的科学意义和实践意义。针对以下问题的研究,有助于在提升催化O3氧化效果的同时,打通科学研究到实践应用的壁垒:(1)简化催化剂合成及改性手段,实现温和条件下的催化剂制备;(2)开发具有填料性质的催化剂,保证足够的比表面积和催化位点,同时避免复杂的分离手段等问题;(3)开发性质更稳定或具有自我修复功能的催化剂,避免有效成分溶解、脱落造成的催化剂失活等问题;(4)持续研究催化O3技术与生化处理的耦合,充分发挥催化O3降解大分子有机物及生化处理矿化小分子有机物的能力,完善废水处理链条。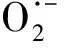
1.3 铈氧化物
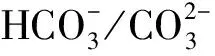
1.4 钴氧化物
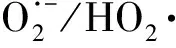
1.5 镍氧化物
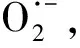
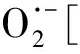
1.6 钛氧化物
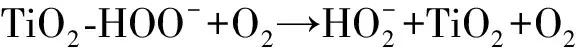
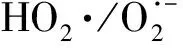

2 碳材料
2.1 活性炭和碳纳米管
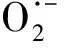
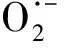
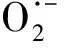
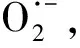
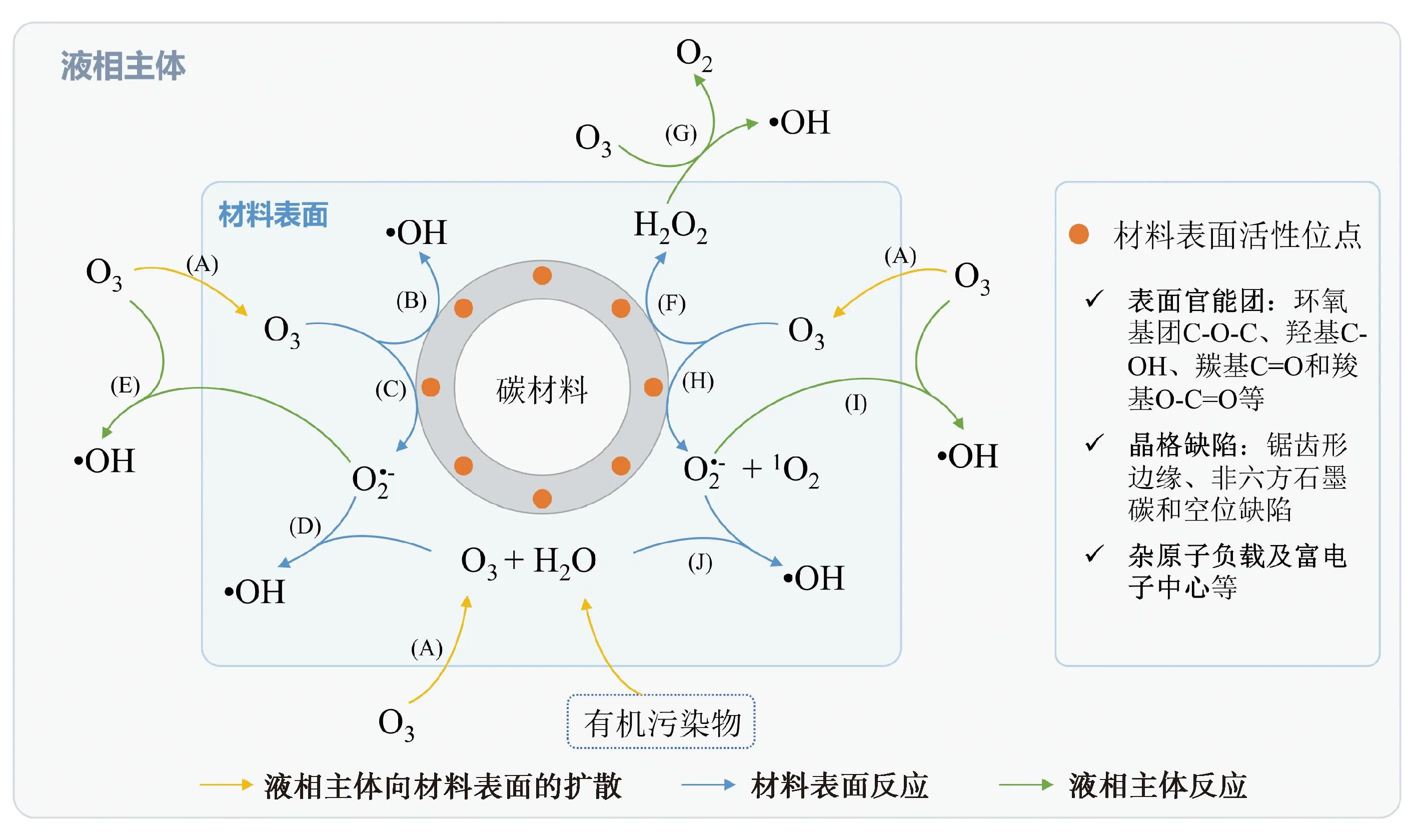
2.2 石墨烯
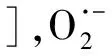
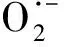

3 结论与展望