重楼皂苷I预防给药对心肌缺血再灌注损伤大鼠调节PI3K/AKT信号通路的作用研究*
2024-03-21田俊斌赵静罗斌吕建瑞马磊
田俊斌 赵静 罗斌 吕建瑞 马磊
(西安交通大学第二附属医院麻醉科,陕西 西安 710004)
心血管疾病是严重威胁人们健康的一大疾病,其发病率和死亡率较高,已经成为全球医学挑战之一[1]。近年来随着动脉旁路移植术和休克疗法(经皮冠状动脉介入治疗以及溶栓疗法等技术)的广泛推广和应用,心血管疾病患者生存率得到有效增加。然而,介入治疗属于有创性手术操作,具有一定术后风险,特别是术后发生的心肌缺血-再灌注(Myocardial ischemia/reperfusion,MI/ IR)损伤,其损伤程度已经成为患者康复和预后的关键影响因素[2]。重楼皂苷I是从中药重楼中提取的一种皂苷类化合物,相关研究[3-4]报道,重楼皂苷I具有抗炎,抗肿瘤,抗病毒,降低胆固醇,降血压等药理活性。近年来研究发现[5],重楼皂苷I对MI/ IR损伤具有一定的保护作用,但具体作用机制仍未完全明确。基于此,本研究拟构建MI/IR大鼠模型,以经典磷脂酰肌醇-3-激酶 (p-Phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(p-Protein kinase B,AKT)信号通路为切入点,探究重楼皂苷I对MI/ IR损伤的治疗机制。
1 材料与方法
1.1 实验动物、材料和仪器
1.1.1 实验动物 72只SPF级SD大鼠,雌雄各半,大鼠体重240~260 g,购于西安交通大学医学院动物学部[许可证号: SCXK(陕)2020-001]。大鼠购买后全部饲养于西安交通大学医学院动物实验中心,实验中心由中央空调统一控制温度和湿度,温度为22~25 ℃,湿度为60%~70%,采光由日光灯提供,明暗均为12 h。所有动物实验操作均获西安交通大学第二附属医院伦理委员会审批(审批号:2023265)。
1.1.2 药物与试剂 重楼皂苷I(纯度94%,上海纯优生物科技公司,货号:P0275);阿司匹林(山东新华制药股份有限公司,国药准字H37020354);大鼠肌酸激酶同工酶MB(Creatine Kinase-MB,CK-MB)、乳酸脱氢酶(Lactic Dehydrogenase,LDH)、谷草转氨酶(Aspartate aminotransferase,AST)、超氧化物歧化酶(Superoxide dismutase,SOD)、丙二醛(Malondialdehyde,MDA)、谷胱甘肽 (Glutathione,GSH)ELISA试剂盒(上海酶联生物科技有限公司,货号分别为:ml059533、ml092588、ml059334,ml093071、ml094962和ml094991);氯化三苯基四氮唑(TTC)(美国Sigma 公司,货号:3923356);HE染色试剂、TUNEL检测试剂盒(绿色荧光)和BCA 试剂盒(江苏碧云天生物科技公司,货号分别为:C0105M、C1098和P0009);PI3K、AKT、B细胞淋巴瘤/因子2(Bcl-2)、Bcl-2相关蛋白(Bax)、GAPDH和二抗(HRP)(英国Abcam 公司,货号分别为:ab139307、ab283852、ab182858、ab181602和ab201822)。
1.1.3 主要仪器 动物心电图系统(美国Nasiff Associates 公司,型号: ECG);超高分辨率小动物彩色多普勒超声仪(加拿大VisualSonics 公司,型号:Vevo 2100);多功能酶标仪(美国Bio-Rad 公司,型号:iMark680);显微镜(日本奥林巴斯公司,BX61型)。
1.2 方法
1.2.1 动物分组、造模 72只大鼠标号后随机分为6组,分别为假手术组(等体积1% DMSO灌胃)、模型组(等体积1% DMSO灌胃)、阿司匹林组(20 mg·kg-1·d-1)、以及重楼皂苷I低剂量组(75 mg·kg-1·d-1重楼皂苷I灌胃治疗)、中剂量组(150 mg·kg-1·d-1重楼皂苷I灌胃治疗)和高剂量组(300 mg·kg-1·d-1重楼皂苷I灌胃治疗),每组12只(依照文献报道[6-8],每组10~20只均可,本研究每组12只符合样本量)。适应性喂养2周后开始给药,给药时间也为2周,上述时间共4周。
1.2.2 MI/IR动物模型的构建 本研究根据文献报道[7],采用冠脉左前降支结扎术构建MI/IR大鼠模型。具体为:将大鼠采用戊巴比妥钠麻醉,麻醉后将其呈仰卧状固定于手术台,并连接动物呼吸机以实时监测其心电图,完成后沿大鼠左胸骨旁边的第3和第4肋骨的中间开胸,打开胸腔、剪开心包膜以使心脏充分暴露,找到心脏左心耳的下缘处2 mm处进针(出针位置为肺部的动脉圆锥旁),进针深度为1 mm,进针后使用6-0缝线及充气球囊一起使用后结扎左冠脉前降支,之后关闭胸腔,当球囊充满气、心电图上显示有明显的ST段升高确定为缺血模型成功构建,此时给予缺血45 min,然后抽空球囊,给予再灌注6 h,当心电图上显示有明显的ST 段下降(50%以上)即可判定为再灌注模型成功构建,假手术组只给予开胸后冠脉穿线但并不结扎。
1.2.3 大鼠心脏彩超评估 根据文献在大鼠再灌注24 h后[8](实验中观察到所有大鼠已完全清醒,能够简单活动)采用小动物彩色多普勒超声仪检测每组大鼠左心室射血分数(Left ventricular ejection fraction,LVEF)、左室舒张末期压(Left Ventricular End Diastolic Pressure,LVEDP)、左室内压最大上升速率(Maximal left ventricular pressure rising rate,+dp/dtmax)、左室内压最大降低速率(Maximum reduction rate of left ventricular pressure,-dp/dtmax)。
1.2.4 大鼠心肌梗死面积检测 大鼠心肌梗死面积的测定采用TTC法[9],具体为处死大鼠后立即取出心脏(分成四个部分,一部分用于心肌梗死面积测定,一部分用于病理学检测,一部分用于蛋白表达的检测,剩余部分保存备用),将其置入-80 ℃ 的超低温冰箱中5 min,然后取出切成6块厚度为1~2 mm的心肌组织,再将其放入1%的TTC 溶液中避光孵育30 min,最后取出采用4%的多聚甲醛溶液固定24 h,收集图像通过Image-Pro Plus 6.0软件测量并计算心肌梗死面积即可(梗死区为灰白色区域,缺血未梗死区为红色区域),心肌梗死面积百分比(%)= (心肌梗死面积/心肌总面积)×100%。
1.2.5 HE染色检测心肌组织病理学 取一小块心肌组织,用4%多聚甲醛溶液固定48~72 h后取出,超纯水反复冲洗后,采用石蜡包埋、切片、苏木精和伊红染色、固定即完成,然后采用光学显微镜照片并收集图像即完成,每张图片选取6个不同的视野。
1.2.6 相关生化指标(心肌损伤标志物和氧化应激因子)检测 采用低温高速离心机将腹主动脉取血法收集的血液离心(离心速度3 000×g,离心时间5 min,离心半径6 cm),血清收集后采用试剂盒提供的说明书进行检测即可,其中心肌损伤标志物指标为CK-MB、LDH和AST,氧化应激因子指标为MDA、GSH和SOD。
1.2.7 TUNEL检测心肌细胞凋亡 采用TUNEL染法检测心肌组织中细胞的凋亡情况,将HE染色固定的心肌组织取出后,切片,脱蜡,依次用PBS洗涤3次、蛋白酶K浸泡30 min、H2O2(3%)浸泡10 min,上述完成后37 ℃条件下采用TUNEL 混合液避光孵育1 h,采用DAPI染色细胞核10 min,完成后采用PBS洗涤二次后即可封片。采用荧光倒置显微镜收集图像,每张图片选取4个不同的视野。分析比较时绿色荧光为TUNEL染色的凋亡细胞,蓝色荧光为DAPI染色的细胞核,绿色越多表明凋亡越严重。
1.2.8 Western blot检测相关蛋白的表达 PI3K、Akt、Bcl-2和Bax蛋白表达量的测定采用Western blot法,采用组织蛋白裂解液提取心肌组织中的总蛋白,蛋白提取后对其进行定量并调平,然后每组各取50 μg行SDS-PAGE凝胶电泳,待电泳结束后裁剪目的蛋白的胶带将其蛋白转移到PVDF 膜,脱脂牛奶封闭2 h,加入一抗封闭过夜,次日取出后加入二抗孵育1 h,采用凝胶成像仪收集图像即完成,结果比较以GAPDH为内参,目的蛋白/GAPDH的灰度值所测蛋白的箱规表达量。

2 结果
2.1 重楼皂苷I对心肌组织病理学的影响 心肌组织HE染色结果显示,假手术组心肌细胞形态完整且规则,同时可见心肌纤维排列整齐,无水肿以及炎症反应,而模型组大鼠则出现紊乱的心肌纤维排列以及部分心肌纤维的断裂。与模型组相比,重楼皂苷I低、中、高剂量组和阿司匹林组均明显好转,但重楼皂苷I低、中、高剂量组和阿司匹林组相比仍有一定的差异。见图1。

图1 大鼠心肌组织HE染色结果图(400×)
2.2 各组大鼠心肌梗死面积比较 与假手术组相比,模型组大鼠心肌梗死面积的相对范围明显增加(t=24.052 0,P<0.001);而相较于模型组,阿司匹林和重楼皂苷I低、中、高剂量组均可明显降低大鼠心肌梗死面积(t=13.211 7、5.040 7、7.845 8、9.989 7,均P<0.001),但重楼皂苷I低、中、高剂量组并未优于阿司匹林组,甚至表现为高于阿司匹林组(P<0.001)。见表1。

表1 各组大鼠心肌梗死面积比较
2.3 重楼皂苷I对大鼠血流动力学的影响 相较于假手术组,模型组大鼠LVDP、+dp/dtmax、-dp/dtmax均明显降低(P<0.05),而LVEDP则明显升高(P<0.05);相较于模型组,重楼皂苷I低、中、高剂量组和阿司匹林组大鼠LVDP、+dp/dtmax、-dp/dtmax均明显升高(P<0.05),而LVEDP则明显降低(P<0.05),但重楼皂苷I低、中、高剂量组相较于阿司匹林组仍然有一定的差异(P<0.05)。见表2。

表2 重楼皂苷I对大鼠心脏血流动力学的影响
2.4 重楼皂苷I对大鼠血清和心肌心功能指标的影响 相较于假手术组,模型组大鼠血清以及心肌组织中心功能指标LDH、CK-MB和AST均明显升高,差异具有统计学意义(P<0.05);相较于模型组,重楼皂苷I低、中、高剂量组和阿司匹林组大鼠血清和心肌组织中心功能相关指标LDH、CK-MB和AST均明显降低(P<0.05),但重楼皂苷I低、中、高剂量组相较于阿司匹林组仍然有一定的差异(P<0.05)。见表3、表4。

表3 重楼皂苷I对大鼠血清心功能指标LDH、CK-MB和AST的影响

表4 重楼皂苷I对大鼠心肌组织心功能指标LDH、CK-MB和AST的影响
2.5 重楼皂苷I对大鼠血清和心肌中氧化应激指标的影响 相较于假手术组,模型组大鼠血清和心肌组织中MDA水平均明显升高(P<0.05),而SOD和GSH则明显降低(P<0.05);相较于模型组,重楼皂苷I低、中、高剂量组血清和心肌组织中MDA 明显降低(P<0.05),SOD和GSH则明显升高(P<0.05);此外,与阿司匹林组相比,重楼皂苷I高剂量组MDA明显降低(P<0.05),而SOD和GSH则明显升高(P<0.05)。见表5、表6。

表5 重楼皂苷I对大鼠血清MDA、SOD和GSH的影响

表6 重楼皂苷I对大鼠心肌组织MDA、GSH和SOD的影响
2.6 TUNEL染色观察心肌组织凋亡变化特点 各组心肌组织凋亡变化特点显示(蓝色部分为细胞核,绿色部分为心肌细胞凋亡后的图像)。假手术组几乎没有发生心肌细胞凋亡(仅有一个绿色凋亡点),而模型组呈现出明显的大量的细胞凋亡,与模型组相比,阿司匹林组和重楼皂苷I低、中、高剂量组凋亡情况明显好转,但重楼皂苷I低、中、高剂量组相较于阿司匹林组仍有一定的差异,表现为绿色荧光依然较多。见图2。
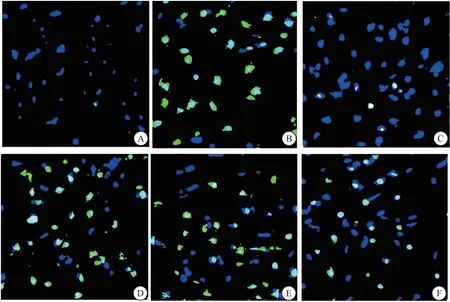
图2 各组大鼠心肌细胞凋亡情况(Tunel法,400×)
2.7 对PI3K、AKT蛋白表达的影响 相较于假手术组,模型组大鼠心肌组织中PI3K、AKT和Bcl-2蛋白表达均明显降低(P<0.05),而Bax表达则明显升高(P<0.05);相较于模型组,重楼皂苷I低、中、高剂量组以及阿司匹林组PI3K、AKT和Bcl-2蛋白表达均明显升高(P<0.05),而Bax蛋白表达则明显降低(P<0.05);此外重楼皂苷I低、中、高剂量组PI3K表达明显高于阿司匹林组(P<0.05),重楼皂苷I高剂量组AKT明显高于阿司匹林组(P<0.05),重楼皂苷I中剂量组和高剂量组Bcl-2表达明显高于阿司匹林组(P<0.05),重楼皂苷I中剂量组和高剂量组Bax表达明显低于阿司匹林组(P<0.05),见图3、表7。

表7 各组大鼠心肌组织中PI3K、Akt、Bcl-2和Bax蛋白相对表达量
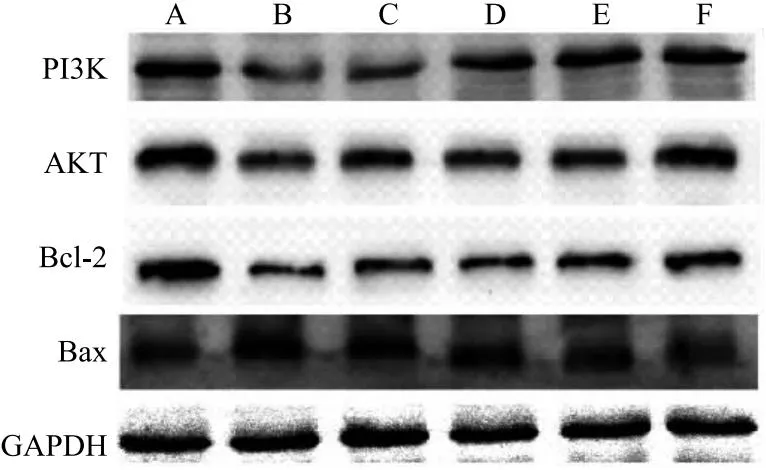
图3 各组大鼠心肌组织中PI3K、AKT、Bcl-2和Bax蛋白表达图
3 讨论
中药重楼是广泛应用的一种中药材,在中医学中具有重要地位,其根茎和地上部分均有药用价值。相关古籍记载重楼具有清热解毒、消肿止痛、凉肝定惊等功效[9]。现代药理学研究表明,重楼皂苷是重楼主要活性成分,其中重楼皂苷I的药用价值极高[10],主要表现在抗细胞凋亡以及抗肿瘤方面[11]。近年来研究发现,重楼皂苷I在防止心血管疾病方面具有极大的优势[12]。江振涛等[13]研究发现重楼皂苷I能明显改善病毒性心肌炎,明显降低心肌炎症指标IL-6、TNF-ɑ和IL-1β的含量,并分析其作用机理可能与其能够调控心肌Bax和Bcl-2的表达有关。王娓娓等[14]实验研究结果表明,重楼皂苷Ⅰ可能通过降低钙粘蛋白表达,导致体外培养的人冠状动脉内皮细胞(HCAEC)生长发育及结构异常,进而抑制HCAEC增值并诱导其凋亡。还有学者[5]构建MI/IR损伤动物模型,予以重楼皂苷I干预后发现重楼皂苷能明显缓解MI/IR损伤,但是具体的作用机制仍然是不明确的。因此本研究也采用重楼皂苷I干预MI/IR损伤动物模型,研究中设置阿司匹林为阳性对照药,原因是阿司匹林作为临床心血管疾病治疗的二级预防用药,在预防和治疗MI/IR损伤方面已经被公认[15]。本研究从心功能、病理学、Tunnel染色结果可以明显看出,与假手术组相比,模型组表现有明显的心肌损伤,以及心肌凋亡和心功能相关指标异常,予以重楼皂苷I干预后,上述指标均有明显的好转,该结果提示重楼皂苷I对MI/IR损伤具有明显的改善作用。然而,阿司匹林对MI/IR损伤的改善作用不及重楼皂苷I,原因可能是这两种药物治疗MI/IR损伤的作用靶点不一致。
近年来研究表明,PI3K/AKT 信号通路与本病的发生发展密切相关,通过调控PI3K/AKT 信号通路能够有效的减缓MI/IR损伤造成的心肌细胞损伤[8,16]。叶桢干等[17]探究了血根碱处理后对MI/IR损伤的作用,研究结果发现血根碱能够通过调控PI3K/AKT信号通路相关蛋白的表达,进而降低炎症反应,最终改善心肌损伤。闫清支等[18]用蒙药额尔敦-乌日勒干预MI/IR损伤大鼠,结果提示,蒙药额尔敦-乌日勒能够有效的调节PI3K-AKT-m TOR通路防止细胞过度自噬,进而保护心肌细胞。PI3K/AKT是细胞中一个经典的信号通路,能够通过调控下游Bcl-2家族蛋白基因的表达,进而调控细胞的凋亡以及抗氧化能力的平衡[19]。Bcl-2是人体内调节细胞凋亡的关键基因,主要有两类,一类为抗凋亡蛋白,主要有Bcl-2,Bcl-XL、Bcl-W、Mcl-1、A1,另一类为促凋亡的蛋白,主要有Bax、Bcl-Xs、Bad、Bak、Bik、Bid等,在上述两大类基因中,PI3K/AKT直接调控的凋亡因子为Bcl-2和Bax,通过调节Bcl-2和Bax两个蛋白的表达不仅能够直接调控细胞的凋亡[20-21],也可调节下游氧化应激指标SOD、MDA和GSH的含量[22]。因此,本研究观察了重楼皂苷I对上述PI3K/AKT信号通路及其调控的凋亡蛋白Bcl-2和Bax蛋白的表达特点。研究结果发现,相较于假手术组,模型组大鼠心肌组织中PI3K、AKT和Bcl-2蛋白表达均明显降低,Bax表达显著升高;相较于模型组,重楼皂苷I低、中、高剂量组和阿司匹林组大鼠心肌组织中PI3K、AKT和Bcl-2蛋白均明显升高,Bax蛋白表达显著降低;值得注意的是,重楼皂苷I对上述蛋白表达的调控更明显,且优于阿司匹林。此外,氧化应激指标SOD、GSH和MDA也呈现有相同的趋势。相较于假手术组,模型组大鼠血清和心肌组织中MDA水平均明显升高,SOD和GSH水平明显降低;相较于模型组,重楼皂苷I和阿司匹林组大鼠血清和心肌组织中MDA水平明显降低,SOD和GSH显著升高。重楼皂苷I对上述指标的改善同样优于阿司匹林组,其中重楼皂苷I高剂量效果更显著。综上,本研究结果证实重楼皂苷I可能通过调控PI3K/AKT信号通路,调节相关凋亡蛋白的转录,进而逆转MI/IR损伤,减轻心肌细胞凋亡。
4 结论
重楼皂苷I对MI/IR损伤大鼠心功能、心肌组织病理学均具有明显的改善作用,其作用机理可能与重楼皂苷I能够调节PI3K/AKT信号通路,进而减轻心肌细胞凋亡,逆转MI/IR损伤有关。该实验进一步挖掘了重楼皂苷I的现代科学内涵,并为MI/IR损伤的临床治疗提供了新的治疗思路及方法。
