红树林植物内生菌分离鉴定及其抑菌活性研究
2024-03-20谢星朋戴悦彭金菊罗帅帅李杨马浩天刘志军张怡马驿
谢星朋 戴悦 彭金菊 罗帅帅 李杨 马浩天 刘志军 张怡 马驿
摘要 [目的]從红树林植物组织中分离出对动物病原菌具有广谱抑菌活性的植物内生菌。[方法]以铜绿假单胞菌、多杀性巴氏杆菌、产气肠杆菌、粪肠球菌4种常见的致病菌作为指示菌,采用M10和P3培养基从红树林植物根、茎、叶组织中分离内生菌,以固体琼脂打孔法筛选具有抑菌活性的菌株,提取菌株的基因组DNA,PCR扩增16S rDNA基因并测序,通过邻接法构建系统发育树。[结果]从红树林植物组织中共分离857株可培养的内生菌,有145株菌有抑菌活性,占分离菌株的16.6%。其中通过M10培养基从红树林植物叶组织分离的菌株32-5对铜绿假单胞菌、产气肠杆菌都具有最强抑菌活性,其抑菌圈直径分别为38和42 mm;通过P3培养基从红树林植物茎组织分离的菌株12-4对粪肠球菌具有最强抑菌活性,其抑菌圈直径为56 mm;通过M10培养基从红树林植物茎组织分离的菌株13-2对多杀性巴氏杆菌具有最强抑菌活性,其抑菌圈直径为64 mm。有抑菌活性菌株分为10个属,其中芽孢杆菌属是优势菌属。[结论]该试验初步揭示红树植物根、茎、叶组织中植物内生菌的抑菌活性和多样性,为开发新型抗菌药物及应用提供理论依据。
关键词 红树林;植物内生菌;分离;鉴定;抑菌活性;海洋细菌
中图分类号 Q939.9 文献标识码 A
文章编号 0517-6611(2024)04-0001-10
doi:10.3969/j.issn.0517-6611.2024.04.001
开放科学(资源服务)标识码(OSID):
Isolation,Identification and Antibacterial Activity of Endophytic Bacteria from Mangrove Plants
XIE Xing.peng,DAI Yue,PENG Jin.ju et al
(Depariment of Veterinary Medicine,College of Coastal Agricultural Sciences,Guangdong Ocean University,Zhanjiang,Guangdong 524000)
Abstract [Objective]To isolate plant endophytes with broad.spectrum antibacterial activity from mangrove plant tissues.[Method]Pseudomonas aeruginosa,Pasteurella multocida,Enterobacter aerogenes and Enterococcus faecalis were selected as indicator bacteria.M10 and P3 solid medias and agar.well diffusion were used to isolate and screen endophytes with antibacterial activity from root,stem and leaf tissues of mangrove plants.Extracted DNA were used as template for PCR amplification of the 16S rDNA gene and sequenced to construct a phylogenetic tree by neighbor.joining method.[Result]A total of 857 culturable bacteria were isolated from mangrove plant tissues and 145 strains had inhibitory activity,accounting for 16.6% of the isolates.The strain 32.5,isolated from mangrove plant leaf tissue using M10 solid medium,had the strongest inhibitory activity against Pseudomonas aeruginosa and Enterobacter aerogenes,with an inhibition circle diameter of 38 mm and 42 mm,respectively.Strain 12.4 isolated from mangrove plant stem tissue using P3 solid medium showed the strongest inhibitory activity against Enterococcus faecalis with an inhibition circle diameter of 56 mm.Strains 13.2 isolated from mangrove plant stem tissues using M10 medium showed the strongest inhibitory activity against Pasteurella multocida with an inhibition circle diameter of 64 mm.Bacteria with antibacterial activity were classified into 10 genus,of which Bacillus was the dominant genus.[Conclusion]This experiment initially revealed the antibacterial activity and diversity of endophytic bacteria in mangrove plant roots,stems and leaf tissues,providing a theoretical basis for the development and application of new antibacterial drugs.
Key words Mangrove;Plant endophytic bacteria;Separation;Identification;Bacteriostatic activity;Marine bacteria
基金项目 广东省自然科学基金项目(2023A1515012181);湛江市科技局科技专项资金竞争性分配项目(2021A05231);茂名实验室科研启动项目(2021TDQD002)。
作者简介 谢星朋(1999—),男,江西吉安人,硕士研究生,研究方向:兽医药理学与毒理学。*通信作者,教授,博士,硕士生导师,从事兽医药理学与毒理学研究。
收稿日期 2023-04-14
红树林是一种处在热带和亚热带交界地带的木本植物群落,是海洋与陆地两大生态系统的过渡区域,其独特的地理环境导致其中的微生物及其产物具有特殊性,红树植物内生菌复杂多样的代谢产物可成为重要的抗菌活性物质来源。目前,从红树林植物如木榄、秋茄、红海榄和海桑等宿主植物中均发现抗菌化合物[1-2]。随着陆地来源的药物研发难度不断加大,以“蓝色海洋药库”为资源库研制新药物已成为当今医药研究的重要方向。海洋微生物天然产物的研究最早是从海洋真菌开始的,海洋细菌天然产物的研究相对较晚。植物内生菌主要是指定殖于植物组织器官以及细胞间隙中的内生细菌[3]。研究显示,植物内生菌其特殊的代谢途径使其次级代谢产物可以产生大量结构新颖、抑菌效果较好的生物活性物质,成为开发新型抗微生物药物的良好资源[4-5]。该试验从广东湛江红树林自然保护区采取红树植物根、茎、叶样品,分离对动物病原菌有抑菌活性的内生菌,对其进行分子鉴定和系统发育分析,为开发新型抗菌药物及其在动物疫病防治领域的应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 培养基。M10培养基:可溶性淀粉10.0 g,水解酪素0.5 g,复合盐母液10 mL,琼脂14.0 g,去离子水1 000 mL,pH 7.2~7.4,复合盐母液溶解。P3培养基: 燕麦粉20.0 g,复合盐母液10 mL,琼脂14.0 g,去离子水1 000 mL,pH 7.2~7.4,复合盐母液溶解。
复合盐母液:KNO3 1.000 g,K2HPO4 0.500 g,NH4NO3 0.100 g,MgSO4·7H2O 0.500 g,NaCl 0.500 g,FeSO4 0.010 g,MnCl2·H2O 0.001 g,ZnSO4·7H2O 0.001 g,去离子水10 mL。LB液体培养基、LB固体培养基购自北京酷来博科技有限公司。
1.1.2 指示菌。
多杀性巴氏杆菌(批号CVCC393)、产气肠杆菌(批号ATCC13048)、粪肠球菌(批号ATCC29212)、铜绿假单胞菌(批号ATCC9027),均购自广东环凯微生物科技有限公司。
1.2 试验方法
1.2.1 样本采集。
从广东湛江红树林自然保护区采集红树植物根、茎、叶各50份,装于密封袋,室温保存。
1.2.2 样本的分组和处理。
将采集的红树植物组织根、茎、叶样品各50份随机排序标记。将样本植物清洗干净,依次用5%次氯酸钠、75%乙醇浸泡3 min,在消毒液浸泡后用无菌水冲洗多次。消毒完成后晾干,采用电动匀浆器将植物组织充分研磨,加入无菌水制成组织原液。
1.2.3 菌株培养与分离。
吸取植物组织原液0.1 mL均匀涂布到M10、P3培养基上,28 ℃培养7~21 d,挑选单菌落,进一步纯化分离后的菌株-80 ℃保存。
1.2.4 有抑菌活性菌株的筛选。
采用固体琼脂打孔法筛选红树植物根、茎、叶组织中有抑菌活性的菌株,将大肠杆菌、金黄色葡萄球菌、沙门氏菌、链球菌4种指示菌分别加入LB固体培养基,用无菌打孔器打孔,将分离菌株培养过夜并用LB液体培养基稀释至105 CFU/mL,接种至孔中,28 ℃培养24 h,测量抑菌圈直径。
1.2.5 16S rDNA测序和系统发育树分析。
对筛选的有抑菌活性的菌株采用试剂盒提取细菌基因组DNA,进行16S rDNA序列PCR扩增。扩增的引物设计如下:上游引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′),下游引物1492R(5′-CTACGGCTACCT TGTTACGA-3′)。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃ 延伸45 s,30次循环;最后72 ℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测,委托上海生工生物工程股份有限公司进行测序分析。序列经BioEdit Sequence Alignment Editor软件整理后,利用EzBioCloud数据库(https://www.ezbiocloud.net/)进行在线比对;选取同源性最高菌株的序列作为参比对象,运用MEGA10.0软件,采用Neighbor-Joining法构建系统发育树,Boostrap 1 000次检测各分支的置信值,对各菌株的系统发育地位进行分析。
2 结果与分析
2.1 分离菌株的抑菌效果
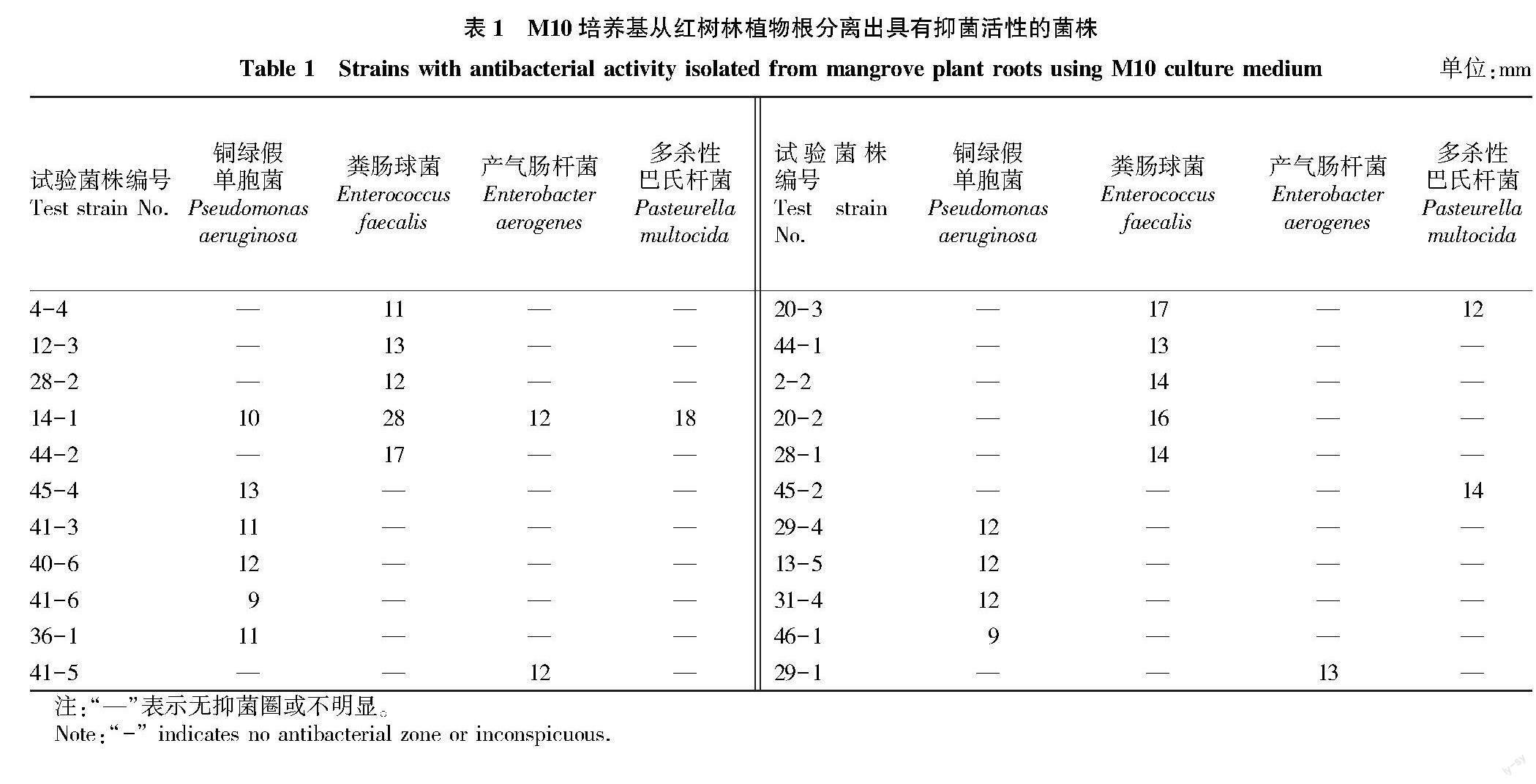
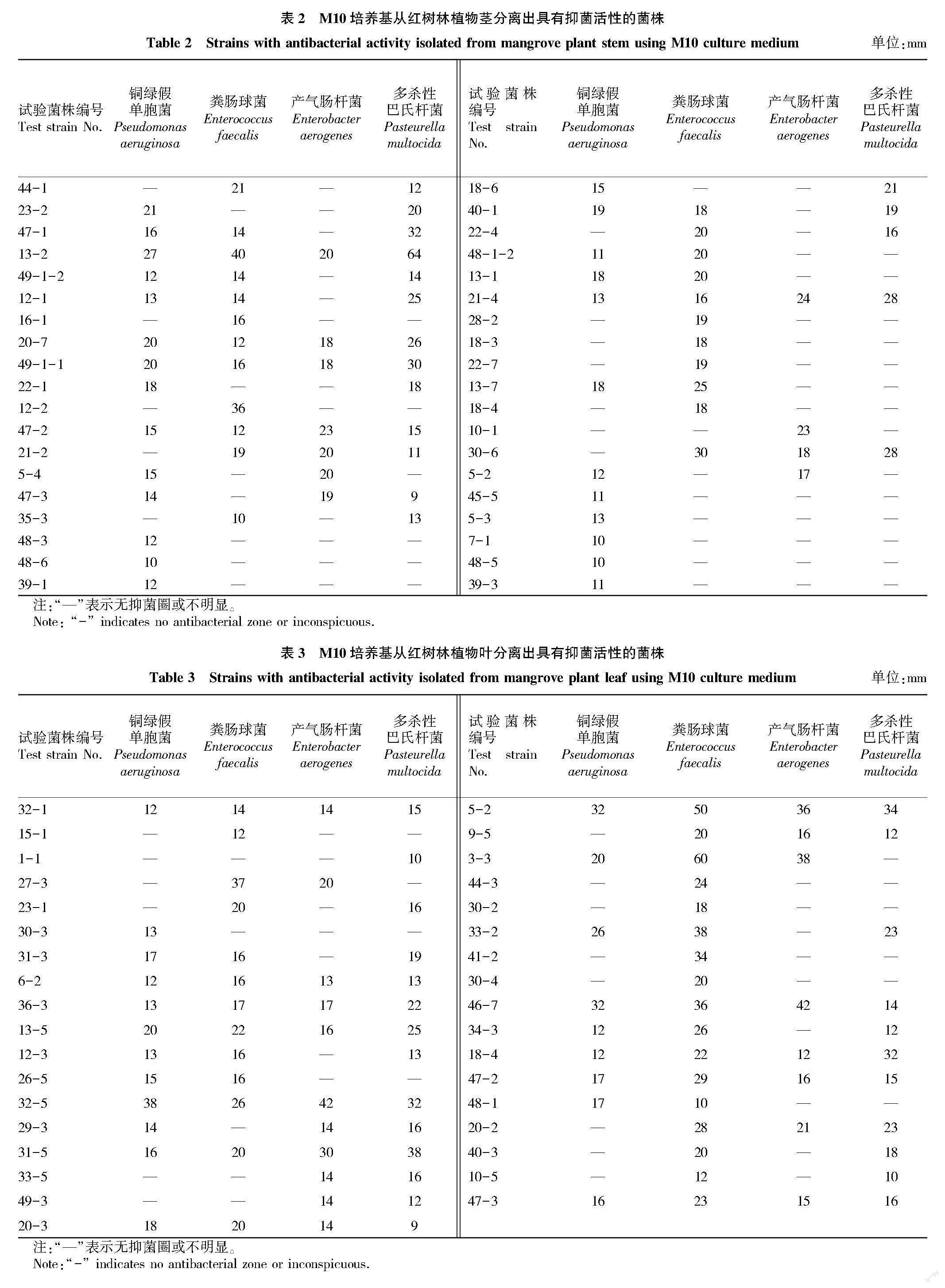
从红树植物根、茎、叶组织中分离出内生菌共857株,其中根227株,茎310株,叶320株。M10培养基共分离出具有抑菌活性菌株95株,从红树林植物根分离出具有抑菌活性菌株22株,如表1所示,菌株45-4对铜绿假单胞菌抑菌活性最强,菌株29-1对产气肠杆菌抑菌活性最强,菌株14-1对粪肠球菌和多杀性巴氏杆菌均表现出最强抑菌活性且呈现广谱抑菌效果;从红树林植物茎分离出具有抑菌活性菌株38株,如表2所示,菌株13-2对铜绿假单胞菌、粪肠球菌和多杀性巴氏杆菌均表现出最强抑菌活性且呈现广谱抑菌效果,菌株21-4對产气肠杆菌抑菌活性最强且具有广谱抑菌效果;从红树林植物叶分离出具有抑菌活性菌株35株,如表3所示,菌株32-5对铜绿假单胞菌和产气肠杆菌均表现出最强抑菌活性且具有广谱抑菌效果;菌株3-3对粪肠球菌具有最强的抑菌活性;菌株31-5对多杀性巴氏杆菌具有最强抑菌活性和广谱抑菌效果。
P3培养基分离有抑菌活性细菌共47株,从红树林植物根分离出具有抑菌活性菌株30株,如表4所示,其中菌株7-3对铜绿假单胞菌抑菌活性最强,菌株11-1对粪肠球菌抑菌活性最强且具有广谱抑菌效果,菌株26-1对产气肠杆菌抑菌活性最强且具有广谱抑菌效果,菌株7-2对多杀性巴氏杆菌抑菌活性最强;从红树林植物茎分离出具有抑菌活性菌株7株,如表5所示,其中菌株12-4对铜绿假单胞菌、粪肠球菌、多杀性巴氏杆菌抑菌活性均最强且具有广谱抑菌效果,菌株14-4对产气肠杆菌抑菌活性最强;从红树林植物叶分离出具有抑菌性菌株10株,如表6所示,其中菌株14-1对铜绿假单胞菌抑菌活性最强,菌株31-4对粪肠球菌和产气肠杆菌抑菌活性均最强,菌株42-4对多杀性巴氏杆菌抑菌活性最强。
2.2 有抑菌活性菌株的基因测序和系统发育分析
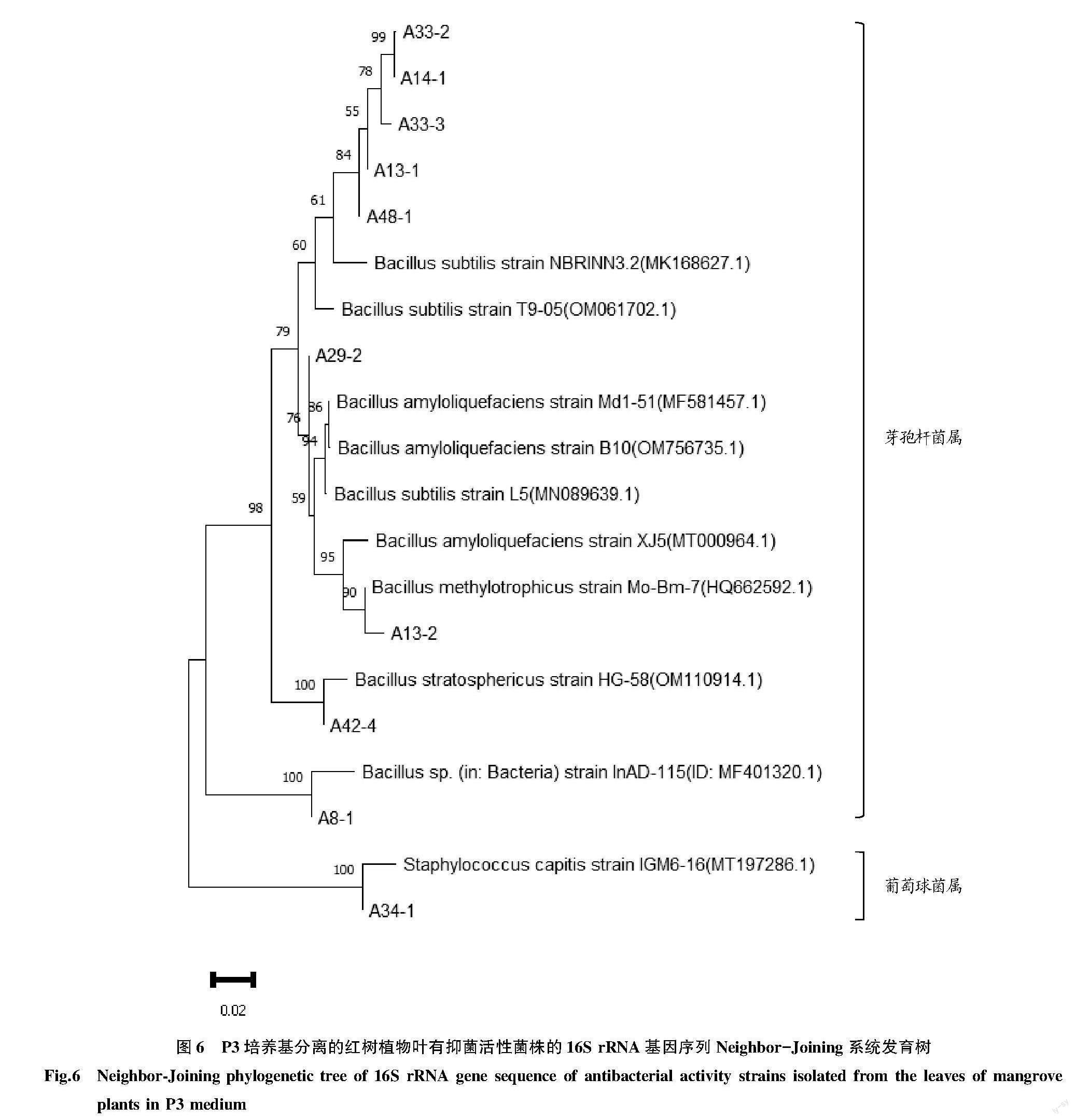
分别对2种培养基分离筛选出的有抑菌活性的菌株构建Neighbor.Joining系统发育树,如图1~6所示。M10培养基从红树林植物根分离的菌株主要分为4个属,分别为变形杆菌属、肠球菌属、葡萄球菌属、芽孢杆菌属;从红树林植物茎分离的菌株主要为8个属,分别为芽孢杆菌属、肠球菌属、葡萄球菌属、草螺菌属、黄单胞菌属、不动杆菌属、肠杆菌属、分散泛菌属;从红树林植物叶分离的菌株主要为4个属,分别为分散泛菌属、黄单胞菌属、芽孢杆菌属、葡萄球菌属。P3培养基从红树林植物根分离的菌株主要分为6个属,分别为芽孢杆菌属、黄单胞菌属、肠球菌属、肠杆菌属、埃希氏菌属、分散泛菌属;从红树林植物茎分离的菌株主要为4个属,分别为芽孢杆菌属、肠球菌属、变形杆菌属、黄单胞菌属;从红树林植物叶分离的菌株主要为2个属,分别为芽孢杆菌属、葡萄球菌属。其中芽孢杆菌属为优势菌属,占分离菌株总数的48.6%。
3 讨论与结论
海洋环境具有高压、高盐、无光照等特殊性,海洋微生物在海洋生态独特环境下会产生獨特的代谢产物,而这些特殊代谢产物作为新型抑菌物质在生物医药具有巨大的研究意义,目前已经有针对海洋微生物及其次级代谢产物研究[6]。许多研究显示海洋微生物中的优势菌属——芽孢杆菌属,可以产生具有抗菌作用的抑菌活性物质[7],如罗曼等[8]从南极海洋沉积物中分离纯化出草芽孢杆菌斯氏亚种对层生镰刀菌具有较强抑菌活性,Zhou等[9]从南大西洋的深海沉积物中分离筛选得到一株能抑制曲霉突变株菌丝生长的环状芽孢杆菌。红树林是一种处在热带和亚热带交界地带的木本植物群落,是海洋与陆地两大生态系统的过渡区域,其独特的地理环境导致其中的微生物及其产物具有特殊性,目前从红
树林植物如木榄、秋茄、红海榄和海桑等宿主植物中均发现抗菌化合物[1-2]。根据戴悦等[10]对红树林植物根际土壤细菌分离鉴定及其抑菌活性研究显示芽孢杆菌和肠杆菌为优势菌属,从红树林植物根际提取的内生菌具有产
生活性物质的潜力。该试验从广东湛江红树林自然保护区采集的植物根、茎、叶中分离具有抑菌活性的菌株占分离菌株的16.6%,M10培养基分离提取的叶、茎组织具有抑菌活性的菌株(95株)比P3培养基(47株)更多。戴悦等[10]从红树林植物根际土壤中分离得到108株具有抑菌活性的菌株,占分离菌株的16.5%,且P3培养基比M10培养基在分离具有抑菌性菌株中更具有优势。李静等[11]从海南东寨港红树林植物内生菌中共分离得到146株放线菌,其中40株具有抗菌活性,占分离菌株的27.4%。以上都是从红树林中提取得到的具有抑菌活性的菌株,且抑菌率都在16.0%以上,因此从红树林中提取的内生菌产生抑菌活性物质研究具有巨大的潜力。
通过分子鉴定和系统发育树分析,在属水平上,有抑菌活性菌株共10个属,分别是芽孢杆菌属、肠球菌属、葡萄球菌属、草螺菌属、黄单胞菌属、不动杆菌属、肠杆菌属、分散泛菌属、埃希氏菌属、变形杆菌属,其中芽孢杆菌属为优势菌属,占分离菌株总数的48.6%,在M10和P3培养基中,M10培养基在叶部提取分离芽孢杆菌属菌株数量最多,在根部提取芽孢杆菌属菌株数量最少,P3培养基在根部提取分离出芽孢杆菌属菌株数量最多,在茎部提取芽孢杆菌属菌株数量最少。李蜜等[12]从红树植物组织器官中获得33株内生细菌,其中芽孢杆菌为优势菌属。张雅慧等[13]从山口红树林根际土壤中获得117株细菌,其中芽孢杆菌为优势属,占所有菌株的28.20%。Varghese等[14]研究表明海洋大型藻类相关异养细菌芽孢杆菌属细菌萎缩芽孢杆菌具有较好的抗菌活性,其中萎缩芽孢杆菌SHB2097(MW821482)对临床上重要的病原体表现出显著的抗菌活性。这与该试验结果一致,优势菌属皆为芽孢杆菌属。
以上数据表明湛江红树林植物各组织内生菌具有产生微生物活性物质的潜力,为开发新型抗菌物药物及其在动物疫病防治领域的应用提供理论依据。
参考文献
[1]
徐志勇,冯昭,徐静.红树林微生物抗菌活性成分研究进展[J].中国抗生素杂志,2017,42(4):241-254.
[2] 闫璧滢,陈渝川,雷丽娟,等.海南东寨港红树林植物和沉积物真菌多样性及其药用活性[J].中国抗生素杂志,2023,48(2):158-171.
[3] 方珍娟,张晓霞,马立安.植物内生菌研究进展[J].长江大学学报(自科版),2018,15(10):41-45.
[4] EL.SAYED MOURAD M H.New bioactive compounds from Verticillium alboatrum and Verticillium leptobactrum[J].Australian journal of basic & applied sciences,2010,4(8):2166-2175.
[5] JOUDA J B,MAWABO I K,NOTEDJI A,et al.Anti.mycobacterial activity of polyketides from Penicillium sp.endophyte isolated from Garcinia nobilis against Mycobacterium smegmatis[J].International journal of mycobacteriology,2016,5(2):192-196.
[6] 李贺,林学政,何培青,等.南极抗细菌活性菌株的筛选及系统发育分析[J].微生物学通报,2011,38(2):264-269.
[7] RAVINDRAN C,VARATHARAJAN G R,RAJASABAPATHY R,et al.Antibacterial activity of marine Bacillus substances against V.cholerae and S.aureus and in vivo evaluation using embryonic zebrafish test system[J].Indian journal of pharmaceutical sciences,2016,78(3):417-422.
[8] 羅曼,万婧倞,黄仕新,等.南极沉积物来源抗菌细菌的筛选及抑菌物质的鉴定[J].微生物学通报,2020,47(6):1787-1794.
[9] ZHOU Y,WANG J Y, GAO X J,et al.Isolation of a novel deep.sea Bacillus circulus strain and uniform design for optimization of its anti.aflatoxigenic bioactive metabolites production[J].Bioengineered,2019,10(1):13-22.
[10] 戴悦,张汝军,张腾月,等.红树林植物根际土壤细菌分离鉴定及其抑菌活性的研究[J].黑龙江畜牧兽医,2023(3):73-78.
[11] 李静,戴素娟,庹利,等.海南东寨港真红树植物内生放线菌多样性及其抗菌活性[J].微生物学通报,2016,43(8):1753-1765.
[12] 李蜜,候师师,银江林,等.北部湾徐闻海域红树内生细菌物种多样性及其杀线虫活性研究[J].广西植物,2020,40(3):301-310.
[13] 赵雅慧,张舒琳,吴家法,等.山口红树林根际土壤可培养细菌多样性及其活性筛选[J].海洋学报,2018,40(8):138-151.
[14] VARGHESE C,CHAKRABORTY K,ASHARAF S.Pharmacological potential of seaweed.associated heterotrophic bacterium Bacillus atrophaeus[J].Archives of microbiology,2022,205(1):1-11.
