解毒化瘀颗粒对急性肝衰竭大鼠NLRP3炎症体调控作用的实验研究*
2024-03-13唐秋媛张荣臻胡振斌王挺帅牙程玉陈月桥
唐秋媛 张荣臻 胡振斌 王挺帅 牙程玉 吕 超 陈月桥
广西中医药大学第一附属医院,广西南宁市 530023
急性肝衰竭(Acute liver failure)是一种在短时间内肝脏细胞出现大量变性坏死及凋亡,肝脏合成、解毒、排泄等功能受损,甚至引起机体代谢功能紊乱而出现严重的临床综合征,属临床上危重肝脏疾病之一[1-2]。该病发病急骤,进展迅速,预后多与患者肝脏储备功能、凝血功能、肝病严重程度等多种因素相关,但至今发病机制尚未完全阐明,不少学者倾向于认同“二次打击学说”,该学说以免疫炎症损伤为核心,指出“内毒素→巨噬细胞→细胞因子风暴”为主要发病机制,认为HBV等因素通过直接损伤肝脏细胞,机体内毒素的增加从而诱导IL-6等多种细胞因子的产生,免疫炎症系统异常出现过度免疫炎症反应而对肝脏进行“二次打击”,最终引发肝衰竭[3-4]。改善肝脏炎症损伤是肝衰竭研究的热点和难点,近年来研究发现NLRP3炎症体及其上下游因子在固有免疫中发挥着重要作用,可通过激活Caspase-1,促使白介素等炎症因子进行加工、释放,引起炎症反应,促使肝细胞坏死[5-7]。本研究通过观察解毒化瘀颗粒对肝衰竭大鼠模型NLRP3炎症体及其上下游相关因子的表达,探索其治疗肝衰竭的作用机制。
1 材料与方法
1.1 实验动物 SPF 级SD大鼠36只,雄性,7周龄,体重为(250±30)g,购于北京斯贝福生物技术有限公司,许可证号SCXK(京)2019-0010。饲养条件:温度20~26℃,通风且湿度为40%~70%。进行适应性喂养(自由进食、饮水)1周。
1.2 药物 解毒化瘀颗粒由茵陈30g,大黄15g,白花蛇舌草30g,赤芍50g,郁金15g,石菖蒲15g组成。采用配方颗粒(江阴天江药业有限公司),由我院提供。一服药使用双蒸水27ml充分溶解药物,药物浓度设定为5.75g/ml,按照体重及给药浓度稀释到适宜浓度进行灌胃。D-半乳糖、脂多糖分别购于上海麦克林生化科技有限公司、北京索莱宝科技有限公司。
1.3 主要试剂和仪器 RIPA细胞裂解液(C1053,北京普利莱基因技术有限公司);BCA蛋白定量试剂盒(BCA Protein Assay Kit)(E-BC-K318-M,Elabscience);超纯RNA提取试剂盒(CW0581M,CWBIO);Gsafe Red plus核酸染料(GK20002,GLPBIO);大鼠白细胞介素18(IL-18)ELISA试剂盒、大鼠白细胞介素1β(IL-1β)ELISA试剂盒(江苏酶免实业有限公司);Marker(#26617,Thermo);Mouse Anti-GAPDH(HC301,TransGen Biotech,1/2 000);HRP conjugated Goat Anti-Mouse IgG (H+L) 、HRP conjugated Goat Anti-Rabbit IgG (H+L) (Servicebio,1/2 000);Rabbit Anti Caspase-1(Servicebio,1/1 000);Rabbit Anti NLRP3(Abcam,1/1 000);Rabbit Anti ASC(Bioss,1/1 000);ChamQ Universal SYBR qPCR Master Mix(Q711-02,Vazyme);紫外分光光度仪(NP80,NanoPhotometer);荧光PCR仪[CFX ConnectTM实时,伯乐生命医学产品(上海)有限公司];全自动酶标仪(WD-2012B,北京六一仪器厂);蛋白垂直电泳仪(DYY-6C,北京市六一仪器厂);全自动化学发光图像分析系统(Tanon-5200,上海天能科技有限公司)。
1.4 造模与给药 采用随机法将36只SPF级SD大鼠分为模型组、空白对照组和解毒化瘀颗粒组,每组12只,记录各组大鼠体重。
采用腹腔联合注射D-GalN+LPS致急性肝衰竭小鼠模型,使用前用生理盐水将D-GalN 350mg稀释成5ml,配制成的70mg/ml的溶液,LPS用无菌生理盐水稀释成7ml,配成5mg/ml的溶液,过滤除菌。腹腔注射D-GalN+LPS溶液(D-GalN溶液600mg/kg,LPS溶液20μg/kg)一次成膜。造模前1周按分组给药:空白对照组:0.9%氯化钠注射液(灌胃)+0.9%氯化钠注射液(注射);模型组:0.9%氯化钠注射液(灌胃)+造模药物(注射);解毒化瘀颗粒组:解毒化瘀颗粒药液(灌胃)+造模药物(注射)。每只大鼠每次灌胃体积为10ml/kg,每天灌胃2次(8:00、22:00),给药浓度57.55g/kg。
造模后48h进行取样,用1%戊巴比妥钠麻醉大鼠,腹主动脉采血,收集血清进行ELISA检测,剖取肝脏,用PBS洗净,滤纸吸干,称重后分别予10%甲醛液固定及液氮保存,用于病理检测、Western Blot及荧光定量PCR检测。
1.5 病理检测 取大鼠肝组织,包埋,切片,烤片,脱蜡,水化。苏木精水溶液染色3min,盐酸乙醇分化15s,返蓝15s,流水冲洗,伊红染色3min,冲洗,脱水,封片,镜检。
1.6 qPCR检测大鼠肝组织中NLRP3、Caspase-1、ASC mRNA表达 提取各组大鼠肝组织总RNA,测定总RNA浓度,OD260×40=RNA ng/μl(浓度),1.8≤OD260/OD280≤2.2(纯度),反转录合成cDNA,在RNase-free的PCR管中配制如下混合液20μl:Total RNA 1pg~1μg,4×gDNA wiper Mix 4μl,RNase-free ddH2O To 16μl,加入5×HiScript Ⅱ qRT SuperMix Ⅱ 4μl。上、下游引物各0.4μl,合成cDNA 1μl。引物序列见表1。95℃预变性10 min,95℃变性10s,58℃退火30s,72℃延伸30s(40个循环)。扩增反应在Roche Light Cycler 480 荧光定量PCR仪上进行,采用2-ΔΔCt法计算目的基因表达量。

表1 引物序列
1.7 Western Blot检测肝组织中NLRP3、Caspase-1、ASC蛋白表达 提取各组大鼠肝组织总蛋白,测定蛋白浓度,配置SDS-PAGE胶,加入制胶板中,缓慢加入至板的2/3的位置,加入无水乙醇压胶,待分离胶凝固后,加入浓缩胶,进行电泳,60V压缩蛋白,80V分离蛋白。将样本蛋白转移至 PVDF膜。用1×转膜液300mA恒流转膜,用1×TBST配置3%的脱脂牛奶封闭液,封闭1h。洗膜,用1×TBST浸泡15min后弃掉,重复3次。分别加入一抗:Anti NLRP3(1/1 000),Anti Caspase-1(1/1 000),Anti ASC (1/1 000),4℃孵育过夜。加入相应的过氧化物酶标记的二抗,孵育2h,洗膜3次。配置发光液,成像,凝胶成像系统拍照分析。Image J软件分析蛋白条带灰度值。
1.8 ELISA检测 按照试剂盒说明设置样本孔和标准品孔,分别加入待测样本及标准品各50μl,空白孔不加。除空白孔外,样本孔和标准品孔每孔加入辣根过氧化物酶(HRP)标记的检测抗体100μl,封板膜封闭反应孔,37℃水浴或恒温箱温育60min。弃去液体,吸水纸拍干,每孔加入洗涤液300μl,静置1min,甩去洗涤液,吸水纸拍干,重复洗板5次。每孔加入底物A、B各50μl,37℃避光孵育15min。每孔加入终止液50μl,15min 内,在450nm波长处测定各孔的OD值。
1.9 统计学方法 所有数据均用IBM SPSS Statistics 19统计分析,两组之间定量数值比较采用独立样本t检验,多组之间定量数值比较采用单因素方差分析,两两比较采用LSD法。检验水准α=0.05。以P<0.05作为显著性差异。
2 结果
2.1 HE染色 如图1所示,空白对照组:肝脏细胞围绕中央静脉排列呈放射状,肝脏组织肝小叶结构清晰致密,未见明显变性坏死、纤维组织增生及炎性细胞浸润。模型组:肝脏组织肝小叶结构紊乱,肝索排列紊乱,肝细胞变性坏死严重,可见出血灶。解毒化瘀颗粒组:肝小叶、肝索结构稍紊乱,细胞坏死程度较轻。

空白对照组
2.2 qPCR检测 如图2所示,模型组大鼠肝组织中的ASC、NLRP3、Caspase-1 mRNA均较空白对照组升高,差异具有统计学意义(P<0.05);解毒化瘀颗粒组大鼠肝组织中的ASC、NLRP3、Caspase-1 mRNA的表达明显低于模型组,具有统计学意义(P<0.05);结果显示解毒化瘀颗粒可降低肝衰竭大鼠肝组织中NLRP3、Caspase-1 mRNA表达水平。
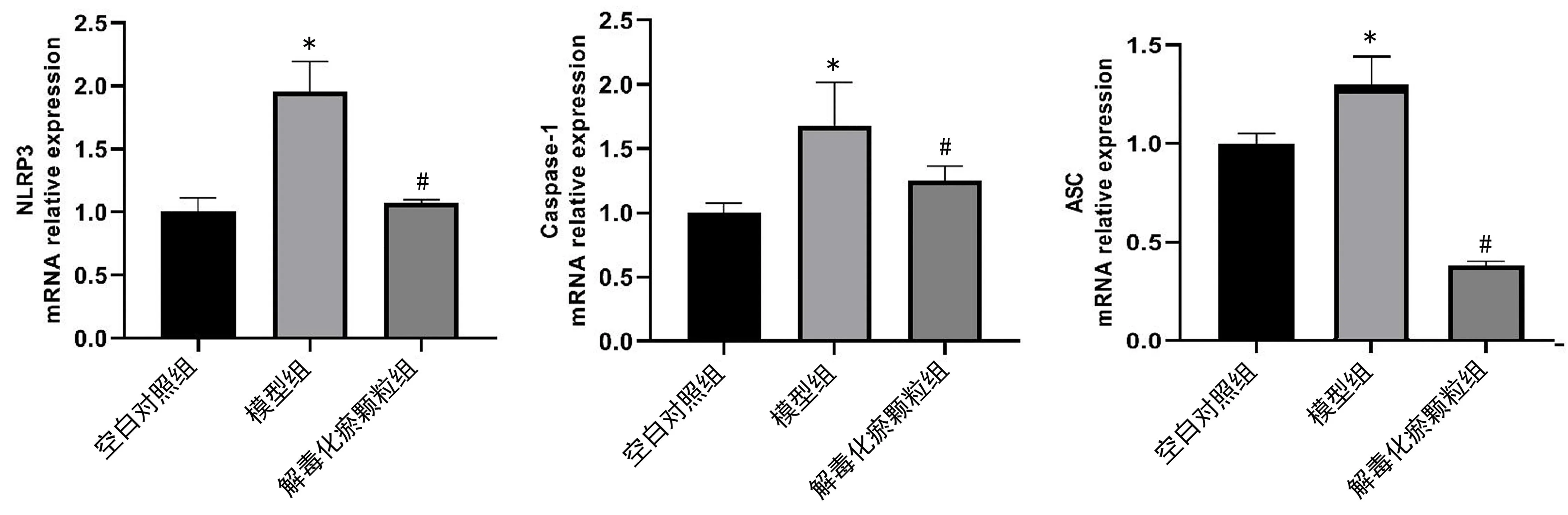
图2 NLRP3、Caspase-1、ASC基因在各组的相对表达情况
2.3 WB检测 如图3所示,模型组、解毒化瘀颗粒组大鼠肝组织中的ASC、NLRP3、Caspase-1 蛋白表达均较空白对照组升高,差异具有统计学意义(P<0.05);解毒化瘀颗粒组大鼠肝组织中的ASC、NLRP3、Caspase-1 蛋白表达较模型组下降,差异具有统计学意义(P<0.05);结果显示解毒化瘀颗粒可下调肝衰竭大鼠肝组织中NLRP3、Caspase-1 蛋白表达水平。
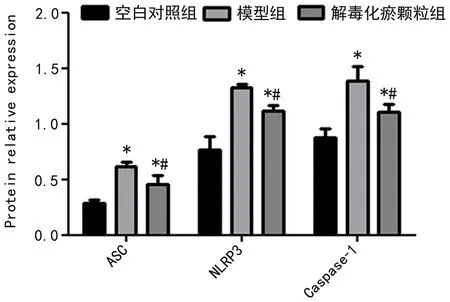
图3 ASC、NLRP3、Caspase-1在各组的蛋白相对表达情况
2.4 ELISA检测 如图4所示,模型组大鼠血清中IL-1β、IL-18的表达均高于空白对照组,差异具有统计学意义(P<0.05);且解毒化瘀颗粒组大鼠血清中IL-1β、IL-18的表达较模型组下降,差异具有统计学意义(P<0.05);结果显示解毒化瘀颗粒可下调肝衰竭大鼠血清中的IL-1β、IL-18表达水平。

图4 ELISA检测IL-1β、IL-18的含量
3 讨论
肝衰竭是临床病死率极高的严重肝病,具有起病急、进展迅速、并发症多等特点,可导致多器官功能障碍,愈后极差。急性肝衰竭的病因复杂,发病机制尚未明确,结合现有的研究认为免疫炎症损伤、肠道微生态失衡和肝脏微循环障碍在内的直接损伤和间接损伤多种因素等为其主要的发病机制[8-9]。近年来的研究陆续发现NLR家族成员(如NLRP1、NLRP3、IPAF和AIM-24等)能通过炎症体多蛋白复合体激活Caspase-1,释放多种炎症因子和细胞因子,参与不同类型的炎症反应[10]。
炎症体是一种蛋白复合体,NLRP3参与形成的NLRP3炎症体介导促炎因子IL-1β、IL-18的产生。
NLRP3炎症体具有识别机体受损或危险信号,被证实参与痛风、重症肌无力、急性肾损伤等多种自身免疫性疾病的发病机制。此外,NLRP3炎症体还参与急慢性肝病的发病机制[11-13]。该炎症体涵盖有Caspase-1、IL-1β、IL-22、TNF-α和MCP-1等,被激活后,Caspase-1被活化,进一步促进IL-1β等促炎细胞因子等分泌,释放至细胞外而发挥炎症效应[14-16],进而促进肝细胞坏死。随着研究的深入,人们逐渐意识到炎症体在炎症反应中扮演着重要角色,是炎症反应的核心,在炎症的启动及维持上起关键性作用,作为一种极具应用潜力的治疗新靶点,炎症体正迅速成为国际研究的热点。并且,随着研究不断深入,越来越多的研究表明,NLRP3炎症体参与了急性肝衰竭的发病过程。因此,深入探索炎症体参与的免疫应答分子机制,对阐明及丰富肝衰竭“免疫炎症二次打击学说”具有重要意义。
毛德文教授打破了因“湿热发黄、瘀热成毒” 形成肝衰竭的传统中医理念,首次提出以“毒邪致病”的新理念,形成了“毒邪病因”学说[17-18]。该学说认为 “热毒内蕴、瘀血内阻”为核心病机, “毒”“瘀”“痰(浊)”胶结[19]为其主要的病理因素。由于毒邪多在各种急性传染病后期治病,加之其发病急、病程短,往往不能及时控制病情发展,因此对于HBV所致的急性肝衰竭的早期诊断应从毒邪出发,为此,毛德文教授结合其多年临床经验,创制了解毒化瘀颗粒[组成:茵陈30g、大黄15g(后下)、白花蛇舌草30g、赤芍50g、郁金15g、石菖蒲15g],具有解毒化瘀、开窍醒神、生新见长之功效[20]。
本研究证实了解毒化瘀颗粒对急性肝衰竭大鼠NLRP3炎症体NLRP3、ASC、Caspase-1、IL-1β和IL-18因子具有调控作用,能够下调NLRP3炎症体NLRP3、Caspase-1、ASC、IL-1β和IL-18等相关因子的表达,极大丰富及支撑肝衰竭“免疫炎症二次打击学说”的科学内涵,为肝衰竭的治疗提供新的靶标,深刻揭示中药解毒化瘀颗粒缓解肝脏炎症损伤,拮抗肝衰竭的分子机制,对促进中医药发展具有重要意义。
