基于全基因表达谱的中药组分川栀方抗巨噬细胞炎性损伤作用机制研究
2024-03-09安婉丽杨智倩程文慧
江 杰,安婉丽,杨智倩,程文慧,杨 鸿
(中国中医科学院医学实验中心,北京 100700)
炎症和免疫细胞在多种系统疾病的发生、发展中发挥着重要作用,尤其固有免疫细胞中的巨噬细胞,具有吞噬作用,能够识别并清除各种病原体,受刺激经典活化后分泌各种炎性细胞因子,并启动激活一系列炎症信号通路,在防御机体病原感染和组织炎症中发挥着重要作用。巨噬细胞分布广泛,可存活长达数月,同时具有功能上的可塑性和异质性,不仅参与脓毒血症、急性肺损伤等感染性疾病炎性损伤相关调节,其局部炎性浸润也与一些非感染性疾病密切相关,如脑缺血再灌注损伤、动脉粥样硬化、糖尿病等,是加剧疾病进程和组织损伤的关键参与者。因此,巨噬细胞已成为炎性反应性疾病的潜在治疗靶点,发展以调控巨噬细胞炎症为中心的药物研究和临床治疗策略具有十分重要的意义。
基于拮抗巨噬细胞炎症而研发的中药组分川栀方(ZGC)抗炎效果明确,课题组前期系列研究表明[1],对于LPS 诱导的巨噬细胞炎性激活,ZGC 能够对多达16 种炎症因子均具有明显的抑制作用,如IL‑6、IL‑1α、IFN‑γ 等,动物整体实验也证实其对以炎症级联反应为主要病理特征的脑缺血再灌注损伤[1]和脓毒症急性肺损伤具有保护作用,证明发展以调控巨噬细胞炎症为治疗靶点的药物具有其可行性和重要性。但ZGC 抗巨噬细胞炎症的具体分子机制尚不明确,为此本研究采用高通量基因芯片检测为核心技术,探究ZGC 对炎性巨噬细胞全基因组表达的调控作用,探究其核心靶标,从而对其作用机制提供科学的解释,为进一步深入研究抗巨噬细胞炎症中药奠定实验基础。
1 资料与方法
1.1 实验材料
小鼠RAW264.7 细胞(协和细胞库)。高糖DMEM、FBS(Gibco 公司);LPS(美国Sigma,L4391)、DMSO(美国Sigma);栀子苷、葛根素、川芎嗪(上海同田);CCK‑8(日本Dojindo);Mouse IL‑6 ELISA kit(杭州联科);Gel Red(美国Biotium 公司); RNA 标准品(美国Thermofisher 公司);核酸分子量marker(台湾SMOBIO 公司);Ambion™ Ami‑no Allyl MessageAmp™ Ⅱ aRNA Amplification Kit(Thermofisher 公司); Agilent RNA 6000 Nano Kit(美国Agilent 公司); Labeling Reagent and Hybrid‑ization Kit, Mouse OneArray®(台湾华联)。2100 生物分析仪、微阵列扫描仪(美国Agilent 公司)。
1.2 实验方法
1.2.1 药品配制 LPS 配制:称取适量LPS 粉末,使用高糖DMEM 配制成4、2、1 和0.5 μg/mL 的溶液,分装保存备用。ZGC 的配制:将栀子苷,川芎嗪及葛根素粉末溶于高糖DMEM,按 800、600、400 及200 μg/mL 配制ZGC 药液,超声溶解并用0.22 μm滤膜过滤备用。
1.2.2 细胞培养 37 ℃,5%CO2,10% FBS‑DMEM培养RAW264.7细胞,避免刺激,隔天传代。
1.2.3 巨噬细胞炎症模型的建立 RAW264.7 细胞接种6 孔板,分为LPS 超高 (4 μg/mL)、高 (2 μg/mL)、中 (1 μg/mL)及LPS 低剂量模型组(0.5 μg/mL)4 个组别,于37 ℃,5%CO2的恒温培养箱培养24 h 后换为相应浓度的LPS 溶液, 20 h 后收集上清, ELISA 法检测IL‑6 浓度。
1.2.4 CCK‑8 法检测LPS 对RAW264.7 细胞的毒性影响 将细胞分为LPS 模型组(1 μg/mL)及Control 组, 37 ℃,5%CO2培养24 h。按照实验分组,分别将上清换成 1 μg/mL 的LPS 溶液及高糖DMEM, 20 h 后,上清换成含10%的CCK‑8 的高糖DMEM 溶液,37 ℃避光孵育0.5 h 后,进行OD 值检测,并且计算细胞的存活率及抑制率。
1.2.5 ZGC 细胞实验剂量考察 按800 μg/mL、600 μg/mL、400 μg/mL 和 200 μg/mL,将细胞分为超高剂量/高剂量/中剂量/低剂量给药组4 个实验组及Control 组,操作同步骤2.4, 24 h 后,弃去原有上清,加入10% CCK‑8 溶液, 37 ℃避光孵育0.5 h后,进行OD 值检测,并计算细胞的存活率及抑制率。
1.2.6 ZGC 抗LPS 诱导RAW264.7 炎性损伤实验 将RAW264.7 细胞接种到6 孔板,分为Control组、LPS 模型组(1 μg/mL)、ZGC 给药组(400 μg/mL),培养24 h 后,正常对照组和LPS 模型组细胞上清换为新的高糖DMEM 溶液, ZGC 组换为终浓度为400 μg/mL 的ZGC 药液,孵育4 h 后,LPS 组和ZGC 组加入终浓度为1 μg/mL 的 LPS 溶液,Con‑trol 组加入同体积DMEM。20 h 后收集上清液,ELISA 法检测IL‑6 浓度,各组细胞使用Trizol 裂解后冻存于−80 ℃冰箱备用。
1.2.7 RNA 提取质控、芯片检测及分析 提取细胞总RNA,对其质控检测, RNA 样本质检合格后,基因芯片杂交,扫描芯片信号,分析差异基因表达,并使用bioinformatics 在线工具(https://www.bioin‑formatics.com.cn)进行聚类分析和功能富集分析。
1.2.8 统计学分析 采用SPSS20.0 软件处理分析数据,结果使用(±s)表示,使用单因素方差分析处理组间差异数据。
2 实验结果
2.1 LPS 刺激剂量筛选结果
ELISA 结果显示,相对于Control 组,各LPS 组均可刺激细胞分泌IL‑6 增多, LPS 刺激浓度越高,IL‑6 表达浓度越高。见表1。
表1 各剂量LPS 刺激细胞分泌不同浓度的IL⁃6(n=3,±s)Tab 1 Each dose of LPS stimulated RAW264.7 cells to secrete different concentrations of IL⁃6(n=3,±s)
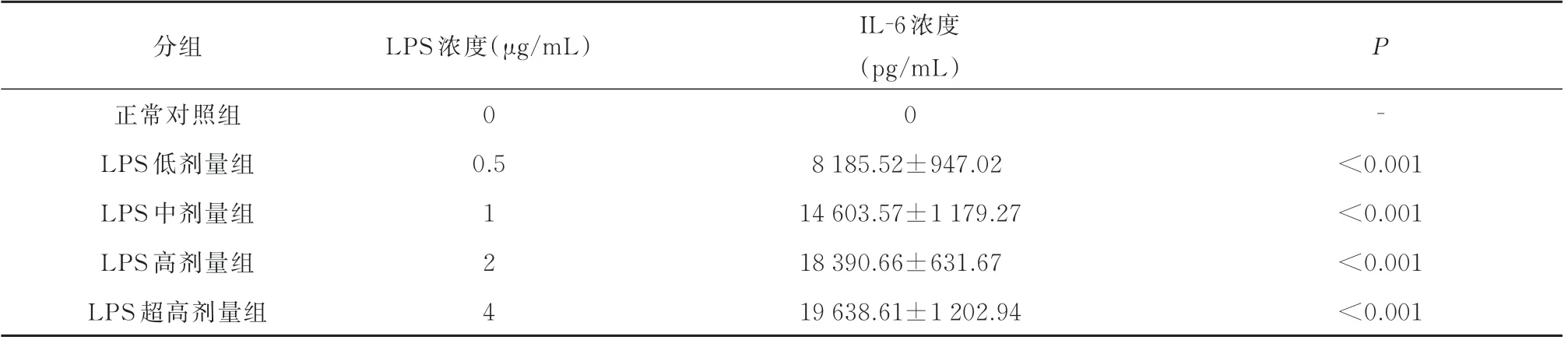
表1 各剂量LPS 刺激细胞分泌不同浓度的IL⁃6(n=3,±s)Tab 1 Each dose of LPS stimulated RAW264.7 cells to secrete different concentrations of IL⁃6(n=3,±s)
分组LPS 浓度(μg/mL)P IL‑6 浓度(pg/mL)正常对照组LPS 低剂量组LPS 中剂量组LPS 高剂量组LPS 超高剂量组0‑0.5 124 0 8 185.52±947.02 14 603.57±1 179.27 18 390.66±631.67 19 638.61±1 202.94<0.001<0.001<0.001<0.001
2.2 LPS 细胞毒性实验结果
细胞毒性实验结果显示,1 μg/mL 的LPS 刺激RAW264.7 细胞20 h 对其细胞增殖没有影响,结合前期实验研究,选用1 μg/mL 作为LPS 诱导细胞炎性反应条件。见表2。

表2 LPS 细胞毒性实验结果(n=4)Tab 2 Results of LPS cytotoxicity experiments(n=4)
2.3 ZGC 细胞毒性实验结果
CCK8 结果显示,随着ZGC 药物浓度的升高,对细胞增殖的抑制率呈现增长趋势,同时总结前期实验研究经验与结果,选用400 μg/mL 的ZGC 药液作为合适的药物干预条件。见表3。

表3 ZGC作用于RAW264.7细胞24 h的细胞存活率研究(n=4)Tab 3 Cell survival study of ZGC action on RAW264.7 cells at 24 h(n=4)
2.4 ZGC 对RAW264.7 细胞炎症的药效确证
作为细胞炎症经典促炎性因子, LPS 组IL‑6 的分泌显著升高,表明细胞炎症模型复建成功;ZGC组IL‑6 水平和LPS 组相比显著降低,验证了其可以有效抑制RAW264.7 炎症模型的IL‑6 释放水平,与前期实验研究结果一致,证明ZGC 抗炎作用确切。见表4。
表4 ZGC 对细胞炎症模型IL⁃6 浓度影响(n=3,±s)Tab 4 Effect of ZGC on the concentration of IL⁃6 secreted by RAW264.7 inflammation model(n=3,±s)

表4 ZGC 对细胞炎症模型IL⁃6 浓度影响(n=3,±s)Tab 4 Effect of ZGC on the concentration of IL⁃6 secreted by RAW264.7 inflammation model(n=3,±s)
注:模型组与空白组相比,#P<0.05,##P<0.01;药物组与模型组相比,*P<0.05,**P<0.01。
组别IL‑6 浓度(pg/mL)P空白对照组(C)LPS 模型组(M)ZGC 给药组(MZGC)0 14 663.23±300.25##12 552.11±1 002.45*‑<0.001 0.025
2.5 RNA 的提取与质检
对所提RNA 进行吸收光谱分析定量,质控结果良好,RNA 纯度较高,并未受到污染且完整度较好。见表5。

表5 RNA 吸收光谱分析定量结果Tab 5 Quantitative results of RNA absorption spectroscopy analysis
2.6 小鼠全基因表达谱芯片结果
2.6.1 差异表达基因分析 扫描基因芯片得到芯片扫描图,对芯片上不同位点的信号分析,得到差异表达基因均一化数据。按|Fold change|≥0.585 且P<0.05 处理数据,得到显著性差异表达的基因,与正常对照组相比,LPS 组上调基因数136 个,下调基因数25 个;与LPS 组比较,ZGC 组下调基因53 个,上调基因数8 个。见图1、2 及表6。

图1 差异倍数直方图Fig 1 Histogram of fold difference

图2 火山图Fig 2 Volcano map
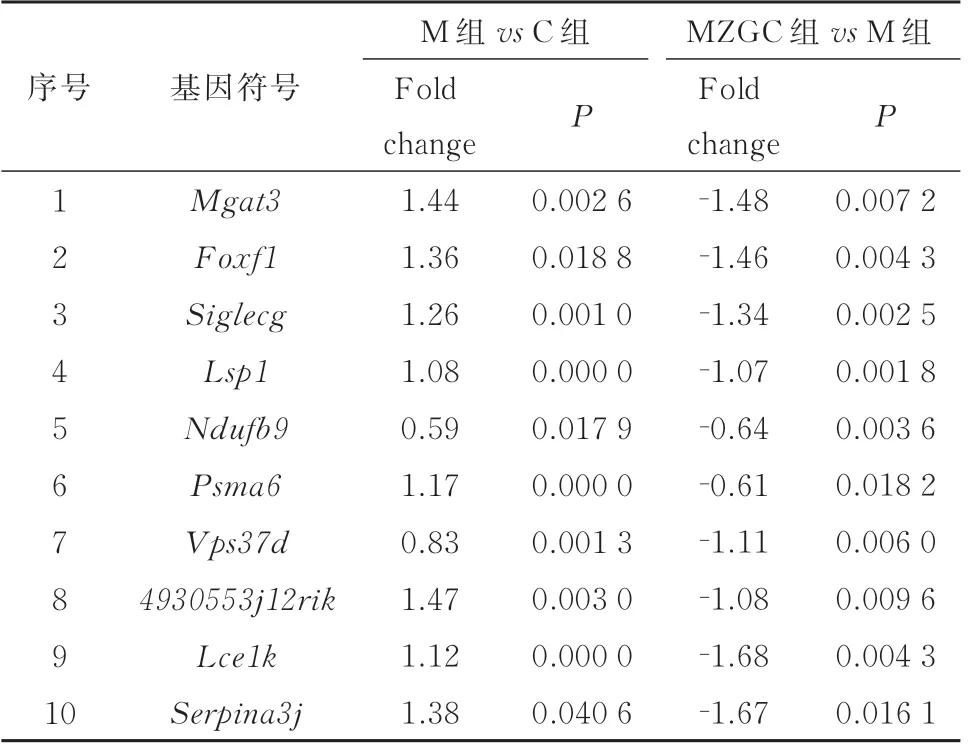
表6 共同差异表达基因Tab 6 Common differentially expressed genes
按|Fold change|≥1 且P<0.05 筛选更有显著性差异表达基因,与模型组比较,ZGC 组下调基因22个,上调基因数5 个,见表7。

表7 MZGC 组vs M 组差异表达基因Tab 7 MZGC group vs M group differentially expressed genes
2.6.2 聚类分析 以层次聚类方法对基因芯片扫描结果差异最大的30 个基因进行聚类分析,并绘制成热图展示各差异基因表达情况和相关性,见图3。

图3 基因差异性表达的分层聚类图Fig 3 Hierarchical clustering map of differential gene ex⁃pression
2.6.3 功能富集分析 ZGC 组与LPS 模型组的差异基因富集分析结果显示ZGC 主要通过白细胞介导免疫调节、前列腺素分泌调节、突触膜、唾液酸结合、免疫受体活性等方面发挥对抗细胞炎症作用。对药物组差异表达基因进行KEGG 富集分析,结果显示ZGC 主要通过细胞因子受体相互作用、C 型凝集素受体信号通路等相关途径干预巨噬细胞炎症。见图4、5。
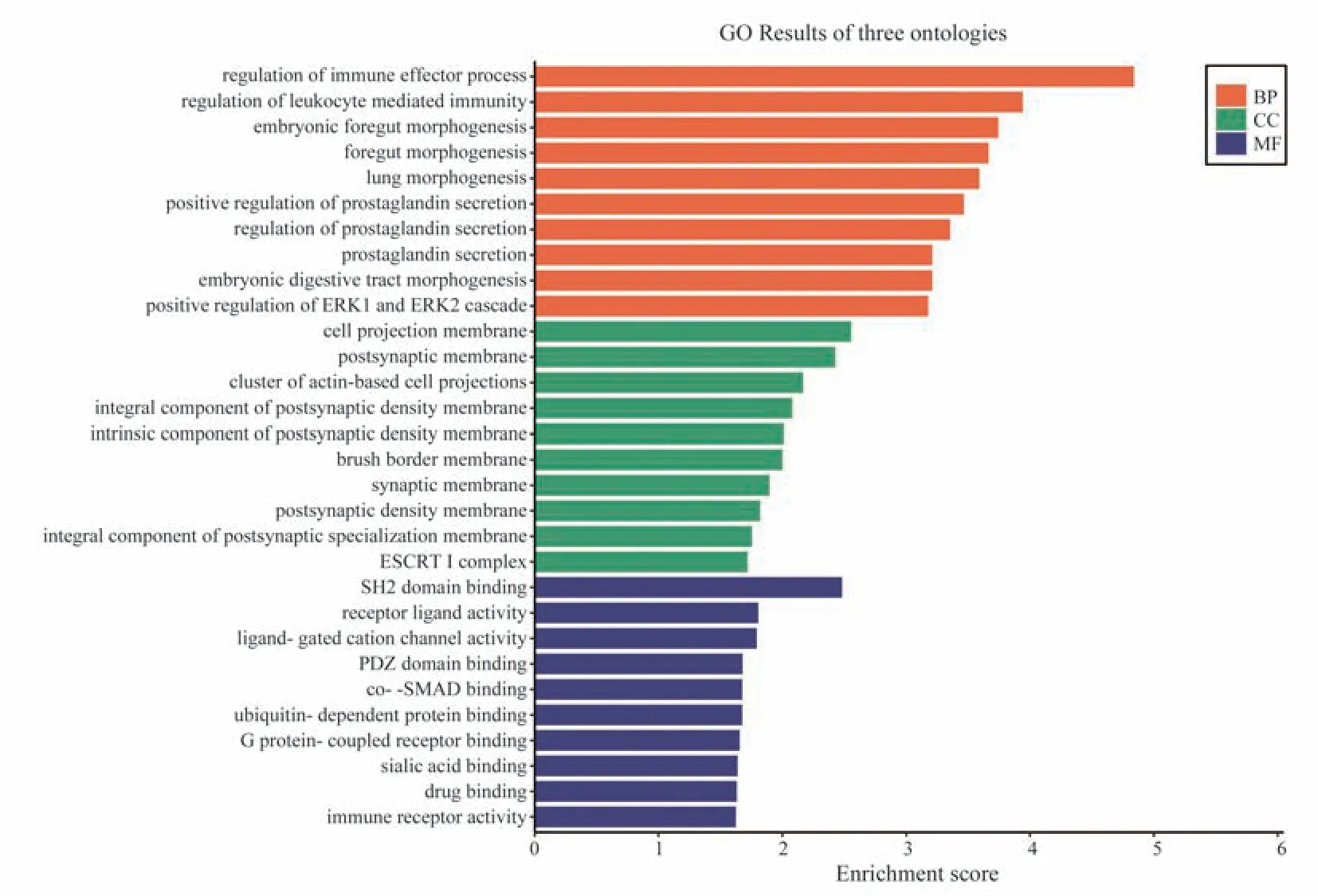
图4 MZGC 组vs M 组GO 富集分析图Fig 4 MZGC group vs M group GO enrichment map
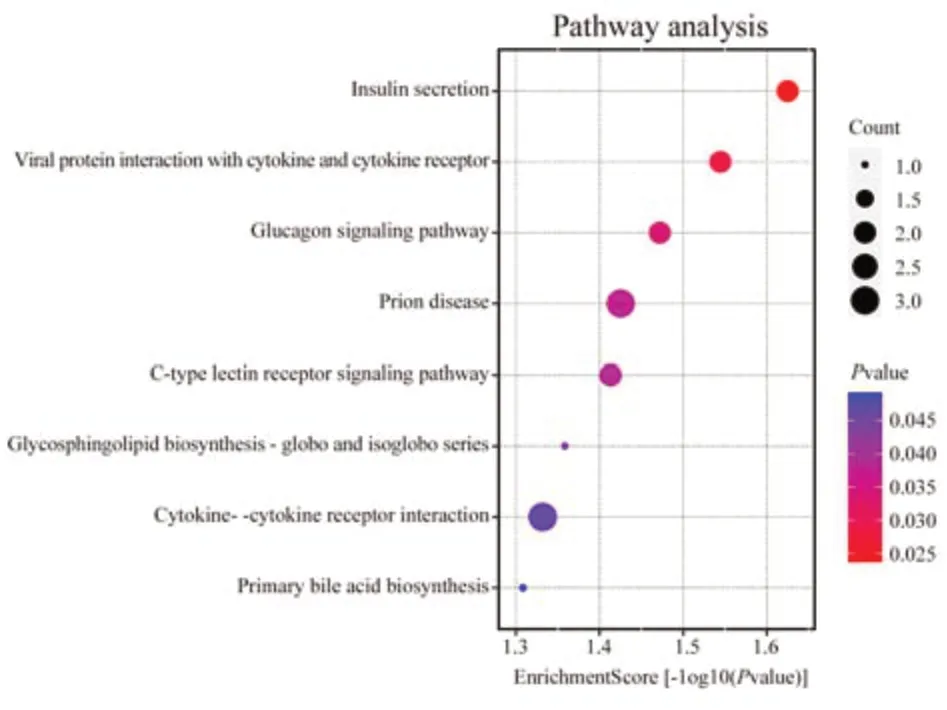
图5 MZGC 组vs M 组KEGG 富集分析图Fig 5 MZGC group vs M group KEGG enrichment map
3 讨论
以炎症巨噬细胞作为治疗目标,在药物发现研究和炎症反应性疾病的临床治疗中具有很大的前景。血液中的单核细胞作为前体细胞,透过血管内皮迁移到受损组织,在局部转成巨噬细胞,其形成两个具有不同功能特性的亚群,即M1 和M2,取决于于不同的刺激;M1 巨噬细胞经病原刺激后经典激活,释放TNF‑α/IL‑1 等细胞因子、一氧化氮合成酶(iNOS)和Th1 趋化因子以清除病原微生物,同时使胞内ROS/NOS 产物增加,在启动炎症反应中起重要作用。这些都有促炎作用,并加剧了组织损伤,而M2 巨噬细胞替代激活产生大量的IL‑10 等抗炎细胞因子、Th2 趋化因子、C 型凝集素(C‑type lec‑tins, CTLs)等,清除残留物,促进血管生成,这对解决炎症和组织修复是必要的[2‑4]。
已有研究证实[5],脂多糖促进巨噬细胞转变为M1 型引起炎症反应,该反应与TLR4 密切相关,该受体可识别病原相关分子介导免疫炎症反应,LPS作为其经典配体通过与巨噬细胞表面TLR4 结合,使细胞发生经典极化,释放大量IL‑1β、IL‑6、TNF‑α等促炎性因子,并激活NF‑κB、MAPK、JAK/STAT等信号通路,引起炎症级联反应,加剧疾病进程和组织损伤[6]。
本课题组基于拮抗巨噬细胞炎症而研发的中药组分川栀方(ZGC)抗炎效果明确,该方由栀子苷、葛根素和川芎嗪组成,能显著抑制IL‑6、IL‑1α、IFN‑γ 等多种巨噬细胞炎症细胞因子的表达[1]。通过基因芯片差异基因分析显示,给药组干预后上调基因表达5 个,下调基因表达22 个,共27 个差异表达的基因。GO 富集分析显示主要涉及白细胞介导免疫调节、前列腺素分泌调节、突触膜、唾液酸结合、免疫受体活性等方面,KEGG 富集分析显示ZGC 主要通过细胞因子受体相互作用、C 型凝集素受体信号通路等相关途径干预巨噬细胞炎症。
其中,与免疫炎症相关的基因表达显著。与LPS 模型组比较,ZGC 组的C4bp基因明显表达上调,C4bp能够抑制补体系统活化,而补体系统的激活能够促进中性粒细胞的大量聚集,使之黏附于血管内皮细胞,并且可以增加血管通透性,使各种免疫细胞渗透至损伤部位,在炎症后期激活可能会导致过度炎症和自身免疫。Kishiwada 等[7]通过大鼠实验,证明LPS 通过NF‑κB 和MEK / ERK 途径降低C4b 结合蛋白两条链‒C4BP α 和C4BP β 的表达,从而促进炎症发展[7]。另有研究表明[8],当C4bp存在于细胞表面时,对于避免炎症复合物在组织上沉积和保持对自身抗原的耐受性可能很重要,从而提供对抗炎症和自身免疫的保护。Kulak 等[9]研究表明,C4bp以剂量依赖性方式显著抑制非感染性疾病中胰岛炎性细胞浸润引发的巨噬细胞IL‑1β 分泌,C4BP 通过防止NLRP3 炎症小体激活所需的巨噬细胞吞噬溶酶体完整性的丧失来抑制炎症。同时实验证明C4BP 通过全身和局部CXCL13 下调,有效预防狼疮肾炎老年小鼠异位淋巴结构新生,具有抗炎和免疫调节活性[10]。因此,C4bp表达上调可以抑制补体系统的激活,从而减少中性粒细胞聚集,抑制炎症反应,发挥免疫调节活性,减轻组织损伤,课题组前期研究中ZGC 能够抑制炎症模型趋化因子MCP‑1、Eotaxin 的分泌水平,可能是通过上调C4bp的表达实现的。
Mgat3,模型组相对正常组表达上调,ZGC 药物组相对模型组表达下调,它参与糖蛋白低聚糖的生物合成,研究表明,Mgat3 可能与嗜酸性粒细胞炎症密切相关[11],同时它能够催化生成二酰甘油,诱导激活蛋白激酶C(PKC)[12]。PKC 的各种亚型[13]通过调控T、B 淋巴细胞和NF‑κB、MAPK 等信号通路在炎症反应过程中起着重要作用。在缺血性脑卒中病理过程中,PKC 的突变形式可导致神经退行性变和认知能力下降[14],另一方面铁介导的炎症可以通过谷氨酸活性激活PKC 通路,同时促进活性氧的释放[15]。研究表明抑制PKC 引起的Toll 样受体活化,可以减轻神经炎症损伤[16]。抑制Mgat3,可以减轻PKC 激活后产生的一系列反应造成的大脑组织炎性损伤,前期实验结果显示ZGC 可以抑制LPS 与巨噬细胞表面TLR 结合激活后释放出的IL‑6、IL‑1β 等多种炎症因子,综合芯片结果,提示ZGC 减轻CIRI 炎症损伤可能与Mgat3 基因的下调有关。
Siglecg,ZGC 药物组相对模型组表达下调,编码唾液酸结合免疫球蛋白型凝集素‑G,是一种CD33 相关受体,在胞外结构域与CD33 高度同源,具有重要的免疫调节功能,在B‑1a 细胞和巨噬细胞等免疫细胞中有相关表达[17]。原癌基因酪氨酸蛋白激酶 Src 可以抑制脓毒症中的炎症过程,并可以促进结肠炎小鼠模型中的抗炎细胞因子IL‑10 释放[18],Siglec‑g 可通过抑制Src 活化促进TLR4 诱导释放炎性细胞因子并抑制抗炎因子IL‑10 的分泌,而Siglec‑ g 缺乏减少了炎症细胞的浸润和脂肪组织中的炎症[19]。另有研究表明[20],Siglecg 缺陷抑制了TLR4 触发的促炎细胞因子的分泌,并增加了体内和体外IL‑10 的产生,提高了脓毒症小鼠存活率。ZGC 对LPS 结合巨噬细胞TLR4 激活炎症的干预,可能与下调Siglecg 基因,阻断C 型凝集素受体信号通路,抑制唾液酸结合密切相关。
Psma6,ZGC 药物组相对模型组表达下调,表达构成蛋白酶体α6 的亚基组分,与缺血性脑血管病密切相关,缺血性脑损伤引起的炎性反应会抑制蛋白酶体对有害蛋白的降解,引起泛素化底物堆积,导致脑细胞受损甚至死亡[21]。同时蛋白酶体也可以激活NF‑κB 信号通路[22],通过降解NF‑κB 的抑制因子IκB,使NF‑κB 激活并释放大量下游细胞炎性因子[23]。研究表明蛋白酶体抑制剂能通过抑制炎性反应减轻大鼠MCAO 模型的脑损伤[24]。提示ZGC可以通过下调Psma6 的表达,抑制巨噬细胞炎症的NF‑κB 信号通路激活,减轻炎症损伤。
综上所述,ZGC 可能通过上调C4bp 和下调Mgat3,抑制补体系统激活,减少中性粒和嗜酸性粒细胞炎性富集,同时配合下调Siglecg 和Psma6,抑制TLR4/NF‑κB 通路激活,降低TLR4 触发的促炎细胞因子的分泌,并增加IL‑10 的释放,促进巨噬细胞往M2 状态转变,改善巨噬细胞炎症,进而以炎症级联反应为对抗靶标,从整体上对脑缺血再灌注损伤[1]和脓毒症急性肺损伤产生保护作用。
4 结论
本研究采用巨噬细胞炎症模型,利用基因芯片技术重点探究ZGC 对LPS 诱导炎症巨噬细胞全基因组表达的影响,结果显示 ZGC 可干预炎性巨噬细胞C4bp、Mgat3、Psma6、Siglecg等27 个基因的异常表达,相关显著差异基因主要参与白细胞介导免疫调节、前列腺素分泌调节、突触膜、唾液酸结合、免疫受体活性等生物功能,影响细胞因子受体相互作用、CTLs 信号通路及TLR4/NF‑κB 等信号通路而发挥抗炎作用,这可能是ZGC 发挥抗巨噬细胞炎性损伤的重要关键靶标。该研究具有重要探索意义,为后续进一步实验明晰了新方向。
作者贡献度说明:
杨鸿:承担课题的经费,文章的设计和书写把关;江杰:承担数据的处理,图表的绘制和文章的书写修改及投稿;安婉丽:参与实验的操作和数据的处理;杨智倩:参与资料收集及文稿整理;程文慧:参与统计分析及文章修改。
所有作者声明不存在利益冲突关系。
