OPG/RANKL/RANK 信号通路在脓毒症相关急性肾损伤小鼠中的研究
2024-03-09陈蔚霖牛新荣
李 辉,陈蔚霖,牛新荣
(1.新疆医科大学,新疆 乌鲁木齐 830000;2.新疆维吾尔自治区人民医院,重症医学二科,新疆 乌鲁木齐 830000)
脓毒症(sepsis)是一种感染引起的生理、病理和生化异常为特征的综合征,其定义为宿主对感染的免疫反应失调[1],脓毒症发病过程中的死亡率与器官功能障碍的发展直接相关,在脓毒症并发的器官功能障碍中急性肾损伤(acute kidney injury,AKI)是最常见、最严重的,研究发现高达60%的脓毒症患者并发AKI,相比其他病因导致的AKI,与脓毒症相关的AKI 病人的死亡率显著增加[2],脓毒症相关急性肾损伤(sepsis associated acute kidney injury,SA‑AKI)可在短时间内迅速降低肾小球滤过率,导致氮类代谢产物蓄积,血清肌酐(Scr)明显升高,电解质和酸碱平衡紊乱,疾病进展迅速,预后差,是高度致残性和致死性疾病[3‑5]。脓毒症所致的急性肾损伤机制复杂,且目前对于SA‑AKI 仍然没有标准化的治疗策略,对于SA‑AKI 的治疗仍以肾脏替代治疗为主[6]。现阶段发现预防和治疗SA‑AKI 的新靶点将有效降低危重症患者的死亡率,因此,迫切需要进一步探索与SA‑AKI 病理生理过程相关的信号转导因子,为SA‑AKI 的机制研究提供新的思路,发现新的治疗靶点。
骨保护素(osteoprotectin,OPG)是肿瘤坏死因子超家族的成员,它由401 个氨基酸残基组成,有7个不同的结构域,其1 至4 结构域有破骨细胞生成抑制特性,5 和6 结构域有介导细胞凋亡的结构同源区,7 结构域由肝素结合区、二硫键以及二聚化所需的游离半胱氨酸残基组成[7]。核因子‑κB 受体活化因子配体(nuclear factor‑κB ligand,RANKL)最初在T 细胞和树突状细胞中被发现[8],由肿瘤坏死因子配体超家族成员11(TNFSF11)基因编码,是目前唯一已知的与膜受体结合的配体[9]。核因子‑κB 受体激活剂(receptor activator of nuclear factor‑κB,RANK)是肿瘤坏死因子受体超家族的Ⅰ型跨膜蛋白[10],RANKL 和RANK 结合后诱导受体的三聚化,可触发肿瘤坏死因子受体相关因子(TRAF)、衔接蛋白的募集和下游信号通路的激活[11,12],其中OPG又被称为RANKL 的诱饵受体,可与RANK 竞争性的结合RANKL,三者相互作用构建了一个调节系统[9]。既往的研究发现OPG/RANKL/RANK 信号通路参与骨稳态、免疫、肿瘤以及代谢性疾病的病理生理过程[13‑15],但在脓毒症相关急性肾损伤中鲜有报道,本研究旨在探讨该通路在脓毒症相关急性损伤中变化及可能的作用,为SA‑AKI 的机制研究探索新的思路。
1 材料和方法
1.1 主要试剂
肌酐(serum creatinine,Scr)、尿素氮(blood urea nitrogen,BUN)试剂盒(南京建成生物工程研究所);肿瘤坏死因子‑α(tumor necrosis factor‑α,TNF‑α)和白细胞介素(interleukins,IL‑6、IL‑1β)酶联免疫吸附试验(enzyme‑linked immunosorbent as‑says,ELISA)、RNA 提取和反转录以及聚合酶链反应(polymerase chain reaction,PCR)试剂盒(武汉科鹿生物科技有限公司);PCR 引物(上海生工生物工程有限公司),SDS‑PAGE 凝胶制备、BCA 蛋白质浓度测定、ECL 化学发光试剂盒(武汉阿斯本生物技术有限公司);β‑肌动蛋白(β‑actin)抗体(天德悦(北京)生物科技有限责任公司);OPG 抗体(美国Affinity Bioscience(艾菲)公司);RANKL 抗体(武汉三鹰生物技术有限公司);RANK 抗体(英国Ab‑cam 公司);辣根过氧化物酶标记的羊抗兔或抗鼠二抗(武汉阿斯本生物技术有限公司);HE 染色试剂盒(北京索莱宝生物科技有限公司)。
1.2 实验动物
选20 只8 周龄左右健康的C57BL/6 雄性小鼠,重量20~25 g,实验动物来自新疆医科大学动物实验中心,许可证号:SCXK(新)2018‑0001。小鼠在恒温(22~24 ℃)、光照/黑暗周期(12 h)环境的动物房适应性喂养3 d 后开始实验,实验操作前禁食8 h,不禁饮水。实验设计通过伦理审核,获得新疆医科大学动物实验中心伦理委员会审批(审批编号:IA‑CUC‑20230217‑18)。
1.3 实验动物模型的制备及分组
实验动物分组:按随机数字表法将实验小鼠分成2 组,每组10 只,即假手术组(Sham 组)和脓毒症组(CLP 组)。
建模:采用盲肠结扎穿孔手术(cecal ligation and puncture,CLP)制备脓毒症相关急性肾损伤模型:用5%水合氯醛0.06~0.08 mL/10 g 腹腔注射麻醉后,固定于手术台上,术区备皮及消毒,沿腹白线作正中切口 1~1.5 cm,翻找盲肠,将盲肠自腹腔移出,用4 号手术缝线距盲肠末端1 cm 处结扎,避免损伤血管,18 号针头贯穿盲肠远端两侧肠壁两次,挤出少量肠内容物,并将少量内容物留于腹腔,随后还纳腹腔,逐层缝合关腹;假手术组小鼠找出盲肠后随即还纳关腹。术毕所有实验小鼠立即颈背部皮下给予30 mL/kg 生理盐水进行液体复苏。
1.4 组织取材方式
术后密切观察小鼠状态,于造模后 24 h,用镊子摘除小鼠眼球留取静脉血约0.6~0.8 mL,室温下静置1 h 后,于4 ℃离心机3 000 r,15 min 后取血清保存−80 ℃冰箱备用,用于肾功能、炎性因子检测;采血后脱颈处死小鼠,留取小鼠左侧肾脏组织,于4% 多聚甲醛中固定,用于苏木精‑伊红(hematoxylin‑eosin,HE)染色,观察肾组织病理学变化;留取右侧肾脏组织,于−80 ℃冷冻保存,用于实时荧光定量聚合酶链反应(real‑time fluoresence quantitative polymerase chain reaction,RT‑qPCR)、蛋白质免疫印迹试验(Western blotting)检测。
1.5 检测指标及方法
1.5.1 肾功能Scr、BUN 水平测定:通过肌氨酸氧化酶法检测肌酐水平,脲酶法测定尿素氮水平,检测方法严格按照 Scr 测定试剂盒、BUN 测定试剂盒说明进行操作。
1.5.2 ELISA 测定血清炎症因子水平:取小鼠血清测定 TNF‑α、IL‑6 和 IL‑1β 含量,严格按照说明书进行操作。
1.5.3 苏木精‑伊红(HE)染色:取小鼠左侧肾脏组织,于4%多聚甲醛中固定72 h,在梯度浓度乙醇中脱水,随后包埋、切片、HE 染色、中性树胶封片,在显微镜下观察肾病理形态学改变。
1.5.4 RT‑qPCR:取小鼠右侧肾脏组织,在RNA 分离试剂(TRI)中充分研磨,从小鼠肾组织中提取总RNA,用逆转录试剂盒操作得到cDNA,单孔上样量2 μg,逆转录程序:25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min,扩增后进行qPCR,每孔上样量1 μL,同时设置3 个复孔,反应程序:95 ℃ 2 min,95 ℃5 s,60 ℃ 10 s,过程循环40 次。用2‑ΔΔCT法计算OPG、RANKL、RANK 的mRNA 表达水平。
1.5.5 Western blotting:取小鼠右侧肾组织剪碎,加入组织裂解液充分研磨提取总蛋白,通过BCA 检测肾组织蛋白浓度,随后电泳分离,每孔上样10 μL,转膜后封闭2 h,加入OPG(1∶1 000)、RANKL(1∶3 000)、RANK(1∶500)、β‑antin(1∶10 000)一抗后4 ℃孵育过夜,次日用TBST 缓冲液振荡清洗后加入二抗(1∶10 000)孵育半小时,曝光显影,用Im‑age J 软件分析目标蛋白表达量,结果用目标蛋白与内参条带灰度值比值表示。
1.6 统计学处理
运用SPSS 26.0 和GraphPad Prism 9.0 软件分析数据。计量资料有正态性,用(±s)表示,两组比较用t检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 血清Scr、BUN 水平
与Sham 组比较,CLP 组Scr、BUN 水平明显升高,两组小鼠Scr、BUN 比较,差异均具有统计学意义(P<0.05),表明CLP 术后小鼠出现脓毒症相关的肾功能损伤。见表1。
表1 血清Scr、BUN 结果(±s)Tab 1 Serum Scr, and BUN results(±s)

表1 血清Scr、BUN 结果(±s)Tab 1 Serum Scr, and BUN results(±s)
注:与Sham 组相比,P<0.05。
组别Sham 组CLP 组BUN(mmol/L)52.31±2.35 100.97±15.32 9.93<0.000 1 n 10 10 Scr(μmol/L)12.92±3.94 tP 74.03±27.28 7.01<0.000 1
2.2 均血清炎症因子水平
与Sham 组相比,CLP 组IL‑1β、TNF‑α、IL‑6 水平明显升高,两组小鼠血清炎症因子水平比较,差异均具有统计学意义(P<0.05),表明CLP 术后小鼠炎症因子水平显著增加,炎症反应显著。见表2。
表2 血清炎症因子结果(pg/mL,±s)Tab 2 Serum inflammatory factor results(pg/mL,±s)

表2 血清炎症因子结果(pg/mL,±s)Tab 2 Serum inflammatory factor results(pg/mL,±s)
注:与Sham 组相比,P<0.05。
组别Sham 组CLP 组n 10 10 TNF‑α(pg/mL)35.89±16.42 IL‑6(pg/mL)21.73±6.65 IL‑1β(pg/mL)36.02±12.54 104.87±20.11 9.19<0.000 1 118.15±24.30 64.9±13.62 9.02<0.000 1 tP 8.87<0.000 1
2.3 肾脏组织病理学变化
Sham 组小鼠的肾脏组织病理结构清晰,未见炎症细胞浸润及肾小球、肾小管坏死等异常病理表现(图1A、B);CLP 组小鼠肾小球部分缺血皱缩,球囊间隙扩大,肾小管中可见坏死脱落的上皮细胞,部分管腔扩大,肾间质不同程度水肿,少量炎性细胞浸润(图1C、D)。

图1 两组肾脏组织病理学 HE 染色图(200× ,400×)Fig 1 Pathological changes in kidney tissues of mouse(HE,200× ,400×)
2.4 肾脏组织中OPG、RANKL、RANK 的mRNA表达水平
与Sham 组相比,CLP 组肾脏组织中OPG 和RANK 的mRNA 表达显著上调(图2A、C),而RANKL 表达则明显下降(图2B),差异均具有统计学意义(P<0.05),表明可能是脓毒症时上调的OPG 结合了RANKL,使其表达水平下调。

图2 肾脏组织中OPG、RANKL、RANK 的mRNA 表达水平Fig 2 The mRNA expression levels of OPG, RANKL, and RANK in kidney tissues
2.5 肾脏组织中OPG、RANKL、RANK 蛋白表达水平
与Sham 组相比,CLP 组肾脏组织中OPG 及RANK 的蛋白表达明显升高(图3B、D),而RANKL的蛋白表达明显下降(图3C),差异均具有统计学意义(P<0.05),该实验的结果与PCR 的结果一致。
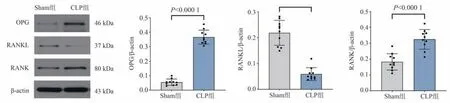
图3 肾脏组织中OPG、RANKL、RANK 的蛋白表达水平Fig 3 Protein expression levels of OPG, RANKL, and RANK in kidney tissues
3 讨论
在重症监护室(ICU)中脓毒症是一种常见疾病,表现为全身炎症反应并伴有严重的器官功能障碍,可累及全身多个脏器(如血管、肺、肝、肾、心脏和脑)常常危及患者生命[16]。用CLP 法建立脓毒症模型,结果显示,制模后小鼠麻醉苏醒延迟,24 h 后发现小鼠出现心率和呼吸频率快、毛发竖立、活力下降,萎靡等表现,血清Scr、BUN 较Sham 组明显升高,肾脏病理结果示肾小球球囊间隙扩大,肾小管上皮细胞不同程度坏死,肾间质可见少量炎性细胞浸润,提示脓毒症小鼠模型建立成功并伴有AKI;SA‑AKI 的发病机制极其复杂,目前研究发现,在脓毒症并发急性肾损伤过程中,炎症反应起着重要作用[17],本研究的结果显示脓毒症组中TNF‑α、IL‑6、IL‑1β 水平显著升高,提示存在严重的炎症反应,与上述研究发现一致,表明SA‑AKI 过程中炎症反应起着重要的作用。
骨保护素属于肿瘤坏死因子超家族,在心脏、肾脏、肺、肝、骨髓、骨和免疫系统等多种组织中表达,最早因参与骨稳态调节而闻名[18,19];最新的研究发现OPG 还参与了炎症反应过程,在心血管疾病中OPG 可以促进血管壁炎症的发生,并增加白细胞与血管内皮的粘连,加重炎症反应过程[20,21],OPG 浓度的增加是导致动脉粥样硬化促炎过程的一个标志[22],还有研究发现OPG 在炎症性肠病中直接参与炎症过程[23]。在肝硬化继发的急性肾损伤中,随着血清 OPG 水平升高急性肾损伤分期也逐步增加,OPG 加重了肝硬化继发急性肾损伤的程度[24]。近期的两项临床研究也发现,OPG 在全身炎症反应综合征(SIRS)时显著升高,并可预测SIRS 患者30 天死亡率[25],同时在SA‑AKI 患者的血清中循环OPG显著升高,且发现OPG 加重了SA‑AKI 时炎症级联反应[26]。在本研究中CLP 组小鼠血清中炎性因子较Sham 组明显升高,肾脏组织中OPG 的mRNA 及蛋白表达较Sham 组明显升高,肾脏病理显示炎性细胞浸润,与上述研究结果一致,表明OPG 参与了SA‑AKI 的过程,且可能通过增加炎症级联反应,加重了脓毒症所致急性肾损伤。
近期研究发现核因子‑κB 受体活化因子配体(RANKL)与核因子κB 受体激活剂(RANK)结合后具有强大的抗炎保护作用[27],当外源性应用重组RANKL 可上调白细胞介素‑10(IL‑10)在浅表感染组织的mRNA 的表达,抑制局部炎症反应[28]。在脂多糖(LPS)处理的小鼠血清中可检测到可溶性RANKL 和OPG,且RANKL 水平显著下调,而OPG 水平则明显上调,发现RANKL 可以抑制巨噬细胞中促炎细胞因子的产生,相反在缺乏RANKL基因的小鼠中,促炎细胞因子的产生显著增加,而在缺乏OPG 基因的小鼠中,促炎细胞因子产生减少,炎症反应更轻[29],本研究结果与之一致。在Mo‑ta 等[30]的研究中也发现了这一点,证实了RANKL与RANK 结合后可以促进TRAF6 和RANK 之间的结合,从而抑制Toll 样受体4(TLR4 )激活,可显著的降低炎症反应的过程,而OPG 通过阻断RANKL 与RANK 结合可显著加重炎症反应。在缺血性脑卒中的研究中,通过体内动物实验和体外细胞再次得到证实,用重组RANKL 增强了RANKL/RANK 信号传导,可以使炎性因子下调,而上调的OPG 阻止 RANKL/RANK 信号传导,从而增加缺血后炎症反应[31,32]。在本研究中CLP 组肾脏组织中RANKL 的表达较Sham 组下调,OPG 的表达明显上调,炎症因子水平明显升高,炎症反应更加显著,病理结果示肾小球球囊壁间隙扩大,肾小管中可见坏死的上皮细胞,间质见炎性细胞,综上OPG/RANKL/RANK 信号通路在SA‑AKI 过程中发生变化,表明其可能参与SA‑AKI 病理生理过程。
综上所述,本研究结果显示在SA‑AKI 中OPG及RANK 表达上调,RANKL 表达下调,此改变说明OPG/RANKL/RANK 信号通路可能参与了SA‑AKI 的过程,且OPG 可能通过阻断RANKL 与RANK 的结合增加炎症反应,加重急性肾损伤,因此为SA‑AKI 的机制研究提供一个新的思路方向。本研究还存在不足之处,首先样本量小,缺乏临床研究数据,其次还需针对OPG 或者RANKL 与RANK 结合的干预实验进一步明确其在脓毒症相关急性肾损中的信号转导机制,这也是下一步研究的重点。
作者贡献度说明:
李辉 :负责参与实验、收集数据并分析、查阅文献及论文撰写 ;陈蔚霖:负责实验试剂和相关耗材购买,并参与实验;牛新荣:负责课题设计、实验指导及文章写作指导,
所有作者声明不存在利益冲突关系。
