基于高遗传转化率及低幼苗玻璃化率的黑果枸杞叶片组合培养体系
2024-03-08乌日恒王美珍刘雪锋
闫 婷 ,乌日恒 ,鲁 敏 ,杨 荣 ,王美珍 ,刘雪锋,3
(1 内蒙古自治区林业科学研究院,呼和浩特 010010;2 内蒙古自治区黑果枸杞工程[技术]研究中心,呼和浩特 010010;3 内蒙古自治区沙地[沙漠]生态系统与生态工程重点实验室,呼和浩特 010010)
黑果枸杞(Lycium ruthenicumMurr.)属于茄科(Solanaceae)枸杞属(Lycium),主要分布在中国宁夏贺兰山、青海东部、新疆北部、内蒙古西部、陕西北部、甘肃和西藏等干旱、盐碱化程度较高的荒漠与半荒漠地区[1]。黑果枸杞浆果富含花色苷、多酚、多糖等物质,尤其是原花青素类物质含量高达5%左右[2]。随着黑果枸杞抗逆基因挖掘、果实发育机制以及花青素合成与积累等研究的深入,其基因功能及种质遗传改良成为研究热点。目前,已报道的黑果枸杞遗传转化体系效率普遍偏低(约为16%左右)[3-4]。此外,在黑果枸杞遗传转化过程中,会产生大量玻璃化幼苗,其组织结构异常,生根移栽成活十分困难,对组培资源造成极大浪费,是遗传转化工作中亟待解决的一大难题[5-6]。任红旭等[7]报道,在农杆菌介导黑果枸杞遗传转化体系研究中愈伤组织分化之后的再生幼苗产生了大量玻璃化现象;戴逢斌等[8]配制了一系列黑果枸杞快繁培养基,虽然克服了以茎段为外植体产生的玻璃化现象,但并未明确在遗传转化过程中是否可以用同样方法克服黑果枸杞玻璃化;张佳琪等[9]发现添加适量浓度精胺可以显著降低黑果枸杞幼苗的玻璃化率,但并未在农杆菌转化体系中进行进一步探讨。因此,建立高效稳定的遗传转化体系,有效降低黑果枸杞再生幼苗玻璃化率,突破靶标基因低效递送的遗传转化瓶颈,是黑果枸杞基因功能研究和遗传改良的重要前提条件。为此,本研究利用农杆菌介导的黑果枸杞幼苗叶片遗传转化的方法,优化改进黑果枸杞遗传转化组合培养基,并筛选到合适的农杆菌种类及适宜的侵染条件和侵染方法,使黑果枸杞的遗传转化率达65%以上,降低再生幼苗玻璃化率至10%以下,为黑果枸杞分子育种奠定了基础。
1 材料和方法
1.1 试验材料
黑果枸杞果实采自内蒙古巴彦淖尔市磴口县黑果枸杞资源圃,以新鲜果实中分离出的种子作为试验材料;质粒p BI121-p35s∷GUS为内蒙古大学生命科学学院哈达教授惠赠;农杆菌热激感受态LBA4404、EHA105购自北京庄盟国际生物基因科技有限公司;引物合成由南京金斯瑞生物科技有限公司完成;卡那霉素(Kanamycin,Kan)、特美汀(Timentin,Tim)、头孢霉素(Cefotaxime Solution,Cef)、利福平(Rifampicin,Rif)等抗生素及β-葡萄糖苷酸酶(beta-glucuronidase,GUS)染色试剂盒购自北京酷来博科技有限公司。
1.2 试验方法
1.2.1 种子萌发及叶片外植体预培养
将黑果枸杞种子用70%乙醇浸泡30 s,再用0.1%氯化汞处理6~8 min,然后用灭菌的dd H2O 冲洗种子4~5次,播种于WPM(woody plant medium)培养基(p H=6.0)中萌发。培养30 d后,将黑果枸杞无菌幼苗叶片剪成1 cm 方块,正面朝上,接种于预培养培养基(pre-culture medium,PM)中预培养2 d。
1.2.2 冻融法转化农杆菌感受态细胞
取1μL(200 ng/μL)pBI121-p35s∷GUS(简称,pBI121)大肠杆菌质粒分别混入20μL LBA4404或EHA105农杆菌热激感受态中,进行热激转化;对转化后的农杆菌单菌落进行PCR 阳性检测,根据GUS基因(β-葡萄糖苷酸酶编码基因)序列设计引物,引物扩增长度398 bp,扩增片段退火温度为60℃。引物序列:GUS-F,5′-TCACAGCCAAAAGCCAGACA-3′,GUS-R,5′-TTGCTGAGTTTCCCCGTTGA-3′。筛选出含有pBI121 载体的阳性LBA4404和EHA105单克隆菌株,侵染备用。
1.2.3 农杆菌培养与外植体侵染
将-80℃冻存的农杆菌菌液LBA4404(包含pBl121载体)和EHA105(包含pBl121 载体)接种到添加相应抗生素的YEB(yorkshire electricity board)液体培养基中培养。28℃条件下,180 r/min摇菌24~48 h,待农杆菌浓度达到OD600>1.0时,离心收集农杆菌菌体,弃上清,并用侵染液轻柔重悬菌体,用紫外分光光度计测定农杆菌菌液浓度。50 m L侵染液配制方法:添加1/4 MS(1/4 Murashige&Skoog medium)液体培养基约49 m L,1 mol/L MES 0.5 m L,1 mol/L MgCl20.5 m L,200 mmol/L乙酰丁香酮50μL。试验设置农杆菌菌株、菌液浓度和侵染时间3个因素。其中,侵染所用农杆菌选用LBA4404菌株和EHA105 菌株;农杆菌侵染液终浓度(OD600)设定为0.4、0.6、0.8 3个水平;侵染时间设定15 min、25 min、35 min 3个梯度。3个因素共组成18个组合处理(2×3×3),每个侵染处理10瓶预培养的叶片外植体,每个试验重复3次。
1.2.4 黑果枸杞遗传转化
制备不同浓度的农杆菌侵染液,浸泡预培养2 d后的叶片外植体,以不同侵染时间进行侵染,侵染结束后,收集侵染叶片,在共培养培养基(co-culture medium,COM)中放入1张灭菌滤纸,将叶片外植体置于该滤纸之上,26℃避光共培养3 d;共培养结束后,将共培养物先用灭菌水清洗5~6次,再用移液枪吹打500 mg/L头孢溶液清洗2次,每次3~4 min,最后用无菌水冲洗3 次,继而用滤纸将水吸干,转移至含有抗生素的愈伤组织诱导培养基(callus-induction medium,CIM)上培养约28 d;将抗性愈伤组织转移到分化选择培养基(differentiation and selective medium,DSM)中,每个处理接种10瓶,每瓶接种3~4个愈伤,试验重复3次,培养28 d左右;将再生幼苗从愈伤组织上切下,插入生根培养基(rooting medium,RM)中,每次接种10瓶,每瓶接种4~5个愈伤,试验重复3次,生根培养时间14~28 d;将适宜大小的再生植株移土炼苗。试验采用的遗传转化用组合培养基主要包括预培养培养基、共培养培养基、愈伤诱导培养基、分化选择培养基和生根培养基,每种培养基组成如表1所示。

表1 黑果枸杞叶片外植体遗传转化用组合培养基Table 1 The combined media for genetic transformation of leaf explants of L.ruthenicum
1.2.5 再生植株移栽炼苗
将黑果枸杞再生幼苗从培养瓶中取出,剥离培养基,再将生根幼苗移栽至营养土中,置于光照培养箱中,用扎眼的透明塑料杯覆盖幼苗保持周围环境湿润,10 d后去除塑料杯,植株可以正常存活。培养箱内的环境条件:光周期为16 h/8 h(昼/夜),相对湿度为60%,温度为22~24℃,日光灯光照强度2 000 lx。从培养瓶中移苗的同时另取幼苗叶片检测GUS活性,验证转基因阳性植株。
1.2.6 GUS活性检测
在遗传转化的每一个过程(侵染后外植体叶片、愈伤组织、再生抗性芽、移植幼苗叶片等),均分别取相关组织进行GUS活性检测。按GUS 染色试剂盒(货号:SL7160)说明书进行GUS染色液配制及染色,最后用95%乙醇进行脱色,直到将全部叶绿素洗脱干净后,拍照。
将移植幼苗叶片进行3次重复检测,认定3次检测均为阳性的植株为最终转基因阳性苗,通过转基因阳性苗推测阳性愈伤的数量,并计算转化率[(阳性愈伤数量/转化总接种叶片数)×100%]。
1.2.7 数据分析
数据采用Origin 2017软件统计分析。
2 结果与分析
2.1 农杆菌单克隆菌株阳性检测
将大肠杆菌质粒p BI121以热激法转化农杆菌感受态菌株LBA4404和EHA105,挑取农杆菌单菌落进行PCR,鉴定阳性菌株。结果(图1)显示,经GUS-F/R引物PCR扩增后获得398 bp大小的条带。取2号和3号单菌落保菌,-80℃冻存,用于后续黑果枸杞叶片的侵染试验。
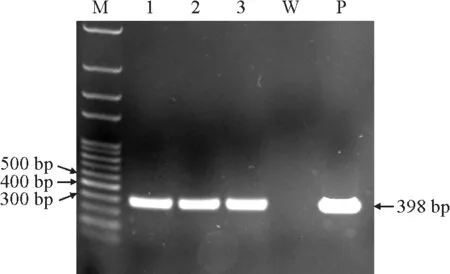
M.100 bp PlusⅡDNA 标记;1.大肠杆菌p BI121;2.转化后的农杆菌LBA4404-PBI121单菌落;3.转化后的农杆菌EHA105-PBI121单菌落;W.dd H2 O;P.p BI121质粒GUS序列扩增图。图1 阳性农杆菌LBA4404-PBI121和EHA105-PBI121菌株鉴定M,100 bp PlusⅡDNA marker.1,Escherichia coli pBI121.2,single colony of transformed LBA4404-PBI121.3,single colony of transformed EHA105-PBI121.W,dd H2 O.P,amplification of GUS fragment of pBI121 plasmid.Fig.1 Identification of the positive LBA4404-PBI121 and EHA105-PBI121 strains
2.2 黑果枸杞叶片外植体最适侵染条件的筛选
确定侵染条件是遗传转化中至关重要的一步,不仅涉及到侵染后的叶片状态、死亡率(包括污染率和侵染浓度过大后外植体软烂个体),还需综合考虑外植体在愈伤诱导培养基上抗性愈伤产生的数目和状态。本研究中使用1/4 MS液体培养基代替dd H2O以调节侵染液的渗透压,而乙酰丁香酮的加入可以诱导农杆菌Vir区基因的活化与表达,从而使农杆菌TDNA更易进入植物基因组,并与其整合[10]。
从表2可知,在农杆菌浓度(OD600)为0.6,侵染时间为25 min 时,农杆菌LBA4404-p BI121 和EHA105-p BI121侵染外植体死亡率分别为5.8%和13.2%,而抗性愈伤诱导率分别为96%和78.2%。

表2 不同农杆菌侵染条件下黑果枸杞叶片外植体愈伤诱导情况Table 2 The callus-induction rate of leaf explants of L.ruthenicum infected by A grobacterium strains under different conditions
通常情况下,EHA105 菌株比LBA4404 菌株具有较强的侵染毒性[11],而本研究中黑果枸杞叶片外植体受到农杆菌EHA105-p BI121 和LBA4404-pBI121侵染表现出的存活率及抗性愈伤大小的差异也可以证明这一点。所以,以侵染后外植体死亡率(或存活率)和抗性愈伤诱导率作为评价指标,黑果枸杞叶片外植体农杆菌侵染的最适条件是农杆菌终浓度(OD600)为0.6,侵染时间为25 min,在此条件下共培养后的供试叶片外植体移入愈伤诱导培养基中,抗性愈伤诱导率为78.2%~96%。
2.3 黑果枸杞再生幼芽最适分化选择培养基的筛选
在抗性愈伤组织形成之后,再生幼苗的形成、正常分化和发育是提高遗传转化率的关键因素。本研究将抗性愈伤组织接种到以MS(DSM1)、MSF(DSM2)、WPM(DSM3)和WPF(DSM4)为基础的培养基中,各培养基均附加激素6-BA 0.25 mg/L,以此在抗性愈伤组织中检测其培养和分化效果。
结果(表3)表明,经农杆菌LBA4404-pBI121和EHA105-pBI121 侵染过后,愈伤组织出芽数量与愈伤数量的比值在DSM2 培养基中分别达到3.20和4.82,与DSM1、DSM3、DSM4培养基差异显著;尤其是在卡那霉素的筛选压力下,农杆菌LBA4404-pBI121 和EHA105-p BI121 处理后 在DSM2培养基中形成的再生芽增殖倍数分别达3.20倍和5.63倍,与在DSM1、DSM3、DSM4培养基上幼芽的发育情况具有显著差异。

表3 不同农杆菌侵染后黑果枸杞叶片外植体在不同分化选择培养基中出芽情况Table 3 Comparisons of budding of leaf explants of L.ruthenicum on different differentiation and selection media after infection with different Agrobacterium tumefaciens
因此,DSM2培养基在抗性愈伤组织芽体分化和选择水平上极具优势。同时,以农杆菌EHA105-pBI121侵染后的叶片外植体生长状态为例(图2),DSM1与DSM2 培养基上再生幼苗的数量明显多于DSM3和DSM4培养基。此外,DSM1与DSM2培养基上再生幼苗叶片颜色呈现绿色而非紫色,其原因可能是由于DSM1 与DSM2 培养基比DSM3和DSM4培养基中添加了更多的氮素,而氮素的丰缺与叶片中叶绿素的含量有着密切的关系。袁海静等[12]研究表明,枸杞具有较强铁元素吸收和积累能力。本研究中将Fe盐母液添加到分化培养基中,意外发现在不影响再生苗发生率的同时,幼苗变得更绿更茁壮。

A.DSM1培养基;B.DSM2培养基;C.DSM3培养基;D.DSM4培养基。图2 黑果枸杞叶片外植体在不同分化选择培养基中再生幼苗发育情况A.DSM1 medium.B.DSM2 medium.C.DSM3 medium.D.DSM4 medium.Fig.2 Development of the regenerated seedlings from leaf explants of L.ruthenicum on different differentiation and selection media
因此,以MS为基础培养基,配合相应的植物激素,再添加Fe盐母液等成分,组成了黑果枸杞最适分化选择培养基,即DSM2培养基。
2.4 黑果枸杞再生幼苗最适生根培养基的筛选
再生幼苗从愈伤组织上切下后,分别接种到以1/2 MS、WPM 和MS为基础的RM1、RM2和RM3培养基中,各培养基均附加激素IBA 0.25 mg/L,以此筛选最适生根培养基。在遗传转化过程中,更高的生根率、更好的植株生长和发育状态可以极大提高植株成活率。本研究中将农杆菌EHA105-pBI121侵染后的黑果枸杞再生幼苗剪切下来,分别接种到RM1、RM2和RM3生根培养基中,其再生幼苗生长情况如图3所示。黑果枸杞再生幼苗培养7 d后即可显示出不同生根培养基在幼苗生长中产生的差异。其中,从幼苗生长状态来看,RM2培养基中叶片颜色正常;从再生苗根部发育情况看,RM1与RM2培养基中,再生幼苗已经开始发育出不定根,尤其以RM2生根培养基中根系发育最为旺盛,而生根组合RM3培养基中幼苗在接种7 d内几乎无根系生长。

A1、B1、C1.再生苗7 d的叶片发育情况;A2、B2、C2.再生苗7 d的生根情况;A3、B3、C3.再生苗21 d的生根情况。图3 黑果枸杞再生幼苗在不同生根培养基(RM1,RM2,RM3)中生根及发育情况A1,B1,C1.Leaves development of the regenerated seedlings for 7 days.A2,B2,C2.Rooting of the regenerated seedlings for 7 days.A3,B3,C3.Rooting of the regenerated seedlings for 21 days.Fig.3 Rooting and development of the regenerated seedlings of L.ruthenicum on different rooting media(RM1,RM2,RM3)
从黑果枸杞再生幼苗在生根培养基中培养21 d后的根系发育统计情况(表4)来看,再生幼苗生根率在RM2 培养基中为81.23%,分别比RM1 和RM3培养基显著提高94.93%和274.84%;而再生苗生根数量与生根苗数量之比在RM2培养基中为14.37,同样显著高于RM1和RM3培养基。

表4 黑果枸杞再生幼苗在不同生根培养基中根系发育情况Table 4 Root development of the regenerated seedlings of L.ruthenicum on different rooting media
同时,RM1培养基上再生幼苗生根率及生根数量与生根苗数量之比均显著高于RM3培养基。因此,以WPM 培养基为基础培养基、添加IBA 激素0.25 mg/L的RM2为黑果枸杞再生幼苗最适生根培养基。
2.5 不同农杆菌侵染对黑果枸杞再生芽发育和生根的影响
由于菌株侵染毒性有所不同,农杆菌LBA4404-pBI121和EHA105-p BI121在侵染外植体后的愈伤诱导阶段,在愈伤形成率和愈伤组织的大小方面显示出差异(表1);在最适分化选择培养阶段,二者农杆菌处理形成的抗性愈伤出芽率分别为100.00%和85.70%(表3)。但值得关注的是,虽然供试农杆菌毒性有所差异,但在一定范围内,农杆菌EHA105-pBI121的活性似乎强于农杆菌LBA4404-p BI121:尽管经过农杆菌EHA105-pBI121处理的叶片外植体产生的愈伤组织数量较农杆菌LBA4404-pBI121处理少,但其黑果枸杞抗性愈伤组织产生了更多的再生幼芽;而在再生幼芽发育成幼苗阶段,农杆菌LBA4404-p BI121侵染的叶片外植体产生的黑果枸杞幼苗玻璃化率约为65.03%,而农杆菌EHA105-p BI121侵染的叶片外植体产生的幼苗玻璃化率仅为9.30%左右(表3、图4)。

A.农杆菌LBA4404-pBI121;B.农杆菌EHA105-p BI121。图4 不同农杆菌侵染对黑果枸杞再生芽发育的影响A.Agrobacterium LBA4404-pBI121.B.Agrobacterium EHA105-p BI121.Fig.4 Effects of infection by different Agrobacterium strains on the development of the regenerated buds of L.ruthenicum
幼苗生根与植株移栽成活率密切相关。从图5可看出,在不同农杆菌侵染过后,黑果枸杞再生幼苗在最适生根培养基上生根率和生根苗数均无显著差异,而农杆菌EHA105-p BI121 侵染处理的幼苗数量和生根总数与生根苗数量比值均显著高于农杆菌LBA4404-pBI121处理。其中,再生苗生根总数与生根苗数量的比值在农杆菌EHA105-pBI121和LBA4404-pBI121侵染处理后分别为14.6 和3.07,EHA105-pBI121具有明显优势。

图5 在最适生根培养基上不同农杆菌侵染黑果枸杞再生幼苗的生根情况Fig.5 Rooting of the regenerated seedlings of L.ruthenicum infected with different Agrobacterium strains on the optimal rooting media
2.6 GUS活性检测
本研究在农杆菌侵染黑果枸杞叶片外植体后第3天(A 阶段)、抗性愈伤组织形成后(B 阶段)、再生幼芽(C阶段)及再生幼苗炼苗移栽后(D 阶段)的4个时期,分别对植物组织进行GUS活性检测,结果(图6)在上述4个阶段中,每一阶段测试的植物组织均有GUS表达。其中,在侵染结束后3 d,外植体叶片上即产生深蓝色斑点,说明两种测试农杆菌侵染效果良好(图6,A1、A2);接着又随机挑取已经在愈伤诱导培养基上生长21 d的愈伤组织进行GUS染色,在愈伤组织边缘可见蓝色组织块(图6,B1、B2),这说明在愈伤组织形成过程中,带有GUS活性的细胞进行了大量增殖,并在增殖细胞中GUS基因持续表达;在分化选择培养期间,再生幼芽开始发育,切取幼芽进行GUS活性检测,发现再生幼芽细胞当中也产生了有活性的GUS蛋白(图6,C1、C2);再生幼苗炼苗后,将每株再生植株进行标号,取其叶片,分别进行GUS染色,从而确定转基因植株。

A1、B1、C1、D1分别为农杆菌LBA4404-p BI121侵染后叶片外植体、抗性愈伤组织、再生芽GUS染色及其再生幼苗,而A2、B2、C2、D2分别为农杆菌EHA105-p BI121侵染后叶片外植体、抗性愈伤组织、再生芽GUS染色及其再生幼苗。E为转基因阳性植株炼苗移栽。F1和F2分别为农杆菌LBA4404-p BI121和EHA105-p BI121侵染后转基因植株叶片GUS稳定表达。图6 农杆菌介导的黑果枸杞叶片外植体遗传转化各阶段中GUS活性检测A1,B1,C1,D1 are GUS staining of leaf explants,callus,regeneration bud and regeneration seedlings after infection with LBA4404-p BI121 Agrobacterium,while A2,B2,C2,D2 are GUS staining of leaf explants,callus,regeneration bud and regeneration seedlings after infection with EHA105-p BI121 Agrobacterium.E are positive transformation lines transferred to soil.F1 and F2 stand for stable GUS expression in the leaves of transgenic lines infected with LBA4404-pBI121 and EHA105-p BI121 Agrobacterium,respectively.Fig.6 GUS activity assay in different stage of Agrobacterium-mediated transformation of L.ruthenicum leaf explants
为了确定整个黑果枸杞组合培养体系的遗传转化率,从愈伤组织上切割幼苗时,将同一个愈伤组织产生的幼苗单瓶培养并标记,直至最终移栽后,通过统计阳性幼苗数量,计算转基因阳性愈伤数量。将阳性的愈伤数量/总接种叶片数比值作为本体系遗传转化效率评价指标。结果(表5)表明,农杆菌LBA4404-p BI121 侵染后幼苗成活率为93%(80/86),遗传转化率约为51.02%;农杆菌EHA105-p BI121侵染后幼苗成活率为96%(96/100),遗传转化率为65.22%。因此,农杆菌EHA105-pBI121侵染后幼苗无论从成活率还是遗传转化率方面都为优选农杆菌。

表5 2种农杆菌菌株处理下黑果枸杞遗传转化情况Table 5 Genetic transformation of L.ruthenicum infected by two different Agrobacterium strains
3 讨论
侵染过程是遗传转化中至关重要的一步,在保证外植体处于正常生长状态的同时,需要将农杆菌中携带目的基因的T-DNA 尽可能地与外植体细胞进行整合,同时在整合的过程中需要外植体与农杆菌密切配合,才能达到最佳平衡状态。而不适宜或较为敏感的外植体会因农杆菌侵染强度过大,导致侵染之后即产生软、烂形态,无法形成愈伤组织;若农杆菌菌液浓度太低,虽外植体发育正常,但容易导致抗性愈伤弱小或遗传转化率下降。在植物基因工程中,农杆菌LBA4404[3,13]、GV3101[4,14-15]、EHA101[13]、EHA105[3,16]均为常用遗传转化农杆菌菌株。其中,农杆菌GV3101、EHA101和EHA105菌株均为C58型遗传背景,而农杆菌EHA105菌株是一种侵染毒性稍强的根癌农杆菌类型[11],农杆菌LBA4404菌株为Ach5型遗传背景,这种类型侵染毒性较弱。本研究参考前人已报道的枸杞遗传转化效率较好的菌株类型[3-4,13-16],并且根据这些不同类型菌株的侵染毒性和遗传背景差异,最终筛选出2 种农杆菌LBA4404和EHA105菌株进行试验。
本研究中,黑果枸杞叶片外植体在最适侵染条件下,经过农杆菌EHA105-p BI121 侵染的外植体成活率较LBA4404菌株的略低,抗性愈伤组织生长形态相对较小,但在本研究中发现,前期抗性愈伤组织的形态大小似乎并不影响外植体在分化选择阶段再生幼苗的发育。在黑果枸杞再生幼苗的形成、分化和发育过程中,可能需要大量的氮素,而MS培养基中更多氮素的添加给幼苗提供了更多可以产生叶绿素的原料,因此以MS培养基为基础的分化选择培养基更适于再生幼苗的分化。袁海静等[12]研究表明,将宁夏枸杞生根培养基中添加2倍的铁盐溶液和有机成分可诱导宁夏枸杞外植体生根,并且对其生长起到明显的促进作用。本研究中也发现,黑果枸杞在再生芽分化和选择培养阶段,也显示出了较强的铁吸收特性,因此DSM2培养基为最适分化选择培养基。
WPM 培养基是用于木本植物组织培养的低盐培养基。WPM 培养基相对MS培养基而言,用硫酸钾替换了硝酸钾,硝酸铵含量降低到了MS培养基的1/4,氮素主要以硝酸钙的形式供应。包振华等[17]研究发现,宁夏枸杞茎段外植体在1/2 MS培养基中的生根率高于MS培养基,相关研究也证明了这一点[8,18]。而本研究表明,黑果枸杞再生幼苗在WPM 低盐培养基中的生根率是1/2 MS培养基生根率的2倍左右。
在黑果枸杞遗传转化过程中,大量玻璃化幼苗是在组织培养过程中引起的生理失调现象[16]。目前,黑果枸杞或枸杞组培苗玻璃化的影响因素主要有6-BA 浓度[8,20]、蔗糖浓度[8,20]、琼脂浓度[8,20]、培养温度[8,19-20]、光照时间[8,19-20]。在考虑到以上环境因素影响的前提之下,本研究用同属于细胞分裂素的激动素6KT 代替了部分苄氨基嘌呤(6-BA),防止6BA 浓度过高引起的玻璃化现象;在优化黑果枸杞遗传转化体系的过程中,发现遗传背景不同的农杆菌可能会影响黑果枸杞幼苗玻璃化形成率。本研究结果表明,农杆菌LBA4404 和EHA105 均适用于黑果枸杞的遗传转化,其遗传转化率均可获得50%以上的转基因植株,但综合考虑时间成本和经济成本,农杆菌EHA105介导的黑果枸杞遗传转化培养体系应为最适方案,该方案可使黑果枸杞遗传转化率达到65%以上,分化幼苗玻璃化率降低至10%以下。
4 结论
黑果枸杞叶片高效组合培养体系包括:叶片外植体遗传转化用菌株为农杆菌EHA105,最适侵染农杆菌终浓度(OD600)为0.6,侵染时间为25 min;预培养和共培养培养基为WPM+6-BA 0.3 mg/L+NAA 0.3 mg/L+6KT 0.2 mg/L+蔗糖30 g/L+琼脂6 g/L;最适愈伤诱导培养基为WPM+肌醇50 mg/L+烟酸0.25 mg/L+维生素B60.25 mg/L+Fe盐母液1 m L/L+甘氨酸1.0 mg/L+维生素B10.05 mg/L+6-BA 0.3 mg/L+NAA 0.3 mg/L+6KT 0.2 mg/L+蔗糖30 g/L+琼脂6 g/L+Kan 30 mg/L+Tim 300 mg/L(p H=6.0);再生幼芽最适分化与诱导培养基为MS+肌醇50 mg/L+烟酸0.25 mg/L+维生素B60.25 mg/L+铁盐母液1 m L/L+甘氨酸1.0 mg/L+维生素B10.05 mg/L+6-BA 0.25 mg/L+蔗糖30 g/L+琼脂6 g/L+Kan 30 mg/L+Tim 300 mg/L(p H=6.0);再生幼苗最适生根培养基为WPM+IBA 0.25 mg/L+蔗糖30 g/L+琼脂6 g/L+Kan 30 mg/L+Tim 300 mg/L (p H=6.0)。
