CT影像组学识别非酒精性脂肪性肝炎的应用研究
2024-03-08胡艳宋侨伟
胡艳 宋侨伟
[摘要] 目的 構建并验证基于CT的全肝影像组学模型用于识别非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)。方法 回顾性选取2018年6月至2022年12月浙江省人民医院收治的122例非酒精性脂肪性肝病患者,其中NASH患者52例。将纳入患者按7:3比例随机分为训练组(n=85)和测试组(n=37),选取每例患者的肝脏平扫图像提取影像组学特征,对训练组提取的特征进行降维并建立影像组学标签,之后联合相关临床特征构建联合预测模型用于识别NASH患者,使用受试者操作特征曲线及测试组数据评估模型的诊断效能。结果 联合预测模型基于年龄和影像组学标签构建,该模型在训练组和测试组中识别NASH患者的诊断效能分别为0.899和0.880,特异性分别为91.2%和88.1%,敏感度分别为86.7%和88.2%。校准曲线在训练组和测试组中也显示出良好的校准性能。结论 基于肝脏CT的影像组学模型可定量评估NASH,有望为临床提供一种无创性评价工具。
[关键词] 计算机体层扫描;非酒精性脂肪性肝炎;非酒精性脂肪性肝病;影像组学;预测模型
[中图分类号] R575 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.04.014
Application study of non-alcoholic steatohepatitis based on radiomics of computed tomography
HU Yan1, SONG Qiaowei2
1.Department of Gastroenterology, Hangzhou Shangcheng District Peoples Hospital, Hangzhou 310009, Zhejiang, China; 2.Department of Radiology, Zhejiang Provinical Poples Hospital, Hangzhou 310014, Zhejiang, China
[Abstract] Objective To construct and validate a whole liver radiomics model based on computed tomography (CT) to identify patients with non-alcoholic steatohepatitis (NASH). Methods A total of 122 patients with nonalcoholic fatty liver disease treated in Zhejiang Provincial Peoples Hospital from June 2018 to December 2022 were retrospectively selected, including 52 patients with NASH. They were randomly divided into training group (n=85) and test group (n=37) according to a ratio of 7:3, and the liver plain scan images of each patient were selected to extract the radiomics features. The extracted features of the training group were dimensioned down and the radiomics signature was established. After that, a joint model was constructed with relevant clinical features to identify NASH patients, and the diagnostic effectiveness of the model was evaluated using receiver operating characteristic curve and test group data. Results The joint model was constructed based on age and radiomics labels. The diagnostic efficiency of the model for identifying NASH patients in training group and test group were 0.899 and 0.880, the specificity were 91.2% and 88.1%, and the sensitivity were 86.7% and 88.2%, respectively. In addition, the calibration curve also showed good calibration performance in training group and test group. Conclusion The joint model based on liver CT can quantitatively evaluate NASH, and is expected to provide a non-invasive evaluation tool for clinical use.
[Key words] Computed tomography; Non-alcoholic steatohepatitis; Nonalcoholic fatty liver disease; Radiomics; Prediction model
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)已成為全球最常见的慢性肝病之一,其患病率与肥胖、糖尿病和高血压等代谢性疾病密切相关[1]。NAFLD通常无症状,但其亚型非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)可进展为肝硬化甚至肝细胞癌[2]。肝穿刺活检一直是诊断NAFLD和NASH的金标准,但其为侵入性操作,具有潜在的并发症和一定的局限性。目前,CT已广泛用于评估肝脂肪含量和肝脏炎症,然而传统CT扫描在诊断NAFLD尤其是NASH存在一定的局限性[3]。影像组学作为一种大数据分析方法已广泛应用于影像学领域,它可深入挖掘和整合图像信息,并客观评估图像特征[4]。已有研究将其用于肝纤维化的CT图像分析并取得成功[5-6]。然而,这些方法均是针对肝脏的单个横截面或更小的感兴趣区进行测定,并未获取全肝的影像学信息,而全肝的影像组学分析或可提供更全面的肝脏信息。本研究基于CT的全肝影像组学定量分析评估NAFLD患者,并联合临床特征构建预测模型用以无创识别NASH患者。
1 资料与方法
1.1 一般资料
回顾性选取2018年6月至2022年12月浙江省人民医院收治的122例NAFLD患者,其中NASH患者52例。纳入标准:①具有完整的CT影像学资料;②CT检查2周内行肝脏活组织检查,且临床及病理资料完整;③非过量饮酒者(男性饮酒折合乙醇量<30g/d,女性<20g/d);④无其他已知慢性肝脏疾病。排除标准:①有大量饮酒史;②存在其他已知慢性肝病;③影像图像有严重伪影,影响测量。将122例患者按7∶3比例随机分为训练组(n=85)和测试组(n=37),训练组用于构建预测模型,测试组用于验证模型的性能。本研究经浙江省人民医院伦理委员会批准(伦理审批号:2020QT322)。
1.2 临床特征及病理诊断
收集患者的年龄、性别、丙氨酸转氨酶、天冬氨酸转氨酶、碱性磷酸酶、总胆红素、直接胆红素、谷氨酰转移酶、三酰甘油等临床资料。NASH的诊断符合美国肝病研究学会2018年指南中NAFLD的病理分型:当脂肪变性>5%时诊断为NAFLD,当同时有脂肪沉积、肝细胞气球样变和小叶炎症则诊断为NASH[7]。
1.3 CT图像预处理及影像组学特征提取
采用GE Optima CT540设备进行腹部扫描,管电压120kV,管电流260mA,层厚/层间隔为5mm/5mm,视野40cm?40cm。将显示肝脏所有层面的CT平扫图像导入通用电气医疗A.K软件进行图像预处理,之后由软件进行三维全肝自动切割。将分割的肝脏文件由一名高年资放射医生使用公共图像处理软件进行手动修正,以纠正自动分割错误的区域,修正后的全肝感兴趣区域文件基于软件分析工具包中的Pyradiomics库(版本2.1.1)选择直方图特征、形态学特征、哈拉利克特征、灰度共生矩阵特征和游程矩阵特征5大类纹理参数进行特征提取。
1.4 影像组学特征筛选及标签构建
为从提取的影像组学特征中排除重复、冗余及不相关特征,本研究对训练组中获取的特征分别进行方差分析,最大相关最小冗余算法及最小绝对收缩与选择算子算法进行特征筛选,最终将筛选后获取的特征使用Logistic回归构建影像组学标签,基于该标签计算获得的每个病例的分数值以反映NASH的可能概率。为评估影像组学标签的诊断效能,使用受试者操作特征曲线(receiver operating characteristic curve,ROC曲线)分别在训练组和测试组评估区分NAFLD与NASH的能力,同时校准曲线评估标志物的拟合度。
1.5 影像组学联合模型的建立及应用评估
对训练组的临床特征及影像组学标签进行单因素分析以选择NASH的独立预测因子,之后基于独立预测因子使用多因素Logistic回归构建影像组学联合模型。使用ROC曲线对训练组数据进行评估,并利用测试组数据进行验证;使用Hosmer-Lemeshow检验对联合模型的拟合度进行分析。校准曲线测量联合模型预测NASH的概率与实际概率之间的一致性。
1.6 统计学方法
采用SPSS 17.0和Python 3.5.6对数据进行统计分析。采用Kolmogorov-Smirnov检验进行正态性检验,符合正态分布的计量资料以均数±标准差(![]() )表示,比较采用独立样本t检验;偏态分布的计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示,比较采用Mann-Whitney U检验。计数资料以例数(百分率)[n(%)]表示,比较采用χ2检验。P<0.05为差异有统计学意义。
)表示,比较采用独立样本t检验;偏态分布的计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示,比较采用Mann-Whitney U检验。计数资料以例数(百分率)[n(%)]表示,比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 患者的臨床资料比较
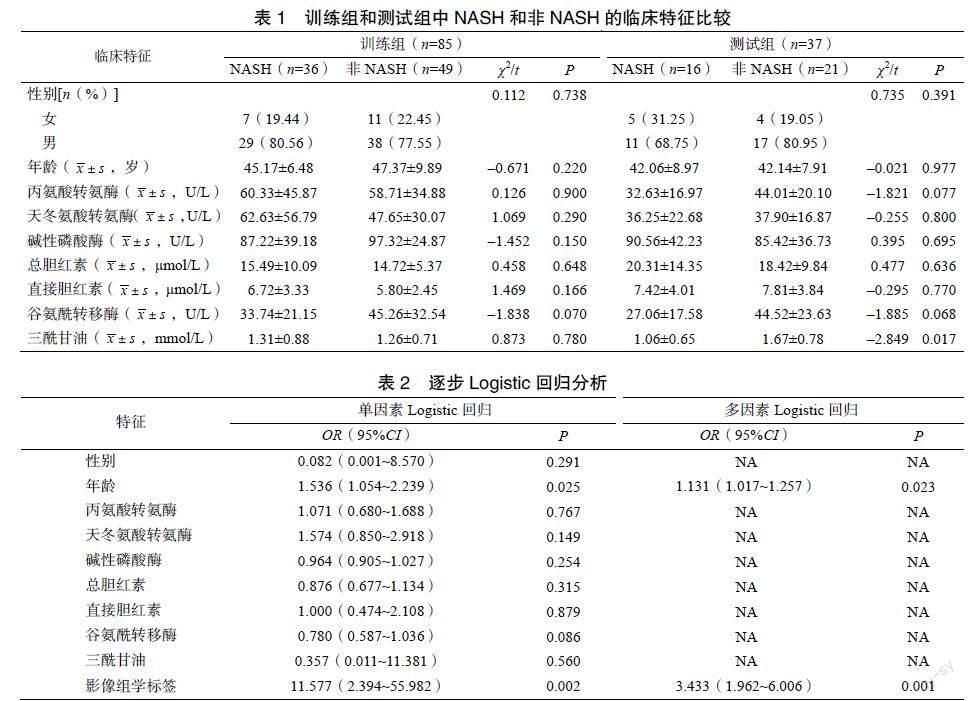
在训练组中,NASH和非NASH患者的所有临床特征比较差异均无统计学意义(P>0.05)。在测试组中,NASH和非NASH患者的三酰甘油比较差异有统计学意义(P<0.05),其他特征比较差异均无统计学意义(P>0.05),见表1。
2.2 影像组学标签评估
经降维后共保留6个特征用于构建影像组学标签,包括2个灰度共生矩阵特征和4个游程矩阵特征。ROC曲线显示影像组学标签在训练组和测试组中均表现出良好的预测效能,曲线下面积分别为0.863和0.859,特异性分别为87.8%和85.7%,敏感度分别为83.3%和87.5%。
2.3 联合预测模型的构建与性能评价
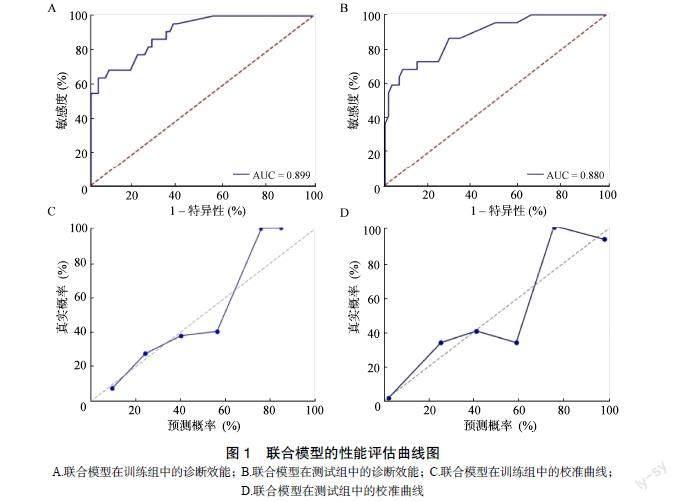
对训练组数据使用逐步Logistic回归分析,结果显示年龄及影像组学标签均是NASH的独立预测因子,见表2。使用年龄和影像组学标签构建联合预测模型,在训练组和测试组中的诊断效能分别为0.899和0.880,特异性分别为91.2%和88.1%,敏感度分别为86.7%和88.2%。校准曲线在训练组和测试组中显示出良好的校准性能,Hosmer-Lemeshow检验在训练组和测试组间无统计学意义(P>0.05),表明没有偏离拟合,见图1。
3 讨论
本研究结果表明,基于CT的全肝影像组学特征构建的影像标签能较准确地识别NASH状态,这可为NAFLD患者的评估提供一种新的方向。此外,影像组学标签联合年龄构建的联合预测模型对NASH有较高的诊断效能,这也为临床诊疗提供一种新的评估工具。
NASH是肝脏疾病的常见类型,其可由脂肪肝向肝纤维化和肝硬化逐步恶化[8]。因此,及早诊断并治疗NASH至关重要。影像组学技术的发展为NASH无创诊断和研究提供新的技术手段[9]。本研究结果也证实基于影像组学技术构建的生物标签能较好地在NAFLD人群中识别NASH患者,表明全肝影像组学特征可用于表征NASH患者肝脏的组织病理变化。相比其他基于肝脏的影像组学研究方法,本研究勾画了整个肝脏的感兴趣区而不是某个层面的感兴趣区,从而保证构建的影像组学标签包含全肝信息,可更准确地反映肝脏病理改变。此外,构建影像组学标签的6个影像组学特征分别归属于灰度共生矩阵特征和游程矩阵特征,均属于像素点空间分布的高阶纹理[10]。这也揭示诸如直方图的低阶纹理并不能反映NASH的病理变化,而高阶纹理在评估NAFLD及NASH患者中可能更具有临床价值。
血清标志物能直接或间接反映肝脏损害和肝脏病理环境,是一种经济有效的检测方法[11]。然而在本研究中,单纯依靠血清学标志物并不能有效识别出NASH患者,相反,本研究结果显示年龄是NASH的独立危险因素。事实上,已有相关研究显示年龄与NASH的患病率相关,且可用于预测NAFLD相关的肝脏病变[12-13]。基于上述研究论据,本研究进一步证实年龄在评估NASH中的重要性。另外,本研究仅使用CT平扫图像,不仅减少患者所受辐射剂量,且避免造影剂可能发生过敏反应及对人体的副作用。
本研究仍存在一定的局限性:①本研究为回顾性单中心研究,未来需要更大样本量及多中心研究进一步验证模型的临床可靠性。②本研究所分析的均为NAFLD患者,因而纳入的NASH患者比例会显著高于普通人群中的NASH患者比例,可能造成研究结果存在偏倚。③由于影像组学特征缺乏相关的生物学意义,本研究无法探究影像组学特征与肝脏基因表达的关系,未来将进一步研究其特定的生物学意义。
综上,影像组学标签在诊断和评估NASH中具有一定的可行性和优越性,可为NASH研究和临床实践提供新的思路和方法,促进NASH的早期诊断和治疗。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
- COTTER T G, RINELLA M. Nonalcoholic fatty liver disease 2020: The state of the disease[J]. Gastroenterology, 2020, 158(7): 1851–1864.
- MANNE V, HANDA P, KOWDLEY K V. Pathophysiology of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J]. Clin Liver Dis, 2018, 22(1): 23–37.
- STAREKOVA J, HERMANDO D, PICKHARDT P J, et al. Quantification of liver fat content with CT and MRI: State of the art[J]. Radiology, 2021, 301(2): 250–262.
- GILLIES R J, KINAHAN P E, HRICAK H. Radiomics: Images are more than pictures, they are data[J]. Radiology, 2016, 278(2): 563–577.
- DAGINAWALA N, LI B, BUCH K, et al. Using texture analyses of contrast enhanced CT to assess hepatic fibrosis[J]. Eur J Radiol, 2016, 85(3): 511–517.
- LUBNER M G, MALECKI K, KLOKE J, et al. Texture analysis of the liver at MDCT for assessing hepatic fibrosis[J]. Abdom Radiol (NY), 2017, 42(8): 2069–2078.
- CHALASSNI N, YOUNOSSI Z, LAVINE J E, et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases[J]. Hepatology, 2018, 67(1): 328–357.
- SHEKA A C, ADEYI O, THOMPSON J, et al. Nonalcoholic steatohepatitis: A review[J]. JAMA, 2020, 323(12): 1175–1183.
- NAGANAWA S, ENOOKU K, TATEISHI R, et al. Imaging prediction of nonalcoholic steatohepatitis using computed tomography texture analysis[J]. Eur Radiol, 2018, 28(7): 3050–3058.
- SHU Z Y, FANG S H, DING Z X, et al. MRI-based radiomics nomogram to detect primary rectal cancer with synchronous liver metastases[J]. Sci Rep, 2019, 9(1): 3374.
- TOITA R, KANG J H. Long-term profile of serological biomarkers, hepatic inflammation, and fibrosis in a mouse model of non-alcoholic fatty liver disease[J]. Toxicol Lett, 2020, 332: 1–6.
- YOUNOSSI Z M, GOLABI P, DE AVILA L, et al. The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: A systematic review and Meta- analysis[J]. J Hepatol, 2019, 71(4): 793–801.
- ZHANG X, WONG G L, YIP T C, et al. Risk of liver-related events by age and diabetes duration in patients with diabetes and nonalcoholic fatty liver disease[J]. Hepatology, 2022, 76(5): 1409–1422.
(收稿日期:2023–03–07)
(修回日期:2024–01–09)
