升降散体外抗流感病毒A/PR8/34/H1N1株的作用研究*
2024-03-07郭雨菲于会勇秦欣欣刘国星畅李聂天旸刘莲莲翟志光王成祥
郭雨菲 于会勇 秦欣欣 刘国星 刘 畅李 磊 聂天旸 刘莲莲 翟志光 王成祥△
(1.北京中医药大学,北京 100029;2.北京中医药大学第三附属医院,北京 100029;3.北京市隆福医院,北京 100010;4.临渭刘尊基中医诊所,陕西 临渭 714000;5.北京市鼓楼中医医院,北京 100009;6.中国中医科学院中医基础理论研究所,北京 100700)
甲型流感病毒(IAV)是引起急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS)的重要病原体,特别在免疫力下降的人群中具有起病急、进展快、死亡率高的特点,给全球带来严重的医疗与经济负担。最新研究显示流感病毒感染人数约占冬春季节所有急性呼吸道感染的三分之一[1]。据世界卫生组织(WHO)估计,每年有近10%的世界人口受到流感的侵袭,29~65万人死于流感[2]。IAV 具有高变异性,易导致耐药病毒株的出现、疫苗效力下降以及全球范围的大流行,而抗流感病毒药物研发的滞后、疫苗接种率低、药物存在不良反应和受耐药性影响等,使得抗流感治疗仍然面临严峻的挑战[3-4]。
IAV 感染大多归属于中医学“时行感冒”“温病”“疫病”范畴[5]。升降散出自《伤寒瘟疫条辨》,由僵蚕、蝉蜕、姜黄、大黄4 味药组成,具有升清降浊、清热祛风之功效。“温邪上受,首先犯肺”,邪热内郁,肺气不得清肃,气机升降失常,因此绝大多数外感热病是以热郁不能透达为病机。升降散中以僵蚕为君,蝉蜕为臣,升浮宣透,透达郁热,正合《黄帝内经》“火郁发之”之旨;用僵蚕、蝉蜕升清而入卫气之分以开上焦,升阳中之清阳;姜黄、大黄降浊由气而及营血,理气血由中而达下焦,降阴中之浊阴,以达到气机升降调和之功。现已有实验研究表明升降散具有抗流感病毒作用,但其作用机制仍不明确。本研究从细胞的层面,体外观察升降散干预流感病毒亚甲型鼠肺适应株(A/PR8/34/H1N1)所致细胞病变的影响,验证升降散体外对IAV 的抑制作用,并进一步探索其抗病毒作用机制,为研发防治流感病毒感染的中药新药提供实验基础。
1 材料与方法
1.1 病毒及细胞株 病毒株:流感病毒亚甲型鼠肺适应株(A/PR8/34/H1N1,以下简称PR8),由中国病预防控制中心传染病所馈赠,病毒经鸡胚传代后,红细胞凝集实验测得血凝滴度为1∶128。细胞株:狗肾细胞(MDCK),由中国病预防控制中心传染病所馈赠。细胞用含有10%胎牛血清和1%双抗的DMEM 培养基,在37 ℃,5%CO2培养箱中培养。
1.2 药物 升降散颗粒剂:僵蚕6 g,蝉蜕3 g,大黄12 g,姜黄9 g。购自北京康仁堂药业有限公司,采用水煮工艺提取有效成分,质量可控。磷酸奥司他韦胶囊(75 mg,国药准字H20065415,批号0221901015,宜昌东阳光长江药业股份有限公司)。药物稀释后经0.22 μm滤膜过滤除菌保存。
1.3 试剂与仪器 PBS 缓冲液(美国Gibco 公司,货号20012043),DMEM 培养液(美国Gibco 公司,货号11995065),青、链霉素母液(10 000 U/mL 青霉素G、10 000 μg/mL 硫酸链霉素,美国Gibco 公司,货号15140122),HEPES(德国Sigma公司,货号H4034-500 g),牛血清白蛋白组分V(7.5%溶液,美国Sigma 公司,货号15260),胎牛血清(FBS,美国Gibco 公司,货号10099141),EDTA 胰蛋白酶(0.05%胰酶,美国Gibco公司,货号25300062),TPCK 胰酶(美国Sigma 公司,货号T8802-50MG),二甲基亚砜(DMSO,美国Sigma 公司,货号506008),Cell Counting Kit-8(CCK8,北京翱擎生物科技有限公司,货号AQ308),TRIzol Reagent[天根生化科技(北京)有限公司,货号DP424],逆转录试剂盒(德国DBI Bioscience 公司,货号DBI-2220);荧光定量PCR 检测试剂盒(美国GeneCopoeia 公司,货号AOPR-1200)。超净工作台(北京东联哈尔仪器制造有限公司,型号BCN-1360),CO2培养箱(美国NUAIRE 公司,型号NU-5510E),台式高速冷冻离心机(德国Eppendorf公司,型号5810R),生物安全柜(Ⅱ级B2型,美国NUAIRE 公司,型号NU-425-600E),荧光定量PCR仪(美国ABI 公司,型号7500);微量核酸定量仪(美国Merinton公司,型号SMA4000)。
1.4 病毒滴度测定 用病毒生长液将流感病毒PR8原液稀释成1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7各浓度梯度。将MDCK 细胞以1×105个/mL的密度接种至96 孔板上,100 μL/孔,在CO2培养箱中37 ℃、5% CO2孵育至细胞基本长满单层,吸弃旧培养液,加入以上浓度梯度的病毒液,100 μL/孔,每个浓度梯度设置8 个复孔,并设置正常对照孔(只加入病毒生长液),在CO2培养箱中吸附2 h 后弃病毒液,PBS 溶液洗涤后每孔加入100 μL 细胞维持液,继续于CO2培养箱中培养。在倒置显微镜下观察细胞形态变化,同时记录特征性细胞病变(CPE)的孔数。培养2 d 后,统计出现病变孔数,按Reed-Muench 公式计算病毒的半数细胞培养感染剂量(TCID50)。
1.5 药物对细胞的毒性测定 升降散颗粒和磷酸奥司他韦用细胞维持液分别从50 mg/mL和4 mg/mL对半稀释成6 个浓度梯度,加入长满单层MDCK 细胞的96 孔板上,100 μL/孔,每个浓度梯度设置6 个复孔,并设置正常对照孔(只加入细胞维持液)。96孔板在CO2培养箱中37 ℃、5%CO2下孵育48 h 后,倒置显微镜下观察CPE。吸弃孔内培养液后用PBS 缓冲液洗涤3 遍,在每孔中加入100 μL 细胞维持液和10 μL CCK8溶液,并设置空白对照组(不含细胞,只加入维持液和CCK8 溶液),继续在CO2培养箱中培养1~4 h,在450 nm 波长处对每个孔的吸光度值(A 值)进行测定,计算细胞的存活率,计算公式:细胞存活率=(A药物组-A空白组)÷(A正常组-A空白组)×100%。以90%以上细胞存活率的药物最小稀释倍数为药物的最大无毒浓度(TC0);用Reed-Muench公式计算药物的半数中毒浓度(TC50)。
1.6 升降散体外抗流感病毒PR8 的作用 升降散与磷酸奥司他韦稀释至TC0,96 孔板上接种MDCK 细胞培养至长满单层后,按照以下3 种不同给药方式进行干预给药。1)预防作用:在孔内加入药物,100 μL/孔,每组设置6 个复孔,同时设置正常细胞对照组和病毒对照组,作用4 h 后吸弃并用PBS 缓冲液洗涤孔内药液,将100TCID50流感病毒PR8 接种于细胞,100 μL/孔,正常细胞对照组加入病毒生长液,在CO2培养箱中37 ℃下吸附2 h 后吸弃并用PBS 缓冲液洗涤孔内病毒液,换细胞维持液继续培养。2)直接作用:将100TCID50流感病毒PR8 和药物混合,37℃下作用4 h,将混合液接种于MDCK细胞,100 μL/孔,每组设置6个复孔,正常细胞对照组加入细胞维持液与病毒生长液的等量混合液,病毒对照组只加入病毒液,在CO2培养箱中37 ℃下作用2 h 后吸弃并用PBS 缓冲液洗涤孔内液体,换细胞维持液继续培养。3)治疗作用:将100TCID50流感病毒PR8 接种于细胞,100 μL/孔,正常细胞对照组加入病毒生长液,在CO2培养箱中37℃下吸附2 h后吸弃并用PBS缓冲液洗涤孔内病毒液,在孔内加入药物,100 μL/孔,每组设置6 个复孔,正常细胞对照组和病毒对照组加入细胞维持液,作用4 h后吸弃并用PBS 缓冲液洗涤孔内药液,换细胞维持液继续培养。按上述给药方法,观察并记录各组CPE,待病毒对照组的CPE(++++)时,用CCK8 法测定并计算细胞存活率(测定和计算方法同1.5),并计算药物对感染细胞的抗病毒有效率(ER)。计算公式:ER=(A药物组-A病毒对照组)÷(A正常对照组-A病毒对照组)×100%。
1.7 流感病毒PR8 感染细胞Caspase-3、Caspase-8、Caspase-9 mRNA 升降散与磷酸奥司他韦稀释至TC0,96 孔板上接种MDCK 细胞培养至长满单层后,将100TCID50流感病毒PR8和药物等量混合,37 ℃下作用4 h 后将混合液接种于MDCK 细胞,100 μL/孔,每组设置3 个复孔,空白(正常细胞对照)组加入细胞维持液与病毒生长液的等量混合液,病毒对照组只加入病毒液,在CO2培养箱中37 ℃下作用2 h 后吸弃并用PBS缓冲液洗涤孔内液体,换细胞维持液继续培养,在药物处理后的12、24、48 h 收集细胞,用Trizol 法提取各组细胞的总RNA。逆转录成cDNA,以cDNA 为模板,分别加入Caspase-3、Caspase-8、Caspase-9 引物进行扩增,见表1,引物均由北京利科丽生物科技有限公司设计与合成。PCR 反应为20 μL 体系,含cDNA 2 μL,2× All-in-One qPCR Mix 10 μL,上下游引物(2 μmol/L)各2 μL,50×Rox Reference Dye 0.4 μL,双蒸水3.6 μL。反应条件:95℃10 min,95℃10 s,55℃20 s,共40 个循环,反应结束后分析熔解曲线。根据标准品反应后所得到的数值获得标准曲线,采用2-ΔΔCt法计算目的基因mRNA 的相对表达量(QR):QR=2-ΔΔCt,ΔΔCt= (Ct待测样本,目的基因-Ct待测样本,内参基因) -(Ct对照样本,目的基因-Ct对照样本,内参基因)。

表1 actb、Caspase-3、Caspase-8、Caspase-9的引物序列
1.8 统计学处理 应用SPSS28.0 统计软件。计量资料以(±s)表示,多组样本间比较采用单因素方差分析,方差齐时,用LSD 进行多重比较,方差不齐采用非参数因子Kruskal-Wallis秩和检验。两组间比较,满足正态性采用t检验,不满足正态性采用Mann-Whitney秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 病毒滴度测定结果 培养48 h 后,倒置显微镜下可以观察到随着稀释倍数的增加,细胞病变程度逐渐降低。统计细胞出现病变的孔数后,根据Reed-Muench 公式计算病毒的TCID50,得到TCID50=10-5.20。本实验将采用100TCID50作为攻毒浓度。
2.2 药物对细胞毒性测定结果 磷酸奥司他韦和升降散的浓度增加,对MDCK细胞产生的毒性随之加重,镜下表现为细胞形态变圆、皱缩,胞内颗粒增多,细胞粘连、破裂、脱落死亡等。根据CCK8 法测得磷酸奥司他韦和升降散的TC0分别为0.25、6.25 mg/mL,TC50分别为0.76、19.69 mg/mL,即确定0.25、6.25 mg/mL 分别为磷酸奥司他韦和升降散体外抗流感病毒作用的最高允许浓度。
2.3 升降散体外抗流感病毒PR8的作用 3种给药方式下病毒对照组细胞明显病变,细胞拉长、粘连,或细胞变圆、脱落,甚至碎裂、溶解等,而升降散组与磷酸奥司他韦组的CPE程度较轻,且吸光度值较高。CCK8法测得各组不同给药方式下的细胞存活率和抗病毒有效率(ER)如表2、表3 所示。3 种给药方式下升降散和磷酸奥司他韦组的细胞成活率均高于病毒对照组(P<0.05),升降散组的细胞存活率不如磷酸奥司他韦组,其中直接作用下,升降散的抗病毒有效率最高(ER=52.37%),而通过预防病毒侵入细胞来抗病毒的ER 较低,表明升降散具有一定的抗流感病毒PR8 株作用。后续实验即以直接作用为给药方式。

表2 各组不同给药方式下细胞存活率比较(%)
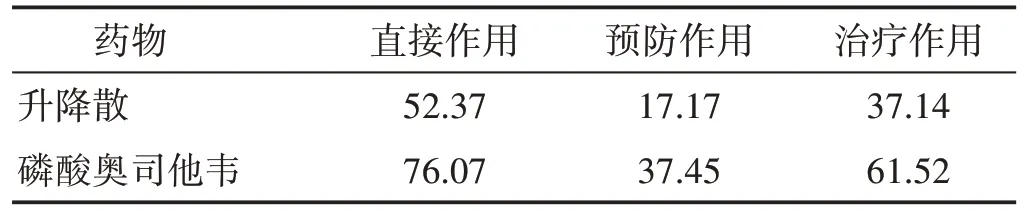
表3 不同给药方式下药物抗病毒有效率(%)
2.4 流感病毒PR8 感染细胞Caspase-3、Caspase-8、Caspase-9 mRNA 表达水平 见表4。与空白组相比,攻毒12、24、48 h 后,病毒对照组的Caspase-3、Caspase-8、Caspase-9基因mRNA均有显著上调(P<0.05),且随着时间的延长呈明显上升趋势。磷酸奥司他韦组MDCK 细胞在12、24、48 h 的Caspase-3、Caspase-8、Caspase-9 基因mRNA 表达明显低于病毒对照组(P<0.01)。与病毒对照组相比,升降散组MDCK 细胞在12、24、48 h 的Caspase-3、Caspase-8、Caspase-9 基因mRNA 表达均被显著下调,差异具有统计学意义(P<0.05或P<0.01)。
表4 各组细胞Caspase-3、Caspase-8、Caspase-9 mRNA相对表达比较(±s)

表4 各组细胞Caspase-3、Caspase-8、Caspase-9 mRNA相对表达比较(±s)
注:与空白组比较,*P <0.05。
组 别空白组(n=3)病毒对照组(n=3)磷酸奥司他韦组(n=3)升降散组(n=3)时间12 h 24 h 48 h 12 h 24 h 48 h 12 h 24 h 48 h 12 h 24 h 48 h Caspase-3 1.00±0.12 1.06±0.04 1.08±0.06 4.92±0.07*6.41±0.16*8.03±0.48*2.06±0.17△△3.24±0.40△△4.17±0.42△△2.94±0.10△△4.37±0.18△△5.34±0.96△△Caspase-8 1.00±0.04 1.17±0.16 1.08±0.07 5.14±0.58*6.71±0.44*7.76±0.59*1.75±0.15△△3.06±0.31△△4.73±0.92△△3.53±0.38△△4.25±0.78△△6.26±0.94△Caspase-9 1.00±0.06 1.06±0.08 1.09±0.21 4.99±0.71*6.57±1.02*9.30±1.09*2.92±0.25△△3.86±0.61△△4.98±0.40△△3.81±0.20△△5.09±0.46△7.25±0.32△
3 讨 论
流感病毒是造成呼吸道疾病的常见病原体之一,其致病性强、易变异、传播能力强,因此具有强危害性。病毒进入细胞后的增殖分为吸附、内吞、脱壳、生物合成、组装和出芽6 个过程[6]。现代研究表明流感病毒的致病机制主要有诱导宿主细胞凋亡/自噬/焦亡、造成细胞氧化应激损伤和细胞因子风暴等学说。不同机制相互联系、相互影响,形成复杂的网络。目前研究已发现多种中药(如黄芩[7]、板蓝根[8]、无毒干蟾[9]等)和中药复方(如麻黄汤[10]、连花清瘟颗粒[11]等)、中药活性成分提取物(如黄芩苷[12]、荆芥挥发油[13]等)具有体内外抗流感病毒效果。由于流感病毒的变异性和耐药性的增加,中药抗病毒的多途径、多靶点等优势逐渐显现。
本实验研究设计3 种给药方式,分别观察升降散是否具有对病毒的直接作用、对病毒侵入细胞的预防作用和对病毒穿入细胞后的治疗作用,从而探索药物对病毒的直接灭活、阻止病毒吸附及抑制病毒进入细胞的生物合成等抗病毒作用。实验结果表明,升降散在最大无毒浓度给药时,3 种给药方式下均能改善流感病毒PR8 诱导MDCK 细胞的细胞病变效应,提高细胞存活率,表明其具有体外抗流感病毒的作用。且实验证明,升降散在最大无毒浓度给药下,能够通过直接灭活的方式抗流感病毒(ER>50%);升降散也能通过阻止病毒吸附及抑制病毒进入细胞的生物合成而抗流感病毒,但作用效果较低(ER<50%),结果表明其主要作用方式可能是对病毒的直接灭活作用,对于阻止病毒吸附及抑制病毒进入细胞的生物合成作用相对较弱,因此后续实验采用直接灭活的给药方式对其作用机制进行了初步探索。
流感病毒侵入宿主细胞后,能够诱导宿主细胞产生凋亡反应,属于流感病毒致病机制之一。细胞凋亡受多因子网络的调控,有许多蛋白和细胞因子参与作用,如半胱天冬氨酸酶家族(Caspase)、Bcl-2 家族蛋白、Fas/FasL 等。细胞凋亡有多种途径,最主要的3 个途径是内源性途径(线粒体途径),外源性途径(死亡受体途径)和内质网途径[14]。线粒体介导的凋亡是通过线粒体膜透化促使细胞色素C 的释放,最终导致Caspase-9的激活以及下游的执行蛋白酶活化导致细胞凋亡,并与Bcl-2 家族蛋白的调控关系密切[15]。细胞膜表面的死亡受体及相应配体结合,形成死亡诱导信号复合物并启动Caspase-8,Caspase-8 会激活其他执行半胱天冬酶例如Caspase-3,使细胞发生凋亡[16]。可以说Caspase-8和Caspase-9分别介导凋亡的外源性途径和内源性途径[17-18],而Caspase-3 是两条途径共同的下游效应执行蛋白酶[19]。近些年的研究发现多种中药及有效物可以影响流感病毒感染细胞的Caspase家族蛋白的表达,从而抑制病毒诱导的细胞凋亡。卢春化等[20]用黄芪多糖干预甲型流感病毒小鼠肺炎模型,发现中药活性成分能下调凋亡相关蛋白Caspase-3、Caspase-8、Caspase-9的表达,从而发挥抗细胞凋亡及保护肺组织的作用。刘晓婷[21]实验研究发现黄芩苷组的Caspase-3、Caspase-8 的mRNA 表达较模型组均明显降低,对病毒感染诱导的细胞凋亡有干预作用。邓东沅等[22]实验发现在体外环境下,木樨草能够降低Caspase 相关家族蛋白的表达从而干预流感病毒H1N1感染细胞的凋亡。本实验应用荧光定量RT-PCR 方法,检测流感病毒PR8 感染细胞中凋亡信号转导通路相关mRNA 的表达,研究发现,模型组Caspase-3、Caspase-8、Caspase-9 表达水平较空白组均显著上升,表明病毒感染后确实会通过多途径诱导宿主细胞凋亡引起细胞病变,且随着感染时间的增加凋亡越发显著,而升降散以最大无毒浓度给药后12、24、48 h均可显著下调细胞内Caspase-3、Caspase-8、Caspase-9的mRNA表达水平,表明其可通过外源性和内源性两个途径抑制病毒感染后宿主细胞凋亡;其中12 h 的差异性较24、48 h更明显,提示中药的药效在感染早期效果更明显,可用于流感的早期治疗。
综上所述,升降散具有一定的体外抗流感病毒作用,且能通过调控凋亡相关Caspase家族蛋白的基因表达,从而抑制流感病毒感染诱导的细胞凋亡。由于流感病毒干预机体的作用机制和涉及的基因调控网络非常复杂,而中药具有多靶点、多途径的作用特点,因此升降散对流感病毒感染的干预作用机制有待深入的实验研究。
