基于多模态影像组学方法在脑胶质瘤高低分级中的应用价值
2024-02-28叶姣宾芳鲁波蔡泽润胡玲通信作者
叶姣,宾芳,鲁波,蔡泽润,胡玲(通信作者)
湘潭市中心医院 (湖南湘潭 411100)
脑胶质瘤是常见的脑部原发性肿瘤,世界卫生组织将其分为Ⅰ~Ⅳ级,其中Ⅰ级和Ⅱ级为低级别脑胶质瘤(low-grade gliomas,LGGs),Ⅲ级和Ⅳ级为高级别脑胶质瘤(high-grade gliomas,HGGs)[1]。研究证实,不同级别的脑胶质瘤患者的治疗方法和预后差异较大。手术切除为LGGs 的首选治疗方法,化疗和辅助放疗是HGGs 治疗的必要方法[2-3]。研究表明,脑胶质瘤分级级别越高,术后复发率越高,患者生存率越低[4]。MRI 是诊断脑胶质瘤的常用方法,其具有软组织对比度高等优点,但其诊断精度仍有待提高[5]。近年来,影像组学方法已广泛应用于癌症的诊断分级、疗效评估及生存期进展预测等领域,为脑胶质瘤的分级提供了思路[6-10]。本研究拟提取脑胶质瘤多模态MRI 的影像组学特征,并对其特征进行分析,旨在建立3 种机器学模型,以提高脑胶质瘤分级的精度。
1 资料与方法
1.1 数据获取及预处理
本研究采取公开可获取的BraTS2018 训练数据集作为研究资料,其包括T1、T2、T1ce、Flair 4 个序列MRI 图像及增强肿瘤区域、浮肿和坏疽3 个区域的掩膜文件。本研究仅采用增强肿瘤区域作为感兴趣区域(regions of interest,ROI),用于后续影像组学特征的提取。将4 个序列的MRI 三维体素间距插值为1 mm×1 mm×1 mm,调整每个序列图像大小为240×240×155,并使用Z-score 方法进行标准化处理。经处理后,数据集包括脑胶质瘤258 例,其中高分化脑胶质瘤210 例,低分化脑胶质瘤48 例,依据9∶1 的比例分配为训练集233 例和测试集25 例。
1.2 影像组学特征提取
影像组学特征提取是指从ROI 中计算大量特定参数的过程。采用基于Python 3.7 平台的Pyradiomics 开源包提取脑胶质瘤影像组学特征。提取的影像组学特征包括一阶及3 类。一阶统计特征反映所测ROI 的对称性、均匀性及局部强度分布变化;形状定量描述ROI 的三维大小和形态信息;纹理特征反映了ROI灰度间的空间排列关系。每个模态MRI 影像均提取107 个影像组学特征,共提取428 个影像组学特征。
1.3 特征筛选及模型建立
首先,对所有特征进行最大最小标准化处理,使标准化后的特征数值处于(0,1)。其次,使用Spearman 系数计算特征间的相关性,并保留任意2 个特征间相关系数>0.9。使用LASSO 算法筛选最终用于构建影像组学模型的特征,根据权值λ 调整LASSO 回归复杂度,λ 值越大,对变量较多的线性模型惩罚力度越大。训练集进行10 倍交叉验证,找到交叉验证误差最小的λ 值,筛选出λ 值不为0 的特征,并计算特征权重,将最后得到21 个特征组成的融合子集作为后续分类模型的基础。
1.4 机器学习分类模型
完成特征筛选后,构建3 种机器学习分类模型:对数几率回归(Logistic regression,LR)、支持向量机(support vector machine,SVM)和多层感知机(multi-layer preceptron,MLP)。LR 是一种线性模型,通过线性决策边界将数据分成2 类。SVM是一种非线性模型,其使用核函数将数据映射至高维空间,并使用线性决策边界分离数据。MLP 是一种深度学习模型,其由多个神经元层组成,并在神经元层后添加激活函数,使MLP 可用于非线性分类任务中。所有模型均采用网格搜索方法进行训练,对各类模型予必要的参数调整,得到训练集各分类模型的最佳参数。
1.5 统计学处理
采用Python 3.7 对数据进行统计分析。计算各预测模型脑胶质瘤高低分化的准确率、曲线下面积(area under curve,AUC)、灵敏度、特异度,并绘制采用受试者特征曲线(receiver operating characteristic curve,ROC)与决策曲线(decision curve analysis,DCA)评估预测模型效能。
2 结果
2.1 特征选择
使用斯皮尔曼相关系数去除冗余特征后筛选出136 个特征,使用LASSO 算法筛选最终用于构建影像组学模型的特征,见图1。最佳惩罚系数λ=0.0168。经选择后,最终保留22个系数值不为0的特征,用于机器学习模型的训练测试,各特征权重见图2。

图1 10 倍交叉验证选择最佳惩罚系数λ
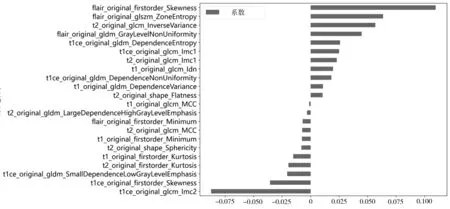
图2 筛选出影像组学特征权重
2.2 模型分类结果
表1 为LR、SVM、MLP 3 种机器学习算法构建影像组学模型预测脑胶质瘤高低分化的结果。图3为3 种模型下训练集和验证集的ROC 曲线。所有模型在训练集的AUC均>0.95,测试集的AUC均>0.90。LR 在测试集中的准确率、AUC和特异度均为最高,敏感度低于SVM 模型。图4 为3 种模型下的DCA 曲线。DCA 曲线表明,3 个模型均具有较好的临床收益,但LR 的净收益高于SVM 和MLP,因此,在影像组学模型中,LR 为最优预测模型。

表1 影像组学模型预测脑胶质瘤高低分化的结果

图3 3 种模型下训练集和测试集的ROC 曲线

图4 LR、SVM、MLP 模型下的DCA 曲线
3 讨论
本研究利用影像组学预测脑胶质瘤患者高低分级的诊断效能,提取Flair、T1、T1ce 和T24 个模态MRI 的影像组学特征并进行数据融合,使用Spearman 和LASSO 回归筛选特征,建立LR、SVM、MLP 3 种机器学习模型进行分类预测。ROC曲线分析显示,3 种模型均具有较好的诊断效能,在训练集和测试集上AUC均>0.9,最高为0.976,且灵敏度和特异度相对稳定。DCA 分析显示,3 种模型曲线在0.2~1.0 阈值下处于干预和无干预曲线上方,在相同阈值下的净收益更高,表明3 种模型均具有较好的临床收益。
本研究对脑胶质瘤高、低分化的影像组学研究发现,4 种模态特征联合LR 机器学习模型在测试集中的AUC值最高,具有最佳的诊断效能。
传统MRI 影像诊断模式诊断结果差异性较大,无法满足临床精确诊断的需求。目前大量研究将影像组学方法用于脑胶质瘤的分级诊断中。Zhou等[11]使用T1增强MRI 影像组学预测脑胶质瘤分级,AUC为0.95。阮君等[12]使用T1、T2、T1加权增强和弥散加权成像4 个模态MRI 影像组学特征评估脑胶质瘤高低分级,结果显示,基于T1、T2和DWI 影像组学特征模型的AUC均>0.9[12]。戴宏等[13]尝试对脑胶质瘤Brats19 公开数据集分级,并使用集成学习投票机制综合3 种机器学习算法模型分类,其集成模型在测试集上的AUC、准确度、灵敏度分别为0.933、0.886 和0.872。本研究LR 模型的AUC、准确度、灵敏度分别为0.976、0.905 和1.000,说明LR 模型对脑胶质瘤分化的识别准确度更佳。
综上所述,基于多模态MRI 影像组学特征可快速、准确预测脑胶质瘤的高低分化,为临床医师对脑胶质瘤的分级诊断提供参考依据。
