Box-Behnken 响应面法优选紫斑牡丹中丹皮酚和芍药苷提取工艺*
2024-02-25付永莉吴春芳
周 坤,付永莉,罗 婷,罗 星,吴春芳
(湖北省武汉市精神卫生中心·湖北省武汉市心理医院,湖北 武汉 430012)
紫斑牡丹Paeonia rockii(S,G.Haw et L.A.Lauener)T.Hong et J.J.Li 为毛茛科芍药属多年生木本植物的干燥根皮[1],又名甘肃牡丹[2],是仅次于中原牡丹种群的第二大品种[3],因其花瓣基部有一明显紫斑而得名[4],其根皮作为药用丹皮已被《甘肃省中药材标准》收载[5]。紫斑牡丹具有清热凉血、活血化瘀功效,临床多用于热入营血、温毒发斑、无汗骨蒸、经闭痛经等症[1-2]。紫斑牡丹根皮中丹皮酚和芍药苷的含量较高,高效提取和分离丹皮酚和芍药苷对扩大牡丹皮药用资源和综合利用有现实意义[6]。由于活性成分丹皮酚能随水蒸气蒸馏,采用蒸馏法获得丹皮酚蒸馏母液,结合重结晶法获取丹皮酚提取物[7],与传统醇提法相比,具有纯化后处理简单、无水溶性杂质干扰、提取纯度更高等优势[8]。本研究中结合紫斑牡丹中活性成分的理化特性,先采用蒸馏法提取丹皮酚[9-10],后结合醇沉法提取芍药苷[11-12],以二者提取率综合评分为响应值,通过对提取关键因素及相关水平的考察,优化紫斑牡丹中丹皮酚及芍药苷的最佳提取工艺。现报道如下。
1 仪器与试药
1.1 仪器
Waters 2695型高效液相色谱仪(美国Waters公司);Starsorius BSI 型电子分析天平(天津泰斯特精密仪器有限公司,精度为万分之一);KQ-250E 型超声波清洗仪(昆山市超声仪器有限公司,功率为300 W,频率为50 kHz);RE-52AA 型亚荣旋转蒸发仪(上海亚荣生化仪器厂);HH-4 型数显恒温水浴装置(江苏荣华仪器制造有限公司);CS101-AB 型电热鼓风干燥装置(重庆试验设备厂)。
1.2 试药
紫斑牡丹饮片(甘肃和顺元中药饮片有限公司,批号为2021112302);丹皮酚对照品(批号为110708-202103,纯度大于98.5%),芍药苷对照品(批号为110736-202141,纯度大于98.5%),均购于中国食品药品检定研究院;甲醇、乙腈(色谱纯,美国Tedia 公司);其他试剂均为分析纯,水为三重蒸馏水。
2 方法与结果
2.1 含量测定
2.1.1 色谱条件
丹皮酚[13]179:色谱柱为Agilent Eclipse plus C18柱(250 mm×4.6 mm,5µm);流动相为甲醇-水(45∶55,V/V);柱温为25 ℃;流速为1.0 mL/ min;检测波长为274 nm;进样量为10µL。
芍药苷[13]108:色谱柱为CAPCELL PAK-C18柱(250 mm×4.6 mm,5µm);流动相为0.1%磷酸-乙腈溶液(14∶86,V/V);流速为1.0 mL/min;柱温为30 ℃;检测波长为230 nm;进样量为10µL。
2.1.2 溶液制备
对照品溶液:取丹皮酚、芍药苷对照品各适量,精密称定,置10 mL 容量瓶中,加甲醇分别制成每1 mL 含0.600 0 mg 丹皮酚、1.500 0 mg 芍药苷的对照品贮备液;取对照品贮备液各适量,加甲醇稀释成质量浓度分别为0.048,0.096,0.192,0.240,0.288µg/mL的丹皮酚对照品溶液[13]179及0.12,0.24,0.48,0.60,0.72µg/mL的芍药苷对照品溶液[13]108。
供试品溶液:取紫斑牡丹根皮饮片50 g,精密称定,置圆底烧瓶中,加液料比倍量的水,连接冷却回流装置,回流提取,参照2020年版《中国药典(一部)》附录中水蒸气蒸馏法,收集9 倍量馏出液,4 ℃冰箱静置12 h,倾去大部分上清液,滤过,得结晶物;合并滤液及上清液,加入其体积量5%的氯化钠(即每100 mL 溶液加氯化钠5 g)混匀,溶解,再进行重蒸馏,收集3 倍量的重蒸馏液,4 ℃冰箱静置12 h,滤过,得结晶物。合并2次结晶物,40 ℃热风干燥,得丹皮酚提取物。取丹皮酚提取物0.2 g,精密称定,置具塞磨口锥形瓶中,精密加入甲醇50 mL,密塞,称定质量,超声处理(功率为300 W,频率为50 kHz)15 min,放冷,再称定质量,以甲醇补充减失的质量,摇匀,滤过,精密取续滤液1 mL,置25 mL 容量瓶中,加甲醇定容,摇匀[13]179,即得丹皮酚供试品溶液。取上述回流提取液,趁热滤过,合并滤液,浓缩至相对密度为1.10~1.20(60 ℃热测),加入95%工业乙醇搅拌,静置24 h,取上清液,滤渣再加95%工业乙醇醇沉12 h,合并2 次上清液,置旋转蒸发仪中回收乙醇,得芍药苷流浸膏,将流浸膏转入蒸发皿中,以少量乙醇润洗烧瓶,洗液转入蒸发皿中,水浴蒸干,105 ℃烘3 h,干燥器中放冷,即得干膏。取干膏粉0.1 g,精密称定,置50 mL磨口锥形瓶中,加稀乙醇35 mL,超声处理(功率为240 W,频率为45 kHz)15 min,放冷,加稀乙醇定容,摇匀,滤过,取续滤液[13]108,即得芍药苷供试品溶液。
2.1.3 方法学考察
系统适用性试验:分别吸取丹皮酚对照品溶液(0.192µg/mL)、芍药苷对照品溶液(0.48µg/mL)、供试品溶液和空白溶剂各10µL,按2.1.1 项下色谱条件进样测定。供试品溶液中,待测组分与其相邻峰分离度均大于1.5,理论板数按丹皮酚峰和芍药苷峰计分别大于5 000和2 000。色谱图见图1。
线性关系考察:精密吸取2.1.2项下丹皮酚和芍药苷对照品溶液各10µL,按2.1.1 项下色谱条件进样测定5 次,以对照品溶液质量浓度(X,µg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程Y丹=75.315 2X丹-0.004 7(r=0.999 9,n=5)和Y芍=95.924 7X芍-0.003 8(r=0.999 8,n=5)。结果表明,丹皮酚和芍药苷的质量浓度分别在0.048~0.288µg/mL和0.12~0.72µg/mL范围内与峰面积线性关系良好。
检测限与定量限确定:将丹皮酚和芍药苷对照品溶液(质量浓度分别为0.192,0.48µg/mL)逐级稀释,分别以信噪比(S/N)为3 倍和10 倍时的质量浓度为定量限和检测限。结果丹皮酚和芍药苷的定量限分别为0.018 7,0.023 4 µg/mL,检测限分别为0.005 6,0.007 0µg/mL。
精密度试验:精密量取丹皮酚和芍药苷对照品溶液(质量浓度分别为0.192,0.48 µg/mL)各10 µL,按2.1.1项下色谱条件进样测定6次,记录峰面积。结果丹皮酚和芍药苷峰面积的RSD分别为1.87%和1.55%(n=6),表明仪器精密度良好。
稳定性试验:精密量取2.1.2 项下供试品溶液适量,分别于0,3,6,9,12,24 h 时按2.1.1 项下色谱条件进样测定,记录峰面积。结果丹皮酚和芍药苷峰面积的RSD分别为1.94%和1.78%(n=6),表明供试品溶液在24 h内稳定性良好。
重复性试验:取紫斑牡丹样品(批号为2021112302),按2.1.2 项下方法制备丹皮酚和芍药苷供试品溶液各5 份,按2.1.1 项下色谱条件进样测定,记录峰面积,并计算含量。结果丹皮酚和芍药苷含量的RSD分别为1.97%和1.89%(n=5),表明方法重复性良好。
加样回收试验:取6份已知含量的紫斑牡丹根皮饮片适量,每份0.5 g,精密称定,向各批次饮片中分别准确加入近100%的丹皮酚和芍药苷对照品,混匀,按2.1.2 项下方法制备供试品溶液,按2.1.1 项下色谱条件进样测定。结果丹皮酚和芍药苷的平均加样回收率均为99.74%,RSD分别为1.33%和1.71%(n=6),表明方法准确度良好。
2.1.4 丹皮酚含量和提取率的测定
分别精密吸取丹皮酚和芍药苷供试品溶液各10µL,按2.1.1项下色谱条件进样测定,将测得峰面积(Y)代入回归方程,计算供试品溶液的质量浓度C1(µg)[14-16]。提取物中含量(X,mg/g)、提取率(Y,%)分别按公式(1)和(2)计算。
式中,X为提取物中丹皮酚或芍药苷含量;Y为紫斑牡丹中丹皮酚或芍药苷提取率;C为丹皮酚或芍药苷供试品溶液峰面积对应的质量浓度;ms0为紫斑牡丹药材的取样量;ms1为丹皮酚或芍药苷提取物取样量;ms2为丹皮酚或芍药苷的提取物总量。
2.2 提取工艺单因素考察
液料比:取紫斑牡丹根皮饮片5 份,各50 g,置圆底烧瓶中,分别按液料比为15,20,25,30,35倍加水,固定提取时间为2 h,乙醇体积分数为55%,按2.1.2 项下方法制备供试品溶液,按2.1.1 项下色谱条件进样测定,考察不同液料比对紫斑牡丹中丹皮酚、芍药苷提取率综合评分的影响,结果见图2 A。可见,液料比在15~25倍范围内时,丹皮酚、芍药苷的提取率综合评分值随液料比的增加而升高;之后,丹皮酚、芍药苷提取率综合评分呈下降趋势。随着液料比的进一步增加,蒸馏液中丹皮酚被大量稀释,在后续重结晶时提取率反而下降,导致丹皮酚、芍药苷提取率综合评分下降。因此,选择液料比为25 倍作为Box-Behnken 响应面试验液料比的中心点。

A.液料比 B.提取时间 C.乙醇体积分数图2 单因素考察结果A.Liquid-solid ratio B.Extraction time C.Ethanol volume fractionFig.2 Results of the single-factor experiment
提取时间:取紫斑牡丹根皮饮片4 份,各50 g,置圆底烧瓶中,液料比为25 倍,乙醇体积分数为55%,提取时间考察范围分别为1,2,3,4 h,分别按2.1.2 项下方法制备供试品溶液,按2.1.1 项下色谱条件进样测定,考察提取时间对紫斑牡丹中丹皮酚、芍药苷提取率综合评分的影响,结果见图2 B。可见,提取时间在1~2 h范围内时,丹皮酚、芍药苷提取率综合评分呈递增趋势;当提取时间超过3 h 时,丹皮酚、芍药苷提取率综合评分下降趋势明显。可能是由于提取时间增加,受热时间过长,馏出液中丹皮酚被大量稀释,影响了重结晶收率;药材加热时间过长,药渣糊化,对芍药苷形成吸附、包埋作用,不利于过滤操作,导致芍药苷提取率评分下降。因此,最终选择Box-Behnken 响应面试验提取时间中心点为2 h。
乙醇体积分数:取紫斑牡丹根皮饮片6 份,各50 g,置圆底烧瓶中,固定液料比为25 倍,提取时间为2 h,乙醇体积分数考察范围设置为45%,55%,65%,75%,85%,95%,分别按2.1.2 项下方法制备供试品溶液,按2.1.1 项下色谱条件进样测定,考察乙醇体积分数对紫斑牡丹中丹皮酚、芍药苷提取率综合评分的影响,结果见图2 C。可见,乙醇体积分数在50%~60%时,丹皮酚、芍药苷的提取率综合评分随乙醇体积分数的升高而升高;当乙醇体积分数高于60%时,丹皮酚、芍药苷提取率综合评分开始显著下降,可能与芍药苷成分的极性密切相关。因此,最终选择Box-Behnken 响应面试验乙醇体积分数的中心点为55%。
2.3 Box-Behnken 响应面法优化提取工艺
2.3.1 试验设计与结果
通过对影响综合评分的因素进行全面考察后,最终选取液料比(因素A)、提取时间(因素B)、乙醇体积分数(因素C)和提取次数4 个关键影响因素作为本试验考察的自变量,鉴于提取次数为非连续型变量(不能无限赋值),该因素无法参与回归分析,结合实际生产及文献[14-16],暂定提取次数为2次。据Box-Behnken中心组合原理,取因素A、因素B、因素C 3 个关键因素,每个因素各设定低、中、高3 个水平,依次赋值为-1,0,+1,Box-Behnken响应面试验因素与水平见表1。按试验组编号对应的因素与水平进行提取操作,计算各编号组中丹皮酚和芍药苷的提取率,以提取物中丹皮酚提取率(Y1)和芍药苷提取率(Y2)的总权重综合评分为评价指标,采用加权评分法计算两者总权重综合评分,总权重综合评分=(丹皮酚提取率/丹皮酚提取率最大值)×50+(芍药苷提取率/芍药苷提取率最大值)×50。结果见表2。

表1 Box-Behnken响应面试验因素与水平Tab.1 Factors and levels of the Box-Behnken test
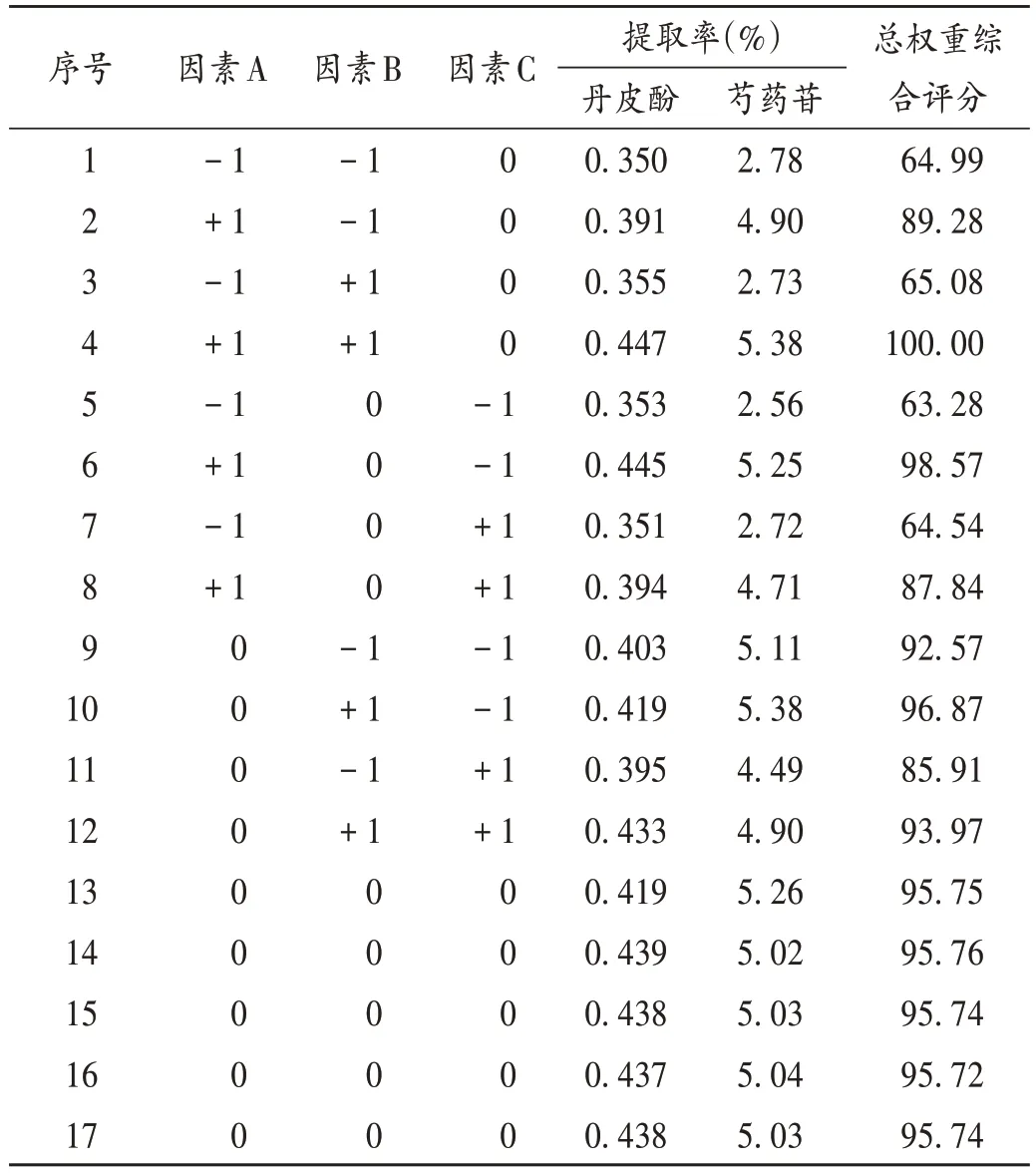
表2 Box-Behnken响应面试验设计与结果Tab.2 Design and results of the Box-Behnken test
2.3.2 模型拟合与方差分析
采用Design-Expert软件对表2中的数据进行回归分析,得因素A、因素B 和因素C 与总权重综合评分的线性拟合回归模型Y=95.74+14.66A+3.07B-2.36C+2.52AB-2.98AC+0.93BC-14.67A2-0.88B2-2.54C2。方差分析结果见表3。可见,建立的回归方程模型F=960.42,P<0.000 1,表明拟合模型差异有统计学意义;失拟项P=0.770 1>0.05,差异不显著,表明未知因素对结果干扰较小,试验误差小,故判断所建立的模型预测性良好。回归模型中变量A,B,C,AB,AC,A2,C27 项对总权重综合评分的线性效应均较显著(P<0.01)。回归方程一次项中,以因素A 对因变量的总权重综合评分影响最突出;因素B 次之,且影响均为正相关;因素C对总权重综合评分的影响为负相关。回归方程二次项中,以A2和C2对总权重综合评分的影响均为负相关,其中以因素A 的影响最显著,因素C影响次之[14-16]。

表3 方差分析结果Tab.3 Results of the analysis of variance
采用Design-Expert 软件对表3 中的试验结果作图,固定某一因素,可得任意2 个因素交互作用对综合评分影响的三维响应面及等高线图,详见图3。
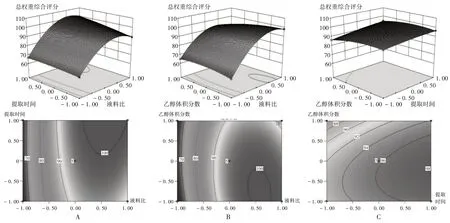
A.提取时间与液料比 B.液料比与乙醇体积分数 C.提取时间与乙醇体积分数图3 各影响因素交互作用对总权重综合评分影响的二维等高线和三维响应面图A.Extraction time and liquid-solid ratio B.Liquid-solid ratio and ethanol volume fraction C.Extraction time and ethanol volume fractionFig.3 2D contour and 3D response surface maps of the interaction of various influencing factors on the total weight comprehensive scores
可见,因素A与因素B、因素A与因素C的三维响应面图均为陡峭开口向下的凸面,表明在所选定考察范围内存在响应值的最大值;因素A 与因素B、因素A 与因素C的响应值等高线图均为圆形至椭圆形,其对应三维响应面图为高度卷曲的曲面,表明自变量与因变量之间的函数关系并非单纯的一元线性关系,故因素A、因素B、因素C 与总权重综合评分间的线性关系采用多元线性方程描述更合理。通过Design-Expert 软件统计数据分析,系统预测推荐的最佳参考工艺为液料比28.25 倍,提取时间147.2 min,乙醇体积分数52.1%,该条件下理论最优总权重综合评分可达104.02,丹皮酚提取率为0.51%,芍药苷提取率为5.42%。为方便实际操作,将该工艺参数调整为液料比28 倍,提取时间150 min,乙醇体积分数52%。
2.3.3 验证试验
取紫斑牡丹根皮饮片3 份,各50 g,按优选工艺进行丹皮酚、芍药苷提取。此工艺条件下丹皮酚提取率为0.49%(RSD=1.33%,n=3),芍药苷提取率为5.38%(RSD=1.07%,n=3),总权重综合评分103.62,与回归方程的预测值基本接近,验证了该模型预测的准确性。
3 讨论
正交试验是对孤立的试验点进行分析的一种优化多变量系统的有效试验设计工具,能给出最佳因素水平组合,但无法找出整个区域因素最佳组合和响应值的最优值[17]。响应面法通过对响应面等值线的分析寻求最优工艺参数,将多因素试验中因素与指标的相互关系用二次多项式拟合。该方法研究因素与响应值、因素间的交互作用,获得的预测模型多为曲面,在试验条件寻优过程中,可连续对各水平进行分析[18]。响应面法获得的预测模型为曲面,线性方程为多元线性回归,故此模型的拟合度、失拟项参数对模型预测的准确性有较高要求,否则模型会失去其预测意义,导致系统给出的预测值出现较大偏差;响应面设计无法对试验的非连续型变量(如提取次数)进行考察,通常需单独考察;响应面优化系统给出的工艺参数是理论基础上的,参数往往需结合生产实际加以修正,并对其进行工艺验证。
本研究中通过单因素试验获取响应面试验关键因素的中心点,在确立相应中心点基础上,采用Box-Behnken 响应面法优化紫斑牡丹中丹皮酚和芍药苷提取工艺。通过线性拟合模型发现,一次项中液料比与总权重综合评分呈正相关,且液料比影响最大;乙醇体积分数对总权重综合评分的影响为负相关,提示乙醇体积分数并非越大越好。当乙醇体积分数超过57.5%时,总权重综合评分降至70,为维持较好的芍药苷提取率,故乙醇体积分数应严格控制在50%~53%。二次项中,尽管A2,C2与总权重综合评分呈负相关,但两者的线性效应均高度显著(P<0.01),其中以液料比的影响最大,提取时间次之,提示液料比是提取过程中应重点监控的因素,液料比过大,丹皮酚蒸馏液体积过大,影响重结晶效率;液料比过小,蒸馏液提取不完全。三维响应面图显示,交互项中液料比和提取时间对总权重综合评分有较大影响。本研究结果显示,乙醇体积分数为52%时对芍药苷有良好的选择性,考虑到实际操作需要,在合理范围内对液料比和提取时间进行适当调整,最终优选紫斑牡丹中丹皮酚和芍药苷提取工艺为液料比28倍,提取时间150 min,乙醇体积分数52%。
