抗菌新武器:聚集诱导发光在细菌感染防治领域的应用
2024-02-22陈伟才刘勇王志明
陈伟才 刘勇 王志明
细菌性感染疾病日益增多,已成为全球范围内严重威胁人类生命的健康问题。自1930年代以来,有很多预防性抗生素药物被发现和证实具有抑制或杀死有害细菌的作用。每种抗生素都有其作用机制,包括细胞壁靶向、蛋白质和核酸合成的失活、产酶抑制等。尽管这些抗生素挽救了数百万人的生命,但滥用或过度使用抗生素,会使细菌产生耐药性并产生超级细菌,从而降低治疗效果。
抗生素耐药性已经成为一场全球性危机。这种情况如持续到2050年,将可能导致每年近1000万人死亡,超过癌症死亡人数。因此,开发新型不产生多药耐药性的抗菌材料迫在眉睫。
光動力抗菌
光动力抗菌(antimicrobial photodynamic therapy, APDT)是公认的对付细菌感染的有效武器[1],这是一种基于光敏剂(photosensitizer, PS)的交互技术,通过光照射产生活性氧(reactive oxygen species, ROS),从而根除或抑制细菌生长[2]。
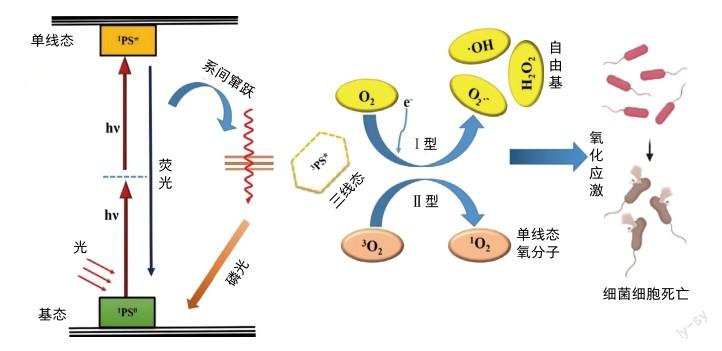
在典型的APDT过程中,基态的光敏剂(1PS0)吸收紫外或可见光,被激发到其高能单线态(1PS*)。然而,激发态的电子自旋是不稳定的,寿命很短(<1微秒)。1PS*可以通过荧光或者非辐射通道耗散能量,或通过系间窜跃产生寿命较长的三重态(3PS*)。在3PS*与底物相对接近的情况下,通过Ⅰ型机制(电子转移过程)或Ⅱ型机制(能量传递过程)发生光化学反应[3]。在Ⅰ型反应中,3PS*将一个电子转移到底物上,并引发高活性的超氧阴离子(O2·-)和羟基自由基(·OH)的产生。所有这些ROS都会对细菌细胞膜和其他功能性生物分子如DNA、内酶、蛋白质和脂肪酸等造成不可修复的氧化损伤[4]。被激发的3PS*与三线态氧分子(3O2)发生Ⅱ型反应,通过能量转移过程产生高活性的单线态氧分子(1O2)。产生的1O2通过触发光动力作用,使细胞抗氧化剂失活,促进氧化应激介导的细胞杀伤作用[5],从而达到消灭细菌病原体的能力。结果表明,Ⅰ型和Ⅱ型机制在APDT的比例在很大程度上取决于PS的类型和感染部位的微环境。APDT对多药耐药和非耐药细菌病原体均产生有效的影响。
聚集诱导发光(aggregation-induced emission,AIE)光敏剂已被广泛用于光动力抗癌与光动力抗菌领域[6]。在所有已报道的有机光敏剂中,具有AIE特性的光敏剂越来越受到关注,这是因为一些AIE特性的光敏剂被证明具有独特的聚集诱导增强产生ROS的效果。AIE光敏剂已成功应用于微生物检测、鉴别和感染治疗。除此之外,通过精确的分子设计来调节π共轭体系和构建电子给体-受体部分,可以获得在可见光范围内具有广泛颜色可调性的聚集诱导发光体(AIEgens),实现白光驱动的病原微生物杀灭。
基于AIE光敏剂的一体化诊疗
通过一个简单的酰胺化反应,AIE材料就可以很容易地修饰到噬菌体表面。AIE材料与噬菌体形成的一类新的抗菌生物偶联物TVP-PAP分子完美保留了AIE材料和噬菌体的特性,已用于针对特定种类细菌的靶向、成像和抗菌一体化治疗[7]。
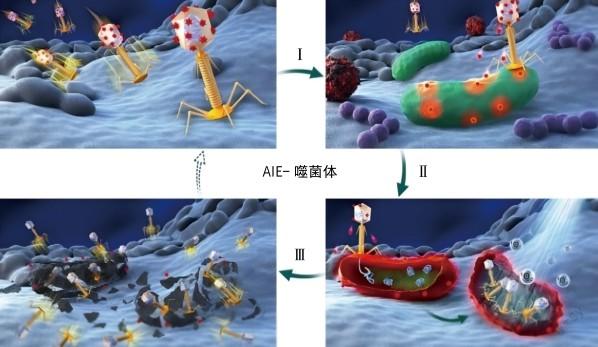
得益于独特的AIE荧光性质、高效的1O2产生效率和对特定细菌的靶向特异性,TVP-PAP已被证实能成功地应用于鉴别成像、选择性和高效性杀灭目标细菌,并且对非靶向细菌和正常的哺乳细胞无明显影响。体外试验表明,在TVP-PAP的协同作用下,多药耐药铜绿假单胞菌的杀灭率接近100%。此外,体内研究证实,TVP-PAP对抗生素敏感菌和多药耐药菌感染的伤口有明显的加速伤口愈合的功效。这些令人瞩目的性能验证了,在协同细菌识别和杀灭上,TVP-PAP偶联体远胜于偶联体的单独组分。通过转变成其他噬菌体,AIE-噬菌体组合策略可以扩展成为一种通用抗菌剂,对治疗细菌感染和间接细菌感染疾病具有很大的潜力。
伤口敷料
伤口敷料的选择对伤口愈合至关重要。具有AIE特性的敷料具有良好的抗菌性能,可有效预防耐药细菌引起的伤口感染,显著加快伤口愈合速度。
AIE纳米纤维敷料
静电纺丝纳米纤维由于高纵横比、高比表面积和可定制性等特点,在组织工程、给药系统和创面敷料等生物医学应用领域得到广泛研究。静电纺丝技术是制备超细聚合物纤维的常用方法,聚合物溶液或熔体在外加静电高压的强电场下,形成圆锥形状(称为泰勒锥)。当电场超过阈值,聚合物液滴克服表面张力,于喷丝头与接收装置之间被拉长从而形成射流。同时溶液迅速挥发,在电场的作用下射流被拉伸至直径成微米甚至纳米级,射流在电场间形成鞭动,最后被收集到固定装置上形成固态微粒或纳米纤维。
基于手持式静电纺丝装置,研究人员研制出具有抗菌性和生物相容性的AIE纳米纤维敷料,以消除多药耐药细菌的感染和促进伤口愈合[8]。与预制纳米纤维膜相比,原位静电纺丝制备AIE纳米纤维可以针对不同的伤口,并且在伤口上具有更好的密实度。特别是,由于手持设备的便携性和灵活性,静电纺丝产生的纳米纤维敷料均可覆盖到不规则的伤口部位,并具有良好的舒适性。基于AIE增强ROS的特性,这种AIE纳米纤维敷料对金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌具有高效的抗菌活性,同时保持良好的生物相容性。动物皮肤创面模型研究表明,沉积AIE纳米纤维敷料能有效防止多药耐药细菌感染伤口,显著减少炎症并加速伤口愈合。此外,这种纳米纤维敷料结合了手持式静电纺丝的便捷性,极大地方便了户外应用。在紧急情况下,这种纳米纤维敷料可以直接沉积在伤口上,在2分钟内完全覆盖伤口。
AIE抗菌水凝胶
水凝胶因优异的物理和化学性质被认为是治疗慢性伤口的理想敷料。水凝胶都是由天然和/或合成的亲水聚合物通过物理或化学交联产生的,具有三维网状结构。聚合物分子间稳定的相互作用决定了水凝胶网络有很好的保持水分的能力。水凝胶具有较高含水量,不仅可以为干燥结痂的伤口提供额外的水分,介导伤口的水合作用,还有利于清创。与此同时,水凝胶还可以吸收伤口处过多的渗出液并保持伤口湿润环境,具有优异的渗出液管理能力。此外,交联结构提供了机械稳定性和耐久性。
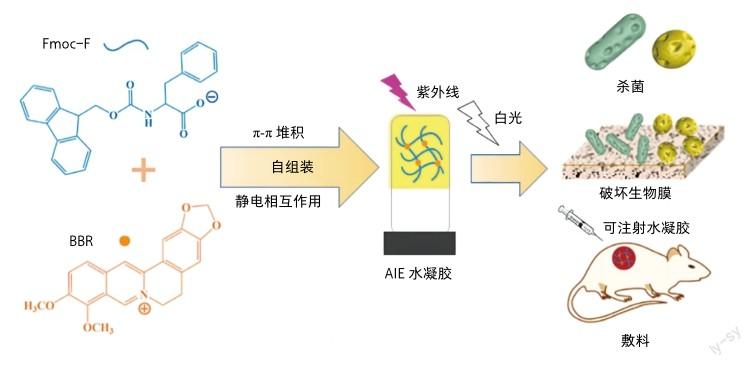
研究人员设计了由丙苯胺酸衍生物(Fmoc-F)和小檗碱(BBR)形成的AIE杂化水凝胶,并用于光动力抗菌和抗生物膜[9]。通过静电作用和π-π堆积,BBR自组装成纳米粒子,然后分散在水凝胶基质中。得到的Fmoc-F/ BBR杂化水凝胶表現出AIE特性,而且在白光照射下产生1O2,通过光动力机制抑制和杀死细菌,进而穿透和根除生物膜。水凝胶即使在白光照射下对哺乳动物细胞也无明显的细胞毒性和低溶血行为。体内实验表明,Fmoc-F/BBR水凝胶对金黄色葡萄球菌感染的伤口具有优异的治疗效果。这项工作提供了一种广谱抗菌和抗生物膜的新策略,并有助于推动一种基于氨基酸基水凝胶的抗菌框架和抗生物膜材料在生物医学领域的应用。
个人防护用品
减少病毒传播风险最有效的手段之一是正确佩戴口罩。然而传统的个人防护用品(PPE)只是通过物理隔绝来防止病毒接触或进入人体,并不能对病毒起到杀灭作用。

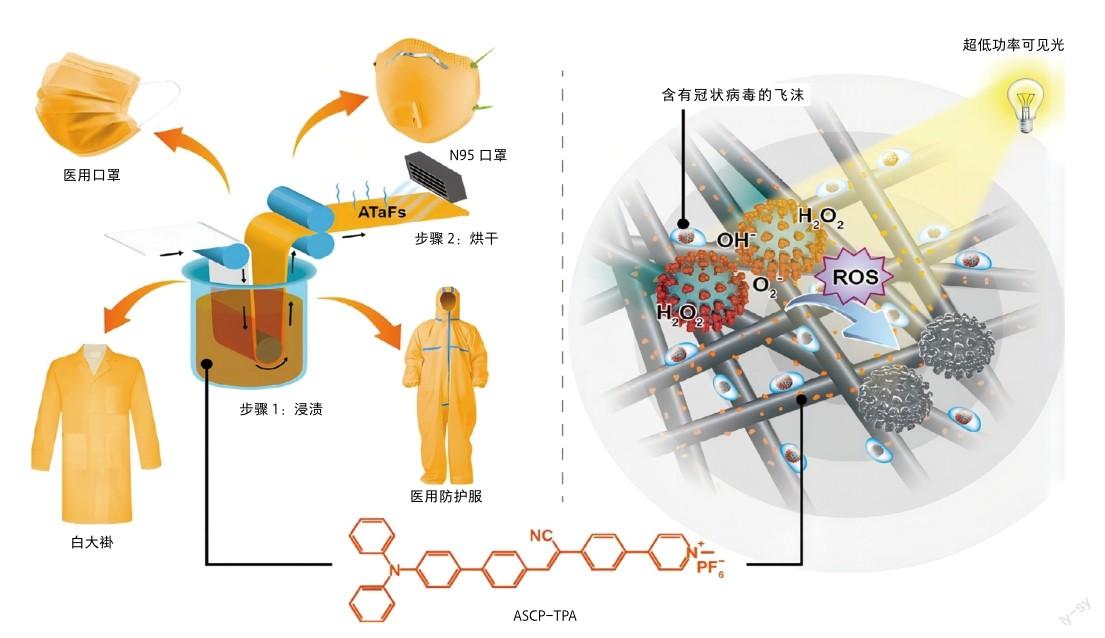
研究人员设计和研制了一系列具有抗病毒效果的织物(ATaF)[10]。通过简单的浸渍和烘干工艺,既可以将具有高效ROS产生效率的AIE光敏剂连接在纺织物上,并且随后可以制作成各种PPE,包括外科口罩、N95口罩、白大褂和医用防护服等。当含有SARSCoV-2病毒的飞沫或者气溶胶接触到ATaF时,在低功率光照(如室内光照)下,即可产生快速杀灭病毒的作用,为穿戴者提供实时保护。同时,ATaF具有优良的耐洗性和光稳定性。基于ATaF的PPE可以重复使用100次以上,并且可以持续使用2周以上。更重要的是,ATaF与皮肤接触后并没有表现出毒性。
光动力抗菌疗法具有非侵入性、高时空精准度的特点,具有广谱抗菌、不易产生耐药性等优势,已成为当前最有前途的新型细菌感染治疗方式之一。而光敏剂产生ROS的效率是决定APDT治疗效果的关键因素。AIE光敏剂由于自身结构特点,可有效减少激发态的能量损耗,提升ROS产生效率,同时,分子结构易于设计开发,并可实现细菌的识别、靶向、实时成像等功能,成为该领域的一个研究热点。
[1]Ren Y, Liu H, Liu X, et al. Photoresponsive materials for antibacterial applications. Cell Reports Physical Science, 2020, 1(11): 100245.
[2]F Sperandio F, Huang Y Y, R Hamblin M. Antimicrobial photodynamic therapy to kill Gram-negative bacteria. Recent Patents on Anti-infective Drug Discovery, 2013, 8(2): 108-120.
[3]Castano A P, Demidova T N, Hamblin M R. Mechanisms in photodynamic therapy: part one—photosensitizers, photochemistry and cellular localization. Photodiagnosis and Photodynamic Therapy, 2004, 1(4): 279-293.
[4]Wainwright M, Maisch T, Nonell S, et al. Photoantimicrobials—are we afraid of the light?. The Lancet Infectious Diseases, 2017, 17(2): e49-e55.
[5]Gnanasekar S, Kasi G, He X, et al. Recent advances in engineered polymeric materials for efficient photodynamic inactivation of bacterial pathogens. Bioactive Materials, 2023, 21: 157-174.
[6]Mei J, Huang Y, Tian H. Progress and trends in AIE-based bioprobes: a brief overview. ACS Applied Materials & Interfaces, 2017, 10(15): 12217-12261.
[7]He X, Yang Y, Guo Y, et al. Phage-guided targeting, discriminative imaging, and synergistic killing of bacteria by AIE bioconjugates. Journal of the American Chemical Society, 2020, 142(8): 3959-3969.
[8]Dong R, Li Y, Chen M, et al. In situ electrospinning of aggregation‐induced emission nanofibrous dressing for wound healing. Small Methods, 2022, 6(5): 2101247.
[9]Xie Y Y, Zhang Y W, Liu X Z, et al. Aggregation-induced emissionactive amino acid/berberine hydrogels with enhanced photodynamic antibacterial and anti-biofilm activity. Chemical Engineering Journal, 2021, 413: 127542.
[10]Li B, Wang D, Lee M M S, et al. Fabrics attached with highly efficient aggregation-induced emission photosensitizer: Toward self-antiviral personal protective equipment. ACS Nano, 2021, 15(8): 13857-13870.
关键词:聚集诱导发光 AIE光敏剂 APDT 细菌感染 ■
