基于NLRP3信号通路探讨三痹汤对佐剂型关节炎大鼠的治疗作用及机制探讨
2024-01-25姚舒婷张春芳周晶
姚舒婷,张春芳,周晶
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.厦门大学附属翔安医院,福建 厦门 361000)
类风湿关节炎(rheumatoid arthritis,RA)是一种全身性的炎症性关节炎,其特征是进行性软骨和骨质破坏以及自身抗体的产生,以滑膜增生、关节软骨破坏及关节畸形为主要病理改变[1]。RA患者活动受限,甚至导致残疾,需要承受巨大的经济和心理压力。RA全球患病率约为1%,我国患病率约为0.28%~0.40%,其中患病男女比例为1∶3,尤其是45~54岁的女性尤为高发[2]。研究表明,RA的发病与多种因素密切相关,当疾病发生后,自身免疫系统启动,分泌大量的炎性因子,从而引发“炎性风暴”,造成骨破坏,若病情得不到控制,最终导致患者关节畸形或功能丧失[3]。西医主要依靠药物治疗,一经确诊就需终身服药,且部分患者由于不良反应、过敏等,难以坚持用药[4]。三痹汤首载于《妇人大全良方》,具有祛风湿、强筋骨、补肝肾的功效,常用于痹症的治疗[5]。药理学研究发现,在抗炎止痛、保护骨组织、提高免疫力等方面,三痹汤所含有效成分具有良好的效果[6]。课题组前期研究表明,三痹汤能够有效降低血清中TNF-α、IL-8、IL-17、IL-1、IL-6和MCP-1的含量,抑制MMP-3、明胶酶-B表达水平,调控TLR4/MAPKs/NF-κB信号通路,并可提高IL-10、TGF-β的表达,抑制炎症反应,改善骨质破坏[7]。NLRP3炎性体(NOD-like receptor thermal protein domain associated protein 3,NLRP3)在RA的发生中起关键作用,NLRP3炎性体蛋白的突变可引起RA患者NLRP3炎性体的活性增强,在RA患者细胞和滑膜中可观察到NLRP3 mRNA和NLRP3-炎性体相关蛋白和基因的高水平表达,通过激活Caspase-1,从而使IL-1β和IL-18表达升高,引起骨破坏及关节组织损伤[8]。为了进一步观察三痹汤治疗类风湿关节炎的作用机制,本研究通过复制佐剂型关节炎大鼠模型,以NLRP3信号通路为切入点,探讨三痹汤对佐剂型关节炎(adjuvant arthritis,AA)模型大鼠滑膜损伤的作用机制。
1 实验材料
1.1 实验动物
SPF级Wistar雄性大鼠60只,体质量(160±200) g,购于辽宁长生生物技术股份有限公司。许可证号:SCXK(辽)F20220531051,相对湿度为40%~70%,大鼠在正常室温下于黑龙江中医药大学附属第一医院动物房适应性喂养一周,饮水、饮食、活动自由,所有操作均符合动物伦理学要求。
1.2 药物与试剂
三痹汤组方:川续断30 g,杜仲30 g,防风30 g,肉桂30 g,细辛30 g,人参30 g,白茯苓30 g,当归30 g,白芍30 g,黄芪30 g,川牛膝30 g,甘草30 g,秦艽5 g,生地黄5 g,川芎5 g,川独活15 g,均购于黑龙江省药材公司。
三痹汤药液的制备:三痹汤遵循原方比例,将方中所有生药加3倍水浸泡1 h,大火煮沸后小火煎煮1 h,纱布过滤,收集药液。再加2倍水煮沸后煎煮1 h,收集药液。将两次药液混合在一起,浓缩至3.52 g/mL,加蒸馏水配制成三痹汤混悬液,浓度为20%,冷藏储存备用。
来氟米特混悬液的制备:将来氟米特片(福建汇天生物药业有限公司,批号:20061229)研磨成粉,用纯水配成1.8 mg/kg的来氟米特混悬液,冷藏储存备用。
试剂:注射用完全弗式佐剂(美国Sigma公司,货号:F5881);IL-1β、IL-18试剂盒(武汉赛维尔生物科技有限公司,货号:G3013);4%多聚甲醛(江苏艾迪生生物科技有限公司,批号:B0010);PBS溶液(0.01M)(江苏艾迪生生物科技有限公司,批号:B0002);10×EDTA修复液(江苏艾迪生生物科技有限公司,批号:B0015);苏木素染液(江苏艾迪生生物科技有限公司,批号:B1001);三氯甲烷(国药集团化学试剂有限公司,批号:10006818);Anti-NLRP3 antibody(武汉菲恩生物科技有限公司,批号:20221110);Anti-Caspase-1 antibody(武汉菲恩生物科技有限公司,批号:20221110);异丙醇(国药集团化学试剂有限公司,批号:80109218);无水乙醇(国药集团化学试剂有限公司,批号:10009218);HyPure TMMolecular Biology Grade Water(吉诺生物医药技术,批号:GNM14002);SweScript RT I First Strand cDNA Synthesis Kit(Servicebio,批号:G3330);HieffTM qPCR SYBR®Green Master Mix (No Rox Plus) 11201ES(Shanghai Yeasen BioTechnologies,批号:11201ES03)。
1.3 实验仪器
足容积测量仪(自制);匀浆仪(Servicebio,型号:KZ-Ⅲ-FP);台式高速冷冻型微量离心机(DragonLab,型号:D3024R);超净工作台(苏净安泰,型号:SW-CJ-1FD);超微量分光光度计(Thermo,型号:NanoDrop2000);标准试剂型纯水仪(青岛富勒姆科技有限公司,型号:FBZ2001-up-p);离心管(Biosharp);TIP头(Biosharp);酶标分析仪(Rayto RT-6100);荧光定量PCR仪(酷搏科技,Quantagene q225荧光定量PCR检测系统);普通光学显微镜(OLYMPUS,型号:CX-21);倒置显微镜(OLYMPUS,型号:Ⅸ51);成像系统(Q-IMAGING,型号:MicroPublisher);离心管、TIP头均购湿热灭菌40 min,干燥。
2 方法
2.1 动物分组及造模
60只大鼠,适应性喂养1周,随机选取10只作为空白组(Control),剩余50只大鼠制备佐剂型诱导关节炎大鼠模型。常规消毒后将其右后肢拉直,用1 mL 注射器针头于足跖中部皮内注射,每只大鼠注射0.1 mL弗氏完全佐剂,每日观察大鼠右后肢发炎肿胀情况和其他体征表现,若右后肢出现明显的发炎红肿和活动受限情况,且AI评分 ≥ 6分表明大鼠佐剂性关节炎模型诱导成功。造模后第7天所有AA大鼠AI评分 ≥6分,提示模型诱导成功。将造模成功的50只大鼠随机分为模型组(Model)、来氟米特组(LeF)和三痹汤高剂量组(SBT-H)、三痹汤中剂量组(SBT-M)、三痹汤低剂量组(SBT-L),每组10只。
2.2 给药方法
造模后第8天开始给药,连续给药3周,按大鼠与人的体表面积计算出相应的用药剂量,三痹汤高剂量组灌服三痹汤7.35 g/kg;三痹汤中剂量组灌服三痹汤3.67 g/kg;三痹汤低剂量组灌服三痹汤1.83 g/kg,来氟米特组灌服来氟米特混悬液1.8 mg/kg;模型组和空白组灌服相同体积的蒸馏水,连续灌胃21 d,每日1次,至免疫后28 d处死大鼠。
2.3 观察指标
2.3.1 关节肿胀程度
在免疫前及免疫后,每周用自制足容积测量仪测量各组大鼠右后足容积,以足容积变化情况观察足肿胀程度。
2.3.2 关节炎指数
在造模前,后续每隔7 d各组大鼠关节肿胀度并对其进行关节炎指数评分(AI),根据大鼠四肢红肿程度评为1~4分。0分,无肿胀;1分,单一趾关节红斑或轻微肿胀;2分,两个及两个以上趾关节出现中度红肿现象;3分,整个足爪包括趾跖关节在内都严重发炎红肿;4分,整个踝关节严重肿胀甚至变形。大鼠四肢关节所得的评分相加,即为关节炎指数,AI > 6分即可认为大鼠炎症明显,造模成功。
2.3.3 滑膜组织标本采集及HE病理学观察
取大鼠踝关节滑膜组织,置于4%多聚甲醛中固定,乙醇逐级脱水,二甲苯透明,石蜡包埋。进行组织切片(2~4 μm),HE常规染色。组织切片进行脱蜡,采用体积分数100%、90%、75%乙醇梯度脱水,滴加苏木素染色5 min,冲洗3 s,滴加1%盐酸乙醇分化,冲洗,滴加0.5%伊红染色液3 min,冲洗,采用体积分数75%、90%、100%乙醇脱水,滴加松节油透明,中性树胶封片。光镜下观察踝关节滑膜组织形态学病理改变。
2.3.4 血液样本采集及血清炎性指标检测
末次给药后禁食24 h,腹主动脉取血,3 000 r/min离心10 min,分离血清,采用ELISA检测试剂盒测定血清IL-1β、IL-18。检测步骤严格按试剂盒说明书进行操作。
2.3.5 PCR法检测各组大鼠滑膜组织中NLRP3 mRNA表达水平
2.3.5.1 总RNA抽提
①取匀浆管,置冰上预冷,加入1 mL的Trizol Reagent,研磨中至无可见沉淀。②12 000 r/min离心10 min取上清。③加入250 μL三氯甲烷,颠倒离心管30 s,充分混匀,静置5 min。④4 ℃ 下12 000 r/min离心15 min。⑤将上清转移到新的离心管中,加入0.8倍体积的异丙醇,颠倒混匀。⑥-20 ℃放置20 min。⑦4 ℃下12 000 r/min离心10 min,管底的白色沉淀即为RNA。⑧重复洗涤一次。⑨加入10 μL无RNA酶的水溶解RNA。⑩55 ℃孵育5 min。
2.3.5.2 反转录
反转录体系:5×Reaction Buffer 4 μL;Oligo(dT)18Primer(50 μm)1 μL;Servicebio®RT Enzyme Mix 1 μL;RNase free water 12 μL;mRNA 2 μL。
2.3.5.3 逆转录程序设置
轻轻混匀并离心,于PCR仪上进行,程序设置见表1。

表1 PCR仪程序设置
2.3.5.4 定量PCR
取0.2 mL PCR管,配制反应体系:2×SYBR Gree qPCR Master Mix 5 μL;Forward Primer 0.2 μL;Reverse Primer 0.2 μL;Nuclease-Free Water 2.6 μL;cDNA 2 μL。每个反转录产物配制3管。PCR扩增程序设置见表2。引物序列表见表3。按照ΔΔCT法计算。

表2 PCR仪扩增程序设置

表3 引物序列
A=CT(目的基因,待测样本)-CT(内标基因,待测样本)
B=CT(目的基因,对照样本)-CT(内标基因,对照样本)
K=A-B
表达倍数=2-K
2.3.6 免疫组化法检测大鼠滑膜组织中NLRP3、Caspase-1 蛋白表达
取大鼠踝关节,消毒,取出所需软骨和滑膜组织,固定,石蜡包埋切片,贴片。免疫组化染色,石蜡切片脱蜡和水化,自来水冲洗2次,PBS洗5 min×3次;修复,3%的过氧化氢孵育15 min;加一抗,37 ℃复苏35 min,PBS洗5 min×3次;加二抗,37 ℃孵育30 min,PBS洗5 min×3次;加三抗,37 ℃孵育30 min;PBS洗5 min×3次;DAB显色8 min,镜下观察,苏木素复染,室温,60 s,自来水冲洗,梯度乙醇脱水,二甲苯透明,封片。
2.4 统计学分析
采用SPSS26.0统计软件进行数据分析,计量资料以±s表示;对数据进行正态分布检验,符合正态分布且方差齐性的资料采用单因素方差分析,进一步两两比较采用LSD法;不符合正态分布且方差不齐的资料采用非参数检验,以P< 0.05为差异具有统计学意义。
3 结果
3.1 各组大鼠一般状态
造模前,各组大鼠毛色柔顺,摄食饮水正常,活动灵敏,反应灵活,二便正常,四肢爪甲呈现淡红色,精神状态良好,活泼好动;造模后,除空白组外,AA大鼠右侧足爪红肿加重,活动明显受限,毛色暗淡,摄食饮水减少,便溏,反应迟钝。见图1。

图1 各组大鼠实验结束足肿胀度的情况
3.2 各组大鼠足容积情况比较
与空白组比较,模型组大鼠在第7~28天足容积显著升高,差异有统计学意义(P< 0.05);与模型组比较,三痹汤高、中、低剂量组和来氟米特组在第7~28天足容积显著下降,差异有统计学意义(P< 0.05);与三痹汤高剂量组比较,三痹汤中剂量在第14~28天足容积升高,差异有统计学意义(P< 0.05),三痹汤低剂量在第7~28天足容积升高,差异有统计学意义(P< 0.05);与来氟米特组比较,三痹汤中剂量在第14~28天足容积升高,差异有统计学意义(P< 0.05),三痹汤低剂量在第7~28天足容积升高,差异有统计学意义(P< 0.05),三痹汤高剂量与来氟米特组比较无统计学意义(P> 0.05)。见表4。
表4 各组大鼠不同时间点足容积比较(±s,mL)
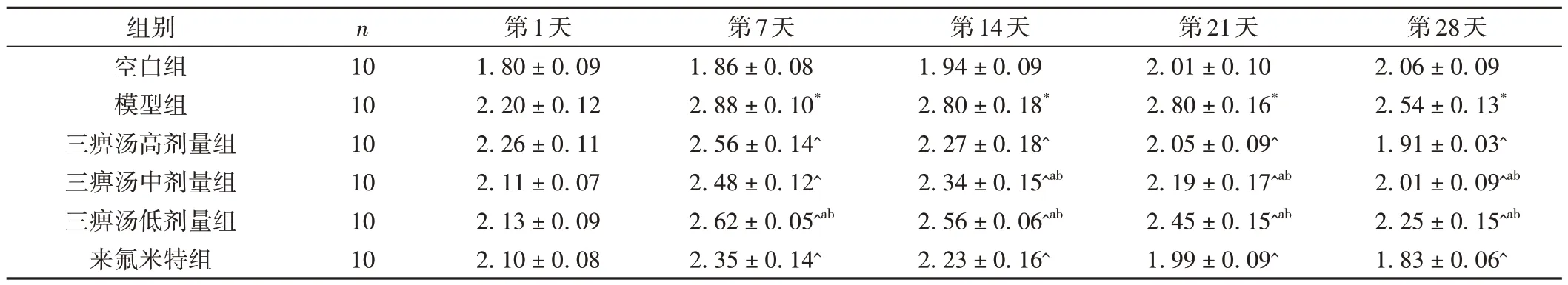
表4 各组大鼠不同时间点足容积比较(±s,mL)
注:与空白组比较,*P < 0.05;与模型组比较,^P < 0.05;与三痹汤高剂量组比较,aP < 0.05;与来氟米特组比较,bP < 0.05。
第28天2.06±0.09 2.54±0.13*1.91±0.03^2.01±0.09^ab 2.25±0.15^ab 1.83±0.06^组别空白组模型组三痹汤高剂量组三痹汤中剂量组三痹汤低剂量组来氟米特组n 10 10 10 10 10 10第1天1.80±0.09 2.20±0.12 2.26±0.11 2.11±0.07 2.13±0.09 2.10±0.08第7天1.86±0.08 2.88±0.10*2.56±0.14^2.48±0.12^2.62±0.05^ab 2.35±0.14^第14天1.94±0.09 2.80±0.18*2.27±0.18^2.34±0.15^ab 2.56±0.06^ab 2.23±0.16^第21天2.01±0.10 2.80±0.16*2.05±0.09^2.19±0.17^ab 2.45±0.15^ab 1.99±0.09^
3.3 各组大鼠关节炎指数比较
与模型组比较,三痹汤高、中、低剂量组和来氟米特组在第7~28天关节炎指数均有下降,差异有统计学意义(P< 0.05);与三痹汤高剂量组比较,三痹汤中剂量在第14~28天关节炎指数升高,差异有统计学意义(P<0.05),三痹汤低剂量在第7~28天关节炎指数升高,差异有统计学意义(P< 0.05);与来氟米特组比较,三痹汤中、低剂量在第7~28天关节炎指数均显著升高,差异有统计学意义(P< 0.05),三痹汤高剂量组在第7~28天关节炎指数变化情况无统计学意义(P> 0.05)。见表5。
表5 各组大鼠不同时间点关节炎指数比较(±s,分)

表5 各组大鼠不同时间点关节炎指数比较(±s,分)
注:与模型组比较,^P < 0.05;与三痹汤高剂量组比较,aP < 0.05;与来氟米特组比较,bP < 0.05。
第28天8.50±0.52 6.10±0.45^6.70±0.48^ab 7.25±0.35^ab 5.75±0.54^组别模型组三痹汤高剂量组三痹汤中剂量组三痹汤低剂量组来氟米特组n 10 10 10 10 10第0天7.50±0.53 7.15±0.85 7.05±0.74 7.25±0.64 7.35±0.48第7天9.20±0.42 7.90±0.73^8.46±0.41^b 8.65±0.42^ab 7.75±0.88^第14天8.95±0.49 7.70±0.58^7.90±0.45^ab 8.00±0.40^ab 6.85±0.67^第21天8.70±0.42 6.73±0.63^7.25±0.54^ab 7.80±0.33^ab 6.45±0.55^
3.4 各组大鼠踝关节滑膜组织病理形态比较
大鼠踝关节HE染色结果显示:空白组大鼠的踝关节结构比较完整,未见异常的滑膜增生,滑膜细胞排列均匀规整,未见炎性细胞的浸润,没有软骨破坏和新生血管;模型组大鼠可见滑膜组织出现异常增生,细胞排列杂乱,可见明显的炎性细胞浸润,并且部分滑膜组织侵入软骨,出现新生血管的形成;三痹汤低剂量组大鼠踝关节组织细胞排列紊乱,可见滑膜细胞增生,炎性细胞浸润,血管翳形成,以及坏死的软骨;三痹汤高、中剂量组和来氟米特组均表现出滑膜组织轻度增生或无增生,炎性细胞浸润较少,未见明显的软骨侵蚀和新生血管,改善情况从强到弱依次为来氟米特组、三痹汤高剂量组、三痹汤中剂量组。见图2。

图2 各组大鼠踝关节滑膜组织病理形态(HE,×200)
3.5 各组大鼠血清中IL-1β、IL-18含量比较
与空白组比较,模型组大鼠血清中IL-1β、IL-18含量明显上升,差异有统计学意义(P< 0.05);与模型组比较,三痹汤高、中剂量组、三痹汤中剂量加来氟米特组、来氟米特组大鼠血清中IL-1β、IL-18含量明显下降,差异有统计学意义(P< 0.05);与三痹汤高剂量组比较,三痹汤低剂量组大鼠血清中IL-1β、IL-18含量升高,差异有统计学意义(P< 0.05);与来氟米特组比较,三痹汤中、低剂量组大鼠血清中IL-1β、IL-18含量升高,差异有统计学意义(P< 0.05),三痹汤高剂量组大鼠血清中IL-1β、IL-18含量变化比较无统计学意义(P> 0.05)。见表6。
表6 各组大鼠血清中IL-1β、IL-18含量比较(±s,pg/L)

表6 各组大鼠血清中IL-1β、IL-18含量比较(±s,pg/L)
注:与空白组比较,*P < 0.05;与模型组比较,^P < 0.05;与三痹汤高剂量组比较,aP < 0.05;与来氟米特组比较,bP < 0.05。
IL-18 85.87±10.94 159.86±19.76*117.02±20.11^111.84±10.75^b 143.51±14.95^ab 109.14±20.43^组别空白组模型组三痹汤高剂量组三痹汤中剂量组三痹汤低剂量组来氟米特组n 10 10 10 10 10 10 IL-1β 16.37±3.13 39.82±4.54*29.24±5.22^31.23±2.74^b 33.49±4.55^ab 27.72±6.84^
3.6 各组大鼠滑膜组织中NLRP3 mRNA蛋白表达水平比较
与空白组比较,模型组大鼠滑膜组织中NLRP3 mRNA蛋白表达水平明显升高,差异有统计学意义(P< 0.05);与模型组比较,三痹汤高、中、低剂量组和来氟米特组大鼠滑膜组织中NLRP3 mRNA蛋白表达水平均明显降低,差异有统计学意义(P< 0.05);与三痹汤高剂量组比较,三痹汤中、低剂量组大鼠滑膜组织中NLRP3 mRNA蛋白表达水平明显升高,差异有统计学意义(P< 0.05);与来氟米特组比较,三痹汤低剂量组大鼠滑膜组织中NLRP3 mRNA蛋白表达水平明显升高,差异有统计学意义(P< 0.05)。见表7。
表7 各组大鼠滑膜组织中NLRP3 mRNA蛋白表达水平比较(±s)

表7 各组大鼠滑膜组织中NLRP3 mRNA蛋白表达水平比较(±s)
注:与空白组比较,*P < 0.05;与模型组比较,^P < 0.05;与三痹汤高剂量组比较,aP < 0.05;与来氟米特组比较,bP < 0.05。
NLRP3 1.00±0.01 4.62±0.20*1.51±0.05^2.71±0.10^a 3.37±0.21^ab 2.64±0.43^组别空白组模型组三痹汤高剂量组三痹汤中剂量组三痹汤低剂量组来氟米特组n 10 10 10 10 10 10
3.7 PCR扩增曲线和熔解曲线
目的基因NLRP3与内参基因GAPDH不同CT值的扩增曲线呈S形,拐点清晰、整体平行性很好,并且目的基因与内参基因扩增曲线倾斜程度相似,说明目的基因与内参基因扩增效率基本一致,扩增良好。扩增产物熔解曲线呈单一峰,其他位置未出现波形,说明产物特异性良好,且无污染。见图3。

图3 NLRP3与GAPDH扩增曲线和熔解曲线
3.8 各组大鼠滑膜组织中NLRP3、Caspase-1蛋白表达比较
与空白组比较,模型组大鼠滑膜组织中NLRP3、Caspase-1蛋白表达明显升高,差异有统计学意义(P< 0.05);与模型组比较,除三痹汤低剂量组外,其余各组大鼠滑膜组织中NLRP3、Caspase-1蛋白表达明显降低,差异有统计学意义(P< 0.05);与三痹汤高剂量组比较,三痹汤中、低剂量组大鼠滑膜组织中NLRP3、Caspase-1蛋白表达明显升高,差异有统计学意义(P< 0.05);与来氟米特组比较,三痹汤中、低剂量组滑膜组织中NLRP3、Caspase-1蛋白表达水平升高,差异有统计学意义(P< 0.05),三痹汤高剂量组滑膜组织中NLRP3、Caspase-1蛋白表达水平变化比较无统计学意义(P> 0.05)。见图4~5和表8。

图4 各组大鼠滑膜组织中NLRP3蛋白表达情况(×400)

图5 各组大鼠滑膜组织中Caspase-1蛋白表达情况(×400)
表8 各组大鼠滑膜组织中NLRP3、Caspase-1蛋白表达比较(±s)

表8 各组大鼠滑膜组织中NLRP3、Caspase-1蛋白表达比较(±s)
注:与空白组比较,*P < 0.05;与模型组比较,^P < 0.05;与三痹汤高剂量组比较,aP < 0.05;与来氟米特组比较,bP < 0.05。
CasPase-1 38.38±3.86 70.10±4.35*47.73±2.71^56.34±5.55^ab 59.29±3.67ab 55.11±3.51^组别空白组模型组三痹汤高剂量组三痹汤中剂量组三痹汤低剂量组来氟米特组n 10 10 10 10 10 10 NLRP3 13.29±1.39 51.83±5.41*16.47±1.50^25.09±2.98^ab 31.30±2.24ab 20.83±2.05^
4 讨论
痹证的病因为在风寒湿外邪等因素影响下,外邪侵袭导致经脉痹阻,气血运行失常,以致血瘀气滞,津停为痰,不通则痛,引发痹痛[9]。发病日久,肝肾亏损,气血亏虚,元气大伤,形成虚痹。故痹证的病机总结为正气不足,卫外不顾。三痹汤以补肝肾、祛风湿、强筋骨为立方依据。痹症以正气亏虚为本,风、寒、湿、热、痰等邪侵袭人体四肢筋骨、关节、肌肉为标,而痹症病机关键即经脉痹阻[10]。三痹汤中人参、茯苓意在治疗痹症日久,正气亏虚,配伍甘草调和诸药,降燥烈之性补亏虚正气;气血不足,气虚血弱,不能濡养经脉,血虚则肢体不荣,肢端麻木,运动不灵,气虚则推动无力,血行瘀阻。方中熟地黄、白芍、当归、川芎,养血补血,活血化瘀。黄芪益气固表,扶正祛邪。杜仲具有滋补肝肾及增强肌肉和骨骼的作用。续断具有调理肝肾、增强肌肉和骨骼以及治疗跌打损伤的功效[11]。间歇性活性成分可保护骨组织,具有消炎、镇痛等作用。独活、秦艽为治疗关节痛的对药,两者合用,使其祛风胜湿,除痹止痛功效更佳,正切病机[12]。
通过定期观察AA大鼠关节肿胀度,笔者发现灌胃给药结束后三痹汤高、中、低剂量组和来氟米特组大鼠关节肿胀程度以及关节炎指数明显低于模型组,且三痹汤高剂量及来氟米特组效果最优,差异有统计学意义,同时HE结果也显示三痹汤高剂量组及来氟米特组较模型组病变程度明显减轻,踝关节滑膜中只有少量的炎性细胞浸润,少量血管翳形成,成纤维样细胞增生较少,关节软骨增生及骨质破坏较少。三痹汤中剂量组大鼠滑膜损伤较模型组明显减轻,三痹汤低剂量组大鼠滑膜损伤与模型组大鼠滑膜损伤相比无明显变化。提示三痹汤有良好的抗炎效果,且药物疗效与给药剂量有关。在本实验中,三痹汤高剂量组大鼠与来氟米特组大鼠踝关节病理改善程度基本一致,说明三痹汤同样可以有效抑制机体炎症反应,延缓RA进展。总体来说,三痹汤高剂量及来氟米特组对AA大鼠模型组踝关节病变的改善功效基本一致,优于三痹汤中、低剂量组。
RA炎症反应以炎性因子过量产生为特征,大量高度活化的炎性因子浸润RA患者滑膜组织内,破坏其软骨并带来一系列关节损伤。IL-1β和IL-18这两种有效致炎因子,能够迅速招募炎性细胞从而引起一系列炎症反应,并发挥其免疫作用使RA愈演愈重[13]。为了进一步探讨三痹汤对AA大鼠炎症反应的影响,本研究检测了各组大鼠血清中IL-1β和IL-18含量。结果显示,三痹汤高、中、低剂量和来氟米特都可以明显降低AA大鼠血清中IL-1β、IL-18含量,尤其是三痹汤高剂量组和来氟米特组,且呈剂量依赖性。三痹汤高剂量组大鼠血清IL-1β、IL-18含量与来氟米特组大鼠基本一致,说明三痹汤同样可以有效抑制机体炎症反应,延缓RA进展。
目前大量研究表明,NLRP3信号通路在RA的发生、发展过程中发挥着重要的作用,其是机体固有免疫的重要组成部分[14],可通过模式识别受体(PRR)识别内源性或者外源性刺激因素,从而聚集Caspase-1并使其激活,并剪切IL-1β及IL-18的活性前体pro-IL-1β及pro-IL-18,促进其成熟,产生成熟的细胞因子并释放,最终导致RA过程中的一系列炎症反应[15]。本研究结果显示,与空白组相比,模型组大鼠血清中IL-1β和IL-18含量显著升高;踝关节滑膜组织中NLRP3、Caspese-1的表达显著升高;NLRP3 mRNA蛋白表达水平显著升高,可知NLRP3炎性信号通路的激活参与了RA的发病过程。通过病理检查不难发现,模型组病变最为严重,大量炎性细胞浸润及肉眼可见的肿胀,这提示我们NLRP3的激活对炎症的发生、发展具有很大的促进作用。经过相应药物治疗后,三痹汤高、中、低剂量组以及来氟米特治疗组大鼠血清中IL-1β和IL-18含量均降低;踝关节滑膜组织中NLRP3、Caspase-1的表达均降低;NLRP3 mRNA蛋白表达水平降低。模型组可能因NLRP3信号通路上游因子NLRP3、Caspase-1激活而致下游因子IL-1β、IL-18合成分泌过多,引起炎性细胞聚集,因而引起关节肿胀、活动受限,而三痹汤发挥其抗炎、镇痛、保护骨组织及提高免疫力等功效,可能通过抑制NLRP3信号通路上游因子NLRP3、Caspase-1的激活阻止IL-1β、IL-18的生成,从而达到对AA大鼠的治疗作用。通过观察三痹汤各剂量组对降低大鼠足容积、关节炎指数评分以及炎性因子水平的影响,发现治疗效果呈剂量依赖性。其中三痹汤高剂量组效果最好,其次是三痹汤中剂量组,三痹汤低剂量组效果最差。来氟米特组大鼠踝关节滑膜组织中NLRP3通路相关蛋白因子表达均低于三痹汤中、低剂量组,而三痹汤高剂量组低于来氟米特组,说明高剂量三痹汤在抑制NLRP3信号通路相关蛋白因子表达方面强于来氟米特。
5 结论
三痹汤能够减轻AA大鼠关节肿胀度,改善滑膜组织病理损伤,并通过抑制NLRP3信号通路的激活,降低大鼠血清IL-1β、IL-18水平,对佐剂型关节炎大鼠起到治疗作用。
