BNIP3 介导线粒体自噬研究进展
2024-01-23黄景珠成秋宸李福建刘泽峰
黄景珠,成秋宸,李福建,刘泽峰,张 国
(1.右江民族医学院研究生学院,广西 百色 533000;2.广西医学科学院.广西壮族自治区人民医院消化内科,广西 南宁530000;3.中山大学附属第一医院广西医院消化内科,广西 南宁 530000)
自噬是细胞利用溶酶体降解细胞质中细胞器和蛋白质等物质,并在营养缺乏或受到外界刺激的情况下保护细胞内环境的稳定。根据降解底物的不同,自噬可分为选择性自噬与非选择性自噬。广义自噬通常为非选择性,但是当细胞自噬定向性清除受损伤细胞器时,表现为相应的选择性自噬,如线粒体自噬、过氧化物酶体自噬、内质网自噬等。线粒体自噬作为线粒体质量控制的关键组成部分,可及时靶向消除受损或功能失调的线粒体,从而防止过量的活性氧(ROS)产生,以及线粒体促凋亡因子和损伤相关分子模式(DAMP)的释放,这些因子和损伤相关分子模式(DAMPs)可能与疾病发生、发展密切相关[1]。 线粒体自噬需诱导自噬和线粒体启动以进行自噬识别,线粒体自噬有两种启动机制,一种依赖于PTEN 诱导的激酶1(PINK1)-帕金RBR E3 泛素蛋白连接酶(PARK2)途径,另外一种依赖于线粒体自噬受体BCL2 相互作用蛋白3(BNIP3)或NIX(BNIP3 类似物,BNIP3L)途径[2]。最新研究表明,线粒体自噬与人类疾病密切相关[3]。
BNIP3 最初发现位于人类染色体10q26.3 上并被称为“NIP3”,被认为属于细胞死亡调节因子Bcl-2 家族,生化结构上,BNIP3 是一种能与腺病毒E1B19kD 蛋白相互作用的蛋白质,主要由4 个功能结构域组成,分别为参与蛋白降解的PEST 结构域、介导Caspase 依赖性线粒体凋亡的BH3 结构域、NH2 结构域、跨膜结构域和羧基端结构域,后者是BNIP3 行使其促Caspase 非依赖性凋亡功能最重要的结构域[4]。近年来随着研究不断深入,BNIP3 在线粒体自噬中的作用备受关注,相关研究领域进展飞快。本文对近年来BNIP3 介导线粒体自噬的机制及其在疾病中的研究进展进行综述。
1 BNIP3 介导的线粒体自噬机制
线粒体自噬是自噬的一种选择性形式,其中线粒体被特异性靶向自溶酶体中的降解,线粒体自噬不仅限于功能失调的线粒体的周转,而且还会减少线粒体的整体质量以应对压力,例如缺氧和营养饥饿[5]。BNIP3 是 一 种 通 过 其C 末 端 跨 膜 结 构 域(TMD)嵌合在线粒体外膜上的蛋白,它面向胞质侧的N 末端旁含一WXXL 模序结构(即LIR),通过该结构可以直接结合LC3 或GABARAP(LC3 同源),从而诱导线粒体自噬[6]。此外,BNIP3 也是一种线粒体自噬受体,同时充当诱导分子受体,通过保守的LC3 相互作用区(LIR)基序直接相互作用,选择性靶向线粒体以进行自噬体降解[7]。同时研究发现,BNIP3 必须首先发生二聚化形成同源二聚体,其线粒体自噬活性受其同源二聚化的调节,这种修饰促进了BNIP3 和LC3 之间的相互作用,导致自噬体募集到线粒体进行线粒体自噬,这与其TMD 结构相关[7]。除了与LC3 结合诱导线粒体自噬外,BNIP3 还可间接诱导线粒体自噬[3]:(1)BNIP3 基因的启动子区域还含有缺氧诱导因子1(HIF-1)的结合位点,其在缺氧条件下上调其表达,诱导线粒体自噬;(2)BNIP3 可通过促进PARKIN 的线粒体易位和促进PARKIN 介导的线粒体自噬来参与泛素依赖性线粒体自噬;(3)BNIP3 可以通过隔离RHEB 来阻止mTOR 的激活,从而激活自噬。裂变诱导的线粒体去极化是触发线粒体自噬的重要因素,目前已有研究证实多项清除线粒体去极化的机制,在生理状态下的去极化可能是线粒体膜通透性转换(MPT)活化的结果或线粒体外膜透化(MOMP)的间接作用。有研究表明,BNIP3 可敏化线粒体中的BAX(BCL2 相关X,细胞凋亡调节剂)和BAK(BCL2 拮抗剂/杀伤剂1)插入和激活,这是线粒体外膜透化的关键步骤,导致膜间线粒体空间中的促凋亡因子释放到细胞质中以启动细胞凋亡级联[1]。
2 BNIP3 介导的线粒体自噬在疾病中的研究
2.1 肿瘤
线粒体自噬在肿瘤中的作用机制仍未清楚,但已有证据表明线粒体自噬与肿瘤的发生、发展密切相关[8]。BNIP3 作为线粒体自噬的重要介质之一,其在调控着线粒体自噬中起着十分重要的作用,对于肿瘤的发展起着双重作用,可促进细胞存活或抑制肿瘤细胞生长。
在某些肿瘤中,BNIP3 介导的线粒体自噬可促进肿瘤发生、发展。Hu 等[9]采用生物信息学方法发现BRCA 中含有4 个基因(BCL2、LEF1、PLK1 和BNIP3)的表达可作为BRCA 的预后生物标志物,综合分析显示BNIP3 高表达的BRCA 患者OS、DSS 和DFS 较差,由此可见BNIP3 可促进乳腺浸润癌发生、发展。在乳腺癌细胞中,下调BNIP3 抑制线粒体自噬,从而促进乳腺癌细胞凋亡[10];在宫颈癌细胞中,上调BNIP3 可促进HeLa 细胞增殖,促进宫颈癌的发生、发展[11]。在卵巢癌细胞中,下调BNIP3 的表达可抑制线粒体自噬,降低细胞迁移和侵袭能力[12]。在皮肤黑色素瘤(SKCM)队列中,通过比较具有“高”BNIP3 水平和“低”BNIP3 水平的SKCM 患者发现BNIP3 表达较高的SKCM 患者表现出显着降低的总生存期(OS),进一步体内、体外实验表明从黑色素瘤细胞中去除BNIP3 可延缓肿瘤细胞生长[13]。在非小细胞肺癌细胞系A549 和SK-1 细胞中,通过下调BNIP3 和NIX 抑制线粒体自噬从而诱导细胞凋亡,以此抑制非小细胞肺癌细胞生长[14]。在肝细胞癌中,Yao 等[15]研究发现,抑制BNIP3 的转录,阻断了PINK1-PRKN 介导的线粒体自噬的启动,诱导PINK1 蛋白的不稳定并减少PRKN 在线粒体的募集,抑制肿瘤细胞发生、发展;Dai 等[16]研 究发现,上调BNIP3 介导线粒体自噬诱导HepG2 细胞凋亡。在结直肠癌细胞中,沉默BNIP3 可减少缺氧条件下肿瘤起始细胞(TIC)集落的形成[17]。
BNIP3 介导的线粒体自噬除了可促进肿瘤的发生、发展外,也有研究表明可抑制肿瘤细胞生长。在胃癌细胞中,上调BNIP3 表达,并激活线粒体自噬,从而抑制胃癌细胞增殖[18]。在肺癌细胞中,Zeng 等[19]研究发现,环维罗布辛D(CVB-D)治疗肺癌细胞可显著抑制BNIP3 转录抑制因子p65 的表达,p65 下调可显著缓解其在CVB-D 治疗后对BNIP3 转录的抑制,并可引起BNIP3 表达增强,从而增强其与LC3 的相互作用,介导线粒体自噬活化,这种线粒体自噬介导的线粒体功能障碍通过靶向p65/BNIP3/LC3 轴是CVB-D 诱导的细胞凋亡的主要机制,进一步体内实验揭示在荷瘤小鼠中,经CVB-D 治疗后荷瘤小鼠皮下移植瘤呈现出生长迟缓。
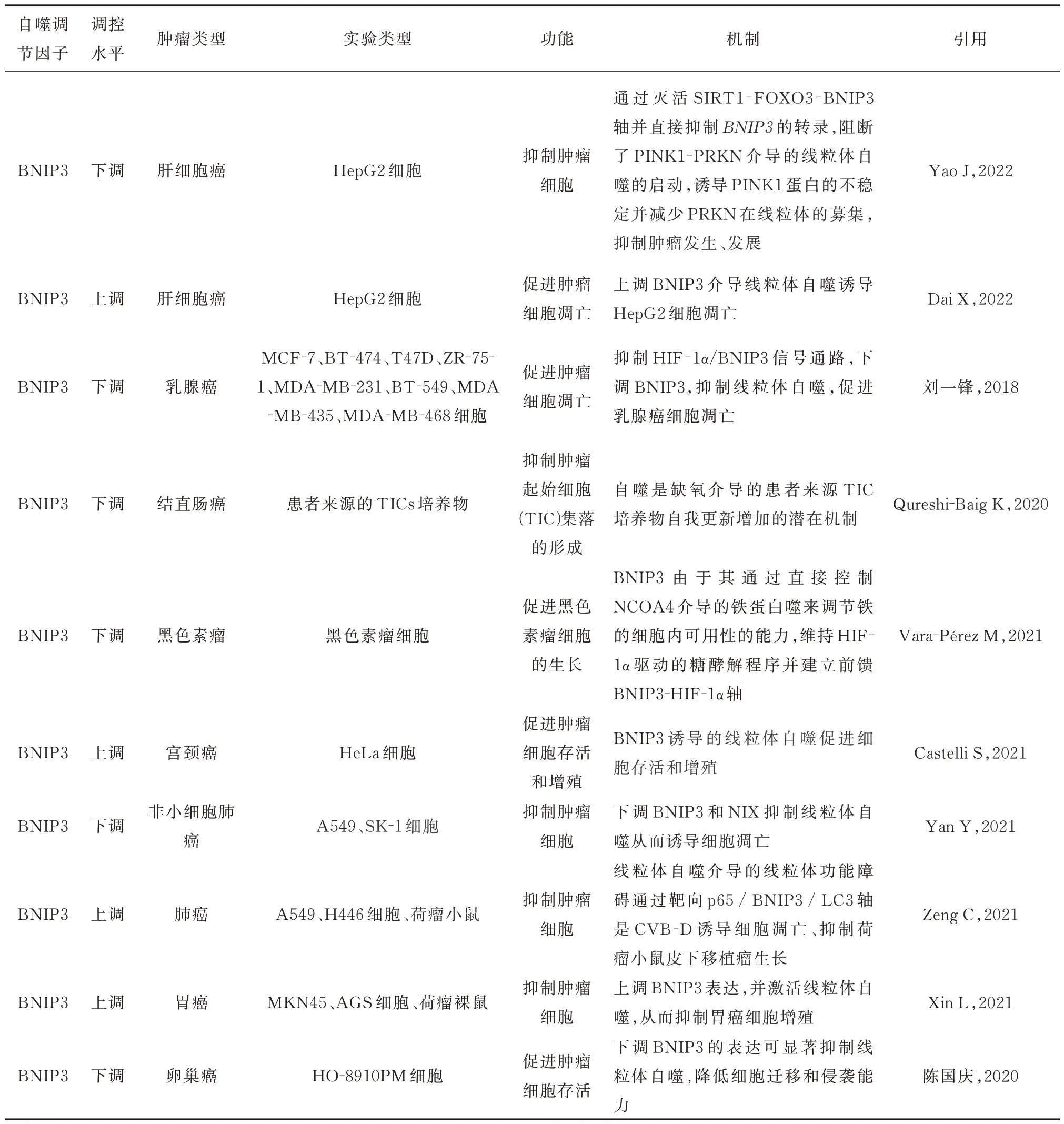
表1 BNIP3 在肿瘤中的作用机制Tab 1 Mechanism of action of BNIP3 in tumors
2.2 心血管疾病
BNIP3 与心脏疾病密切相关,在缺氧、心脏肥大或缺血期间BNIP3 蛋白的表达增加[20]。同时也有研究表明,当缺氧与心肌细胞酸中毒相关时,BNIP3 诱 导 细 胞 凋 亡 而 不 是 自 噬[21]。BNIP3 在 心脏疾病中的作用仍有待于进一步研究。
BNIP3 在心肌缺血再灌注损伤中具有双重作用,BNIP3 的过表达会损害心肌缺血再灌注(I/R)表型,伴有细胞凋亡、ROS 生成、线粒体碎裂和功能障碍增加,与此同时也发现,在I/R 中诱导BNIP3介导的线粒体自噬有助于去除受损的线粒体并保护心肌细胞免于凋亡[20];在复氧(HR)损伤处理中,观察到HR 损伤促进了Ser17 位点的Bnip3 磷酸化,磷酸化后的Bnip3 具有增加的Bnip3 与LC3 相互作用的能力,激活了BNIP3 介导的线粒体自噬[22]。近年来诸多研究表明[22-25],下调BNIP3 蛋白表达,抑制线粒体自噬从而起到防止心肌缺血再灌注损伤的作用。与此相反,Zhang 等[26]研究发现,含有5 的Jumonji 结构域(JMJD5)通过介导HIF-1α-BNIP3 通路,增强BNIP3 表达,进而对OGD/R 诱导的心肌细胞损伤起到保护作用。近年来误食乌头碱的人群不在少数,误食乌头碱后会出现一系列症状,其中较为严重的是心脏毒性,这可使心肌损伤,Peng等[27]研究发现,乌头碱抑制心肌细胞增殖,并以剂量和时间依赖性方式诱导炎症和细胞凋亡,进一步通过RNA 测序,基因集富集分析(GSEA)结果显示,经乌头碱干预后的心肌细胞炎症、细胞凋亡与自噬相关,该团队进一步研究表明,乌头碱诱导的心肌细胞损伤可能诱导TNFα 活化,然后抑制BNIP3 依赖性线粒体自噬,在体内实验中,通过心内注射BNIP3 过表达腺病毒,结果表明BNIP3 的过表达明显抑制了乌头碱诱导的心肌损伤,其机制可能是通过增强线粒体自噬有效地逆转了乌头碱诱导的心脏毒性,这为临床治疗提供了新思路。
在扩张型心肌病(DCM)模型中发现,BNIP3 蛋白表达下降,线粒体自噬受损,进而致使心肌细胞功能和DCM 的宏观表型受损,这一系列变化表明,BNIP3 介导的线粒体自噬在DCM 中发挥着重要作用,增强BNIP3 蛋白表达水平,可能为治疗DCM 提供一种新的治疗策略[28]。
在线粒体自噬受体依赖性途径中起关键作用的Bnip3 的表达可在IL-6 刺激后增加,Huo 等[29]研究发现通过横主动脉收缩(TAC)诱导心肌炎症,经雷洛昔芬干预后,可观察到雷洛昔芬可以阻断过度激活的IL-6/STAT3 信号传导,并通过减少氧化应激和调节线粒体自噬水平来缓解炎症,进一步实验研究发现在该实验中Bnip3 蛋白表达下降,该团队研究表明Bnip3 蛋白表达下降,调节线粒体自噬,以缓解TAC 诱导的心肌炎症,心脏重塑和功能障碍,对心力衰竭疾病有一定的临床意义。
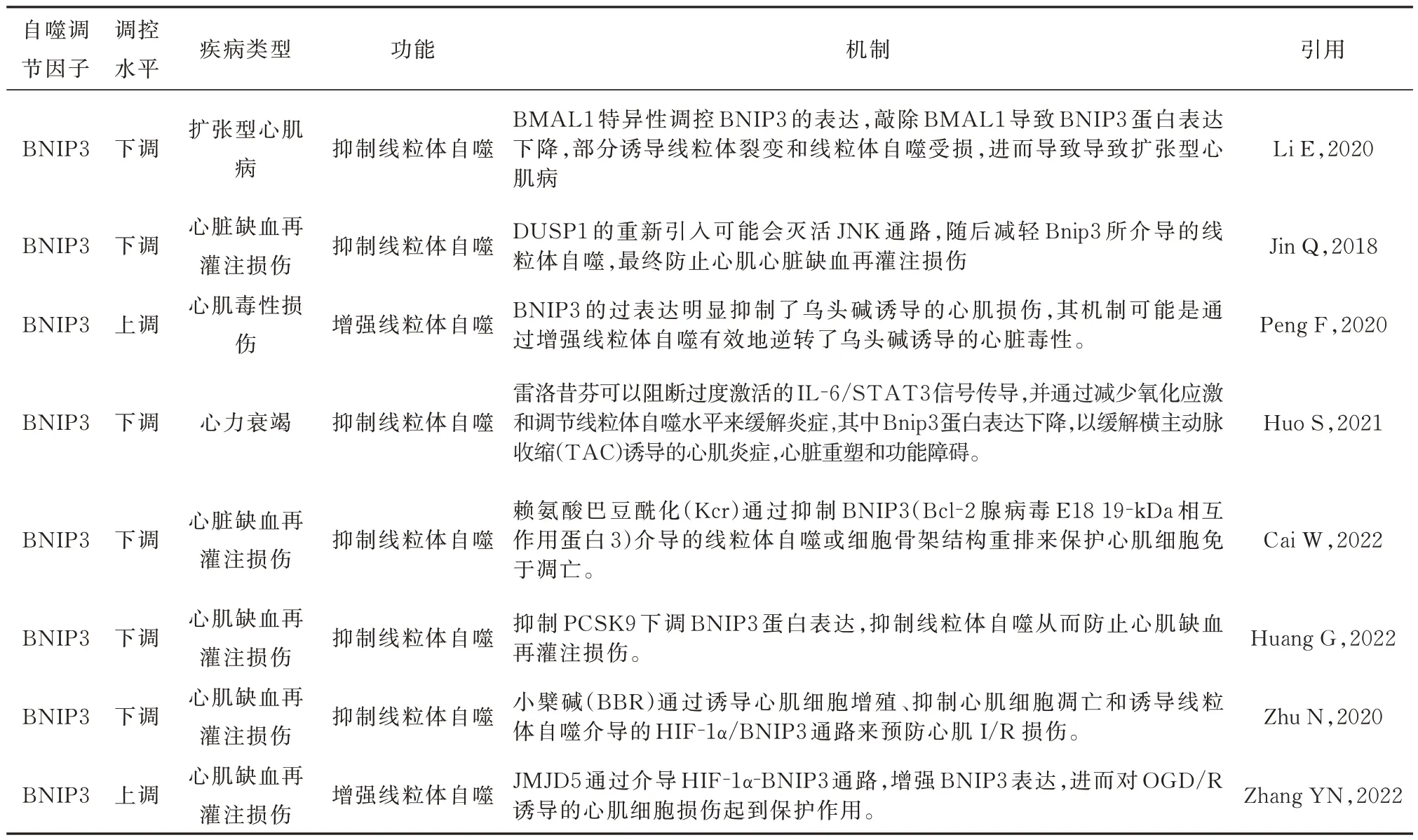
表2 BNIP3 在心脏疾病中的作用机制Tab 2 Mechanism of action of BNIP3 in heart disease
2.3 肝脏疾病
BNIP3 介导的线粒体自噬与非酒精性脂肪性肝病、酒精性脂肪性肝病、肝纤维化等疾病相关。在非酒精性脂肪性肝病研究中,Li 等[30]研究发现,上调Bnip3 介导的线粒体自噬,可减轻线粒体损伤并抑制线粒体依赖性肝细胞凋亡,从而改善饮食诱导的非酒精性脂肪性肝病;Gong 等[31]研究发现,上调BNIP3 蛋白,增强了线粒体自噬,缓解了肝脂肪变性程度。在酒精性脂肪性肝病研究中,Wu 等[32]研究发现,Hif-2α 水平与线粒体自噬之间可能存在负相关关系,体内、外实验均表明,Hif-2α 的缺失启动了线粒体自噬,这种现象可以减少肝脏脂质积累,且参与肝脂肪酸β 氧化的PPAR-α/PGC-1α 信号通路受到BNIP3 介导的线粒体自噬的负调控,该团队研究表明BNIP3 介导的线粒体自噬可调节酒精性脂肪肝病的脂质代谢。在肝纤维化研究中,Wang等[33]研究发现XBP1 激活显著抑制了BNIP3 介导的线粒体自噬并加剧了肝纤维化,进一步实验揭示了Xbp1 敲除通过促进巨噬细胞中BNIP3 介导的线粒体自噬激活来减少ROS 的产生,有助于改善肝纤维化。
2.4 肾脏疾病
在氧-葡萄糖剥夺再灌注(OGD-R)后培养的肾近端肾小管上皮细胞以及肾缺血再灌注诱导的小鼠损伤模型中发现,肾小管中的BNIP3 表达增加,进一步通过沉默肾小管细胞中Bnip3,可减少OGDR 诱导的线粒体自噬,并增强OGD-R 诱导的细胞死亡;同时体内实验也证实,Bnip3 敲除后加重了肾缺血再灌注损伤,减少了线粒体自噬,导致受损线粒体的积累,活性氧的产生增加,并增强肾脏IR 后肾脏的细胞死亡和炎症反应[1]。此外,有研究表明[34],BNIP3 介导的线粒体自噬与糖尿病肾病进展密切相关,通过调节BNIP3 介导的线粒体自噬,恢复了异常的线粒体功能障碍和线粒体质量控制,可逆转糖尿病肾病进展。
2.5 神经系统疾病
自噬与神经元分化过程密切相关,在某些情况下,自噬可通过消除蛋白质聚集体和衰老细胞器的降解来支持细胞稳态,这两者都对发育和成年期的神经元细胞存活和分化至关重要。研究表明,神经元中的BNIP3 基因在海马体的缺血性CA3 区域中下调,但在激活独特的神经元保护程序或死亡中仍然起着关键作用,而无需去除改变的蛋白质或线粒体[35]。
慢性缺氧、间歇性缺氧(IH)、慢性脑灌注不足(CCH)、神经元缺血再灌注损伤等会造成神经元细胞损伤。在慢性缺氧中,自噬降解受损和BNIP3 介导的低效线粒体自噬可能是神经元细胞损伤的机制[36]。而Yu 等[37]研究发现,敲低BNIP3 基因的表达可保护脊髓神经元免受缺氧诱导的细胞死亡。BNIP3 在缺氧诱导神经元损伤机制中发挥着不同作用,其机制有待于更多研究证实。有研究表明[38],激活BNIP3 介导的线粒体自噬,可显著抑制IH 小鼠海马体中NLRP3 炎症小体的形成和小胶质细胞的浸润,减少神经元凋亡和海马炎症;在神经元缺血再灌注损伤研究中也发现,通过激活BNIP3介导的线粒体自噬可保护神经元免受缺血再灌注损伤[39]。在CCH 研究中发现,与慢性缺氧、IH、神经元缺血再灌注损伤不同的是,CCH 切断了BNIP3所需的线粒体自噬,最终阻止异常的过度自噬和线粒体自噬,减缓CCH 诱导的神经元凋亡[40]。在1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的小鼠为帕金森病模型中发现,普拉克索(PPX)通过调节BNIP3 介导的线粒体自噬削弱了MPTP 诱导的小鼠神经元损伤[41]。
2.6 其他
近来,研究表明,在先兆子痫(PE)患者中的BNIP3 表达降低,进一步研究表明失调的BNIP3 与PE 的线粒体自噬受损,氧化应激和细胞凋亡有关[42]。BNIP3 介导的线粒体自噬在软骨细胞中表现出不一样的作用, Kim 等[43]研究发现,BNIP3 的过表达通过上调软骨降解酶和软骨细胞死亡来刺激线粒体自噬和软骨降解,对维持软骨稳态具有重要意义;Lin 等[44]研究发现,HIF-1α 抑制BNIP3 的表达,进而介导软骨细胞线粒体自噬过程,部分减弱去铁胺(DFO)对软骨细胞铁超负荷的保护作用,通过线粒体自噬防止血友病性关节病(HA)的发展。在减轻哮喘症状及改善气道平滑肌(ASM)重塑方面,BNIP3 发挥重要作用,通过BNIP3 调节线粒体功能和粘附蛋白的表达来调节ASM 的粘附、迁移及增殖[45]。
3 总结及展望
综上所述,BNIP3 是调节线粒体自噬关键因子,在线粒体自噬研究领域中备受关注。本文综述了近5 年BNIP3 介导的线粒体自噬最新研究进展,并总结BNIP3 介导的线粒体自噬与肿瘤、心血管疾病、肝脏疾病、肾脏疾病、神经系统疾病及其他疾病的关系。由于自噬在疾病中扮演的角色不同,其发挥的作用也有差异。BNIP3 在肿瘤、心肌缺血在灌注损伤、缺氧诱导神经元细胞损伤等多种疾病中,均表现出双重作用,可促进疾病发生、发展,又可对疾病起到保护作用,这可能与疾病类型或疾病所处阶段相关。相较于经典的PINK1-parkin 通路,BNIP3 介导的线粒体自噬研究在各种疾病的研究中仍不够充分与深入,具体作用机制仍未清晰,在未来研究中,需更多的研究人员参与到BNIP3 介导的线粒体自噬研究中去,以期发现一些新靶点,为疾病诊治提供新思路。
作者贡献度说明:
黄景珠:进行文章的构思与设计,撰写论文;成秋宸、李福建、刘泽峰:进行文献/资料收集、整理;张国:进行文章的可行性分析及论文的修订,负责文章的质量控制及审校,对文章整体负责、监督管理。
所有作者声明不存在利益冲突关系。
