猪肺炎支原体通过抑制SPLUNC1 功能破坏呼吸道炎性反应平衡
2024-01-17王海燕张珍珍倪博刘蓓蓓冯志新
王海燕,张珍珍,倪博,刘蓓蓓,冯志新✉
1 江苏省农业科学院兽医研究所/农业农村部兽用生物制品工程技术重点实验室/国家兽用生物制品工程技术研究中心,南京 210014;2 兽用生物制品(泰州)国泰技术创新中心,江苏泰州 225300
0 引言
【研究意义】 猪肺炎支原体(Mycoplasma hyopneumoniae,Mhp)是引起猪支原体肺炎的病原,也是猪呼吸道综合征的重要病原之一,传染性强、感染率高,可引起持续性感染,被认为是猪场最常发生、流行最广和最难净化的重要疫病之一,给养猪业带来重大经济损失[1-4]。Mhp 主要通过呼吸道黏膜侵入机体,破坏呼吸道炎性反应平衡,引起炎性损伤是Mhp的主要致病途径,而其机制尚不清楚[5-6]。因此,揭示Mhp 破坏炎性反应平衡的机制对于解决Mhp 持续性感染问题具有重要意义,也可为开发Mhp 新的疫苗或药物设计靶点提供新的思路。【前人研究进展】Mhp感染入侵的过程中,Mhp 可招募或诱导上皮细胞、巨噬或中性粒等免疫细胞分泌表达TNFα、IL-1β以及CXCL8 等炎性细胞因子,引起宿主过度的免疫应答,造成肺脏淋巴细胞、中性粒细胞以及单核细胞浸润,炎性因子过度表达,临床表现为肺部肉变[1,5,7]。因此,宿主过度免疫反应导致的炎性损伤是Mhp 主要的致病因素。面对Mhp 的感染入侵,肺脏可通过炎性反应调控,抑制过度炎性损伤,维护肺脏平衡。如Mhp 感染DC 或单核细胞后,可诱导宿主产生抑炎性细胞因子IL-10,IL-10 可帮助宿主抑制过度表达的炎性因子,维护机体稳定[8-9]。然而,Mhp 感染后如何拮抗宿主的炎性调控功能,破坏炎性反应平衡,引起炎性损伤,目前仍知之甚少。短的上腭、肺及鼻咽上皮克隆1蛋白(SPLUNC1)是一种稳定表达于呼吸道黏膜中并且含量最高的天然免疫功能蛋白[10-11]。SPLUNC1具有调控呼吸道的炎性反应,抑制细菌或病毒生长等多种重要功能[12-15]。在正常生理状态下,肺脏中SPLUNC1 稳定表达,并通过其多种天然免疫调控功能抵抗外来病原感染,维持黏膜稳定;在感染致病状况下,SPLUNC1 存在表达失调或功能缺失[10]。绿脓杆菌、肺炎链球菌或流感病毒的小鼠肺部感染模型中,SPLUNC1 的蛋白或mRNA 表达水平显著下调[16]。人肺炎支原体或肺炎克雷伯菌感染后,肺部SPLUNC1 表达显著上调[17]。除此以外,LPS 刺激后,SPLUNC1 表达还呈现先上调后下调的动态变化[10]。SPLUNC1 在不同的感染状况下所呈现出的表达失调,是呼吸道和病原之间相互斗争、相互抗衡的结果。因此,SPLUNC1 也被认为是呼吸道黏膜面对危险信号时的“信号传感器”[10]。【本研究切入点】明确感染状态下SPLUNC1 表达调控机制,对于控制病原感染,维护呼吸道健康具有重要的意义。然而,SPLUNC1 在Mhp 感染引起炎性损伤过程中的作用目前尚未见报道。因此,本研究以Mhp 与SPLUNC1 相互作用为切入点。【拟解决的关键问题】明确Mhp 对SPLUNC1 体内外表达的影响,阐明SPLUNC1对Mhp诱导炎性因子表达的作用,揭示Mhp通过SPLUNC1 蛋白破坏宿主炎性反应平衡的机制。本研究对了解Mhp 持续性感染机制具有重要意义,也可为开发Mhp 新的疫苗或药物设计靶点提供新的思路。
1 材料与方法
试验于2018—2022 年在江苏省农业科学院兽医研究所完成。
1.1 材料
1.1.1 细胞和菌株 猪支气管上皮细胞系(PBECs)由江苏省农业科学院兽医研究所构建和保存,猪肺炎支原体(JS 株)的细胞毒和组织毒,均由江苏省农业科学院兽医研究所分离、鉴定和保存。
1.1.2 实验动物 2—3 月龄Mhp 抗原、抗体检测阴性的健康仔猪,4—6 周龄的Balb/c 小鼠购自扬州大学实验动物中心,均饲养于带通风和高效过滤系统的江苏省农业科学院实验动物中心,用不含抗生素的饲料饲喂。
1.1.3 主要试剂 RNA 提取试剂盒,反转录酶,2×SYBR Green PCR Mix,2×PhantaTM Master Mix(诺维赞生物科技有限公司,江苏,南京)。SPLUNC1兔单抗(Lsbio,美国),ERK 兔单抗、p-ERK 兔单抗和β-actin 鼠单抗(碧云天生物科技有限公司,江苏,南通),Mhp P97 鼠单抗(2A10)为实验室自制。Lipo3000 转染试剂(Invitrogen,美国),TNF-α、IL-1β和CXCL8 检测试剂盒(SAB,美国)。其他均为常规化学试剂。
1.2 方法
1.2.1 实验猪攻毒和组织样品采集 参考文献[18-19]方法进行气管内攻毒,感染组每头注射5 mL Mhp 组织毒悬液,对照组每头猪注射5 mL PBS。注射完毕,保持保定姿势10 s 以上,防止注射物咳出。攻毒后28 d,剖杀并分离肺脏组织,观察肺脏肉变;取肺泡灌洗液,按照试剂盒说明,利用细胞因子ELISA检测试剂盒和多功能酶标仪检测肺泡灌洗液中炎性细胞因子(CXCL8、TNFα和IL-1β)的含量;取病变处的肺脏组织,固定于4%多聚甲醛中,进行肺脏病理切片和组织免疫荧光检测(金贝津生物,湖北武汉);取肺脏组织,提取RNA 进行mhp和splunc1在肺脏组织中转录水平检测。
1.2.2splunc1基因扩增 根据Gene Bank 上公布的猪splunc1基因序列,基因登录号:NM- 001005727.1,设计splunc1特异性PCR 扩增引物(表1)。利用RNA提取试剂盒,提取猪支气管上皮细胞中的总RNA,反转录成cDNA 后,利用2×PhantaTM Master Mix 进行splunc1的PCR 扩增。PCR 加样体系如下:2×PhantaTM Master Mix 12.5 μL,上下游引物各1 μL,cDNA 模板2 μL,ddH2O 补充至25μL。PCR 反应条件如下:95 ℃预变性3 min;95 ℃变性10 s,58 ℃退火30s,72 ℃延伸2 min,34 个循环;72 ℃延伸5min。PCR 产物随后进行1%琼脂糖凝胶电泳。
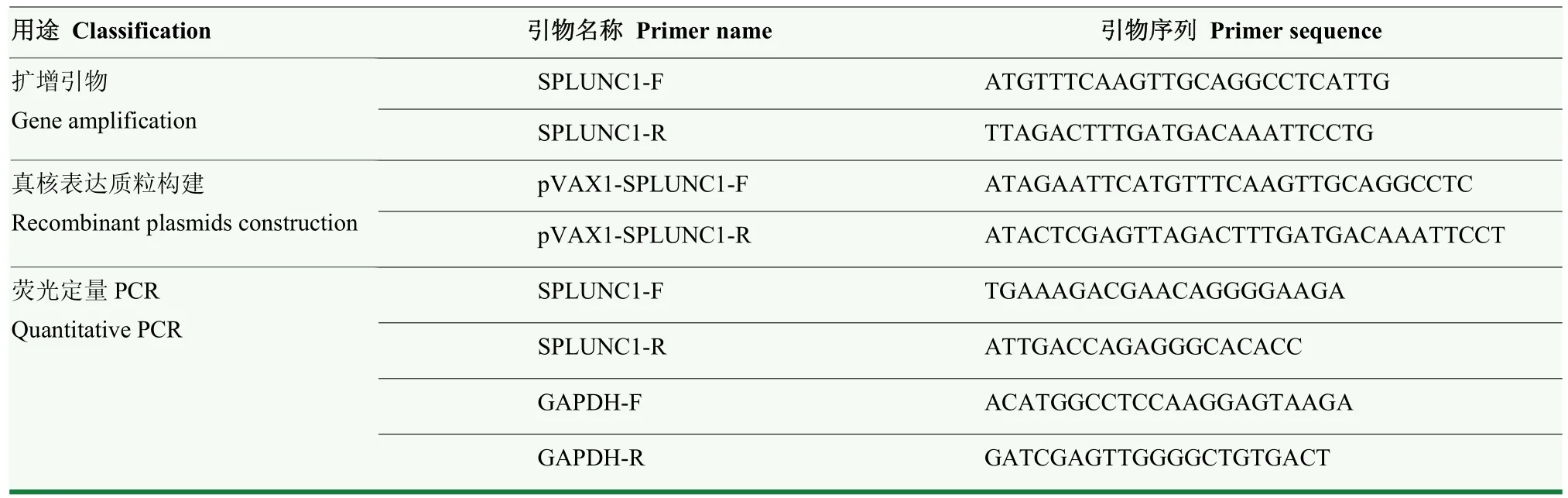
表1 引物序列Table 1 Primer sequences
1.2.3 原核和真核表达重组质粒的构建、鉴定和蛋白表达 PCR产物回收纯化后进行产物和载体的双酶切(ECORI,XolI),将酶切并纯化过的目的基因与pcDNA3.1 和pET28a 载体16 ℃连接过夜。连接产物转化大肠杆菌感染态DH5α,提取重组质粒后进行双酶切鉴定,分别构建pET28a-SPLUNC1 和pCDNA3.1-SPLUNC1 重组质粒。将pET-28a-SPLUNC1 转化BL21重组菌,加IPTG 进行诱导表达,诱导表达后4 h,进行超声波破碎,取表达菌进行鉴定。
1.2.4 Western blotting 裂解并提取不同处理细胞的总蛋白,取等量的蛋白(30 μg)加入5×SDS loading buffer 于100 ℃水浴锅煮沸5 min 后进行SDS-PAGE 电泳,电泳结束进行蛋白转印。室温封闭2 h 后,4 ℃条件下一抗作用过夜:SPLUNC1 兔单抗(1∶2000 稀释),ERK 兔单抗,p-ERK 兔单抗,IκBα兔单抗,β-actin 鼠单抗,Mhp P97 鼠单抗(均为1∶1000 稀释)。PBST 洗涤后,室温孵育HRP 标记的羊抗鼠或羊抗兔的二抗1 h。PBST 洗涤后,化学发光仪曝光。
1.2.5 荧光定量PCR 对不同处理细胞的总RNA 反转录后,取2 μL 反转录产物利用SPLUNC1、GAPDH特异性引物(表1)以及2×Power SYBR Green PCR Master Mix 进行Real-time PCR 检测。PCR 加样体系为:2×SYBR Green PCR Mix 10 μL,上下游引物各1 μL,cDNA 2 μL,RNase free ddH2O 补齐至20 μL。按照SYBR Green Real-time PCR染料说明设定PCR反应程序:95 ℃预变性2 min,95 ℃15 s,60 ℃1 min,40 个循环。
1.2.6 间接免疫荧光 将不同处理的细胞利用冰预冷的甲醇4 ℃固定45 min 后,加入PBST 稀释的一抗:SPLUNC1 单抗(1∶100),Mhp-P97 单抗(1∶100),4 ℃过夜,PBS 洗涤后加入FITC 标记的羊抗鼠或者Alexa-Fluor-555 标记的羊抗兔二抗,37℃作用1 h,PBS 洗涤3 次,于荧光显微镜下观察并拍照。
1.2.7 Mhp 体外感染对SPLUNC1 表达的影响 将Mhp(50 moi)体外感染细胞,感染后不同时间(3、6、9 h)利用Western-blotting 和Real-time PCR 对SPLUNC1的转录和表达进行检测,分析Mhp 对SPLUNC1 表达的影响。
1.2.8 SPLUNC1 对Mhp 生长的影响 将纯化后的不同浓度的SPLUNC1 蛋白(10、25、50 μg·mL-1)与同一浓度的Mhp(105CCU50/mL),或者同一浓度的SPLUNC1 蛋白(25 μg·mL-1)与不同浓度的Mhp(103、105、107CCU 50/mL)37 ℃孵育作用后,对Mhp 进行CCU50 检测,明确SPLUNC1 对Mhp 生长的影响。参考文献[12]方法,利用小鼠体内抗体封闭试验,明确SPLUNC1 对Mhp 生长的影响。SPLUNC1 特异性单抗(25 μg/只)滴鼻接种,接种后2 h,参照文献[20]方法进行Mhp 攻毒,攻毒后7 d,取小鼠肺泡灌洗液,检测肺泡灌洗液中的Mhp 的CCU50 含量,明确SPLUNC1 对Mhp 体内生长的影响。
1.2.9 SPLUNC1 对Mhp 黏附能力的影响 在细胞中对SPLUNC1 进行过表达或siRNA 干扰,24 h 后感染Mhp(50 moi),分别于Mhp 感染后12 h 固定细胞。利用Mhp 单抗P97-2A10 对黏附到细胞上的Mhp 进行激光共聚焦检测,分析SPLUNC1 对Mhp 黏附细胞能力的影响。
1.2.10 SPLUNC1 对Mhp 诱导的CXCL8 表达以及炎性活化通路的影响 将已构建成功的pCDNA3.1-SPLUNC1或对照质粒分别转染入细胞中进行过表达,转染后24 h 感染Mhp,分别利用ELISA 对不同处理细胞中的CXCL8 的表达进行检测分析;设计并合成靶向SPLUNC1 基因的特异性RNA 干扰片段,对细胞中SPLUNC1 进行干扰,24 h 后感染Mhp,对CXCL8 的表达进行检测。明确SPLUNC1 对Mhp 诱导CXCL8表达的影响。同时,收集不同处理组细胞,利用Western-blotting 检测SPLUNC1 对MAPK、NF-κB 通路活化的影响。
2 结果
2.1 Mhp 体内感染后可诱导肺脏内炎性细胞因子表达
对试验猪进行Mhp 气管内攻毒,攻毒后28 d 采集肺脏样品。结果表明:感染组肺脏可见质地较硬的深红色肉变(图1-A);H.E.染色结果显示,感染组肺脏有大量的炎性细胞浸润,炎性损伤显著(图1-B);荧光定量PCR 和细胞因子ELISA 结果显示,与对照组相比,感染组Mhp(图1-C)以及肺泡灌洗液中炎性细胞因子(CXCL8、TNFα和IL-1β)表达显著上调(图1-D)。以上结果证实Mhp 体内感染后可诱导肺脏炎性细胞因子表达和炎性损伤。

图1 Mhp 感染后肺脏中炎性细胞因子和炎性损伤检测Fig.1 The detection of inflammatory cytokines and inflammatory damage in the lung after Mhp infection
2.2 Mhp 体内外感染均可抑制SPLUNC1 表达
实验猪气管内攻毒后28 d 采集肺脏样品。肺脏组织IFA 结果显示,感染组支气管黏膜表面可见Mhp特异性荧光分布(红色),但SPLUNC1 表达较弱(绿色);相反,对照组支气管黏膜表面和内部未见Mhp特异性荧光分布,但可见显著的SPLUNC1 表达分布(图2-A)。荧光定量PCR 结果显示,与对照组相比,感染组肺脏组织中SPLUNC1 表达显著降低(图2-B)。因此,Mhp 体内感染后,肺脏组织中SPLUNC1 表达下调。

图2 Mhp 抑制SPLUNC1 的转录和表达Fig.2 Mhp inhibited the transcription and expression of SPLUNC1
将Mhp 体外感染猪支气管上皮细胞系,感染后不同时间点,细胞中SPLUNC1 的转录和表达水平检测结果显示:Mhp 体外感染后可显著降低猪支气管上皮细胞中SPLUNC1 的mRNA 和蛋白表达水平(图2-C,D)。上述结果均证实,Mhp 体内外感染可抑制SLUNC1 表达。
2.3 猪源SPLUNC1 基因的克隆和表达
为明确SPLUNC1 在Mhp 感染过程中的作用,构建了SPLUNC1 真核和原核表达重组质粒。首先,提取原代猪支气管上皮细胞中的总RNA,利用猪源SPLUNC1 特异性引物扩增SPLUNC1 基因。PCR 结果显示,在750 bp 大小处可扩增出对应大小的条带(图3-A)。酶切和PCR 鉴定结果显示,SPLUNC1基因已成功克隆至原核表达载体pET-28a 和真核表达载体pCDNA3.1 中(图3-B)。将构建好的pET-28a-SPLUNC1 转化至BL21 中进行诱导表达。SDS-PAGE结果显示,与诱导前相比,27 kDa 左右有对应大小的蛋白表达(图3-C)。利用SPLUNC1 特异性单抗对表达的蛋白进行Western-blotting 鉴定,结果表明,表达的蛋白与SPLUNC1 抗体呈现特异性反应(图3-D)。
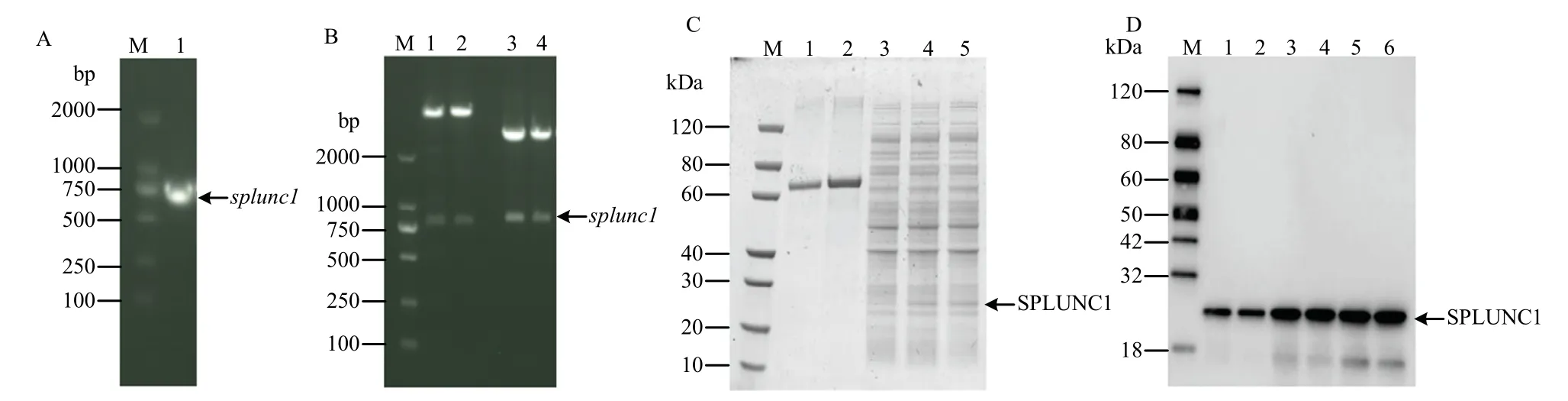
图3 splunc1 的克隆、重组质粒构建和蛋白表达Fig.3 splunc1 cloning, construction of recombinant plasmids and the protein expression of SPLUNC1
2.4 SPLUNC1 对Mhp 生长无显著影响
为明确SPLUNC1 对Mhp 生长的影响,取纯化后的SPLUNC1 蛋白与Mhp 菌液进行孵育,随后进行CCU50检测。检测结果表明,与对照组相比,SPLUNC1作用组未显著抑制Mhp 生长(图4-A,B)。与此同时,利用小鼠体内抗体封闭试验,明确SPLUNC1 对Mhp 生长的影响。结果表明,SPLUNC1 抗体封闭组与对照未抗体封闭组相比,肺泡灌洗液中Mhp 的含量无显著差异(图4-C)。以上体内外结果均证实,SPLUNC1 对Mhp 生长无显著影响。
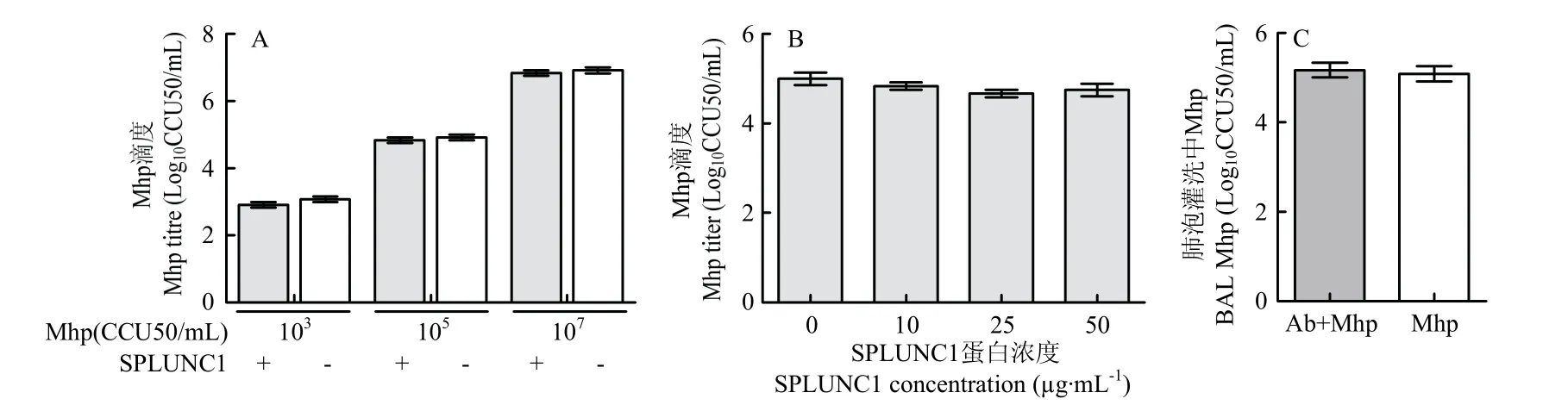
图4 SPLUNC1 对Mhp 的抑菌作用Fig.4 Antibacterial activity of SPLUNC1 on Mhp
2.5 SPLUNC1 对Mhp 体外黏附无显著影响
黏附是Mhp 感染致病的重要过程,为了明确SPLUNC1 是否通过调控Mhp 的黏附来抑制CXCL8的表达,本研究在细胞中进行SPLUNC1 的过表达和siRNA 干扰,随后利用Western-blotting 和IFA 对Mhp黏附情况进行检测。结果表明,SPLUNC1 过表达或干扰,细胞中Mhp 平均荧光强度和蛋白灰度无显著差异,证实SPLUNC1 对Mhp 的黏附无显著的影响(图5)。

图5 SPLUNC1 对Mhp 体外黏附的影响Fig.5 The effect of SPLUNC1 on Mhp adhesion in vitro
2.6 SPLUNC1 可抑制Mhp 感染引起的CXCL8 表达上调以及MAPK-ERK 通路的激活
为检测SPLUNC1 对Mhp 感染诱导炎性因子表达的影响。将真核表达重组质粒pcDNA3.1-SPLUNC1 以及对照质粒,SPLUNC1 干扰片段以及对照干扰片段转染至细胞,转染后24 h 感染Mhp。细胞上清中的CXCL8 检测结果显示:SPLUNC1 过表达可显著降低Mhp 诱导的CXCL8的表达(图6-A);相反,SPLUNC1 干扰后可进一步上调Mhp 诱导的CXCL8 的表达(图6-B)。以上结果证实,SPLUNC1 可调控Mhp 感染引起的CXCL8 的表达。

图6 SPLUNC1 对Mhp 诱导CXCL8 表达及对ERK 通路活化的影响Fig.6 The effects of SPLUNC1 on the expression of CXCL8 and the activation of ERK pathway induced by Mhp
Mhp 可通过激活MAPK-NF-κB 通路诱导CXCL8等促炎性因子表达[18]。为了明确SPLUNC1 对该通路的调控作用,发现SPLUNC1 过表达可抑制Mhp 引起的ERK-NF-κB 通路的活化(图6-C);相反,siRNA干扰可进一步促进Mhp 引起的ERK-NF-κB 通路的活化(图6-D)。说明SPLUNC1 可通过MAPK-NF-κB抑制CXCL8 的表达,进而调控Mhp 感染引起的炎性反应。
3 讨论
3.1 Mhp 感染后可通过破坏炎性反应平衡诱导肺脏炎性损伤,而其机制不清
呼吸道黏膜上皮分布于气管、支气管等部位,是猪肺炎支原体、流感以及其他呼吸道病原感染入侵的主要部位,也是机体抵抗病原入侵第一道防线[7,13,21-23]。Mhp 入侵呼吸道后,首先黏附并定殖于气管、支气管上皮上,克服黏膜上的纤毛、黏液等天然物理屏障后,通过ERK1/2、P38 和JNK 的磷酸化以及IκBα的降解来激活NF-κB 炎性信号通路,招募或诱导上皮、巨噬或中性粒等细胞分泌促炎性细胞因子CXCL8、TNFα 和IL-1β 等,引起宿主过度的免疫应答,破坏炎性反应平衡,造成肺脏炎性损伤[5,24-26]。同时,为抵抗病原感染,机体自身具有多种炎性反应调控功能,如分泌功能蛋白、分泌抑炎性细胞因子以及活化TLR 信号等方式来抑制过度炎性反应,来减少炎性损伤[8-9,27]。机体在正常状态下,是处于炎性反应平衡的状态;病原感染破坏炎性反应平衡后,则导致炎性损伤,Mhp 如何破坏炎性反应平衡机制仍不清晰。
3.2 SPLUNC1 可通过负调控MAPK-NF-κB 通路,抑制炎性因子过度表达,维护机体炎性平衡。
SPLUNC1 是一种稳定表达于呼吸道黏膜中并且含量最高(约10%)的天然免疫功能蛋白,具有调控呼吸道的炎性反应,抑制细菌或病毒生长等多种重要功能[16,28]。LIU 等研究发现,SPLUNC1 具有表面活性功能,可抑制肺炎克雷伯菌生物被膜的形成[29]。SPLUNC1 也通过调控黏膜表面钠离子通道,维持呼吸道黏膜液体厚度,维护呼吸道平衡[22]。CHU 等[12]研究发现,SPLUNC1 可抑制人肺炎支原体生长,负调控人肺炎支原体感染引起的炎性因子IL-13的表达。由此可见,针对不同的病原体,SPLUNC1 所表现的免疫功能也有所不同。同时,SPLUNC1-α6 区域是SPLUNC1 抑制炎性反应的主要功能域[30]。本研究结果也显示,过表达SPLUNC1 可抑制Mhp 感染引起的CXCL8 的表达,证实了SPLUNC1 对炎性反应的调控功能。随后,本研究基于Mhp 感染入侵呼吸道黏膜的过程,探究SPLUNC1 对炎性反应的负调控机制。研究结果表明SPLUNC1 并没有影响Mhp 的生长和黏附。而CHU 等[12]发现,SPLUNC1 可抑制人肺炎支原体的生长,这一现象可能与人与猪SPLUNC1-α6 功能区域的差异有关。进一步研究发现,SPLUNC1 可抑制Mhp 感染引起的ERK1/2 的磷酸化和IκB 的降解,证实SPLUNC1 可直接靶向MAPK-NF-κB 通路,抑制炎性因子过度表达,维护机体炎性平衡。
3.3 Mhp 可通过减少SPLUNC1 在呼吸道黏膜中的表达分布,破坏宿主炎性反应平衡
在正常生理状态下,肺脏中SPLUNC1 稳定表达,并通过其多种天然免疫调控功能维持黏膜稳定;在感染状况下,SPLUNC1 存在表达失调或功能缺失[10]。如肺炎链球菌或流感病毒的小鼠肺部感染模型中,SPLUNC1 的蛋白或mRNA 表达水平显著下调;相反,人肺炎支原体或肺炎克雷伯菌感染后,肺部SPLUNC1表达显著上调[16]。本研究发现Mhp 体内外感染可显著降低呼吸道黏膜的SPLUNC1 的转录和表达,并显著上调肺泡灌洗液中CXCL8 的表达。SPLUNC1 在不同的感染状况下所呈现出的表达失调,是呼吸道和病原之间相互斗争、相互抗衡的结果。因此,Mhp可通过抑制SPLUNC1 的表达,减少其在呼吸道黏膜中的表达分布,破坏宿主通过SPLUNC1 调控炎性反应平衡的功能,从而激活NF-κB 炎性信号通路,引起炎性因子过度分泌和炎性损伤,帮助其持续性感染。因此,不同毒力Mhp 对SPLUNC1 表达的抑制作用与其炎性损伤和毒力的相关性还有待于后续进一步研究。
4 结论
猪肺炎支原体在感染入侵过程中,一方面,呼吸道黏膜可通过短的上腭、肺及鼻咽上皮克隆1 蛋白(SPLUNC1)来调控炎性因子的过度表达,维护宿主炎性平衡。因此,SPLUNC1 是呼吸道黏膜维持稳定的“卫士”。另一方面,猪肺炎支原体又可通过抑制呼吸道黏膜中SPLUNC1 的表达,拮抗宿主天然免疫,破坏炎性平衡,引起炎性损伤,帮助其持续性感染。因此,该发现对了解猪肺炎支原体持续性感染机制具有重要意义,也为猪肺炎支原体新疫苗开发或药物靶点设计提供新的思路。
