基于Bt 毒素的杀虫蛋白理性设计与创新应用策略
2024-01-17徐重新金嘉凤孙晓明沈成张霄陈澄宇刘贤金刘媛
徐重新,金嘉凤,孙晓明,沈成,3,张霄,陈澄宇,刘贤金,刘媛
1 江苏省农业科学院农产品质量安全与营养研究所/省部共建国家重点实验室培育基地-江苏省食品质量安全重点实验室,南京 210014;2 江苏大学食品与生物工程学院,江苏镇江 212013;3 南京农业大学植物保护学院,南京 210023
0 引言
Bt 毒素是苏云金芽孢杆菌(Bacillusthuringiensis)代谢产生的一类具有特异性杀虫功能的大分子蛋白,典型代表为伴胞晶体杀虫蛋白(Cry 和Cyt,属δ内毒素)和分泌到胞外的营养期杀虫蛋白(Vip),也有微量分泌型杀虫蛋白(Sip),但因杀虫活性弱和制备困难,几乎不被关注。目前获认证命名的Bt Cry/Cyt/Vip 毒素已达1 005 种,涵盖Cry 家族78 亚类818 种、Cyt 家族3 亚类40 种和Vip 家族4 亚类147 种(数据来源于国际Bt 毒素权威统计网站http://www.lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/);此外,仍有新的亚型被发现的报道[1]。Bt 毒素由于特异性对鳞翅目如小菜蛾(Plutellaxylostella)、鞘翅目如马铃薯甲虫(Leptinotarsadecemlineata)、双翅目如埃及伊蚊(Aedesaegypti)等多种常见害虫具有较强毒杀活性,而对绝大多数非靶标生物特别是人类及高等动物相对较为安全,其现以制剂或转基因作物的形式广泛用于害虫绿色防控。截至2023 年6 月,中国农药信息网(http://www.chinapesticide.org.cn)数据显示,仅在中国登记的生物农药制剂有效成分含Bt 毒素的产品就达240 余种;而其转基因作物在全球的种植面积更是超过1 亿公顷,商品化品种涵盖水稻、小麦、玉米、马铃薯、大豆、木瓜、棉花、烟草等世界主要经济作物,带动相关作物年均增产价值超过190 亿美元[2]。然而随着Bt 毒素长期广泛应用,靶标害虫抗药性也逐渐显现,报道显示,目前在野外发现至少有小菜蛾、草地贪夜蛾(Spodopterafrugiperda)、粉纹夜蛾(Trichoplusiani)、灰翅铃夜蛾(Helicoverpapunctigera)、棉铃虫(Helicoverpaarmigera)、棉红铃虫(Pectinophora gossypiella)、玉米螟(Ostriniafurnacalis)7 种鳞翅目和山杨叶甲(Chrysomelatremulae)1 种鞘翅目害虫对一些成熟应用的Bt 毒素(如Cry1Aa、Cry1Ab、Cry1Ac、Cry1Ah、Cry1B、Cry1C、Cry1F、Cry1J、Cry2Aa、Cry2Ab、Cry2Ae、Cry3Aa 等)产生了抗性[3];此外,部分Bt毒素如Cry1Aa、Cry1Ai、Cry1Ca、Cry1Fa 和Cry2Aa对家蚕(Bombyxmori)[4-6]、Cry1Ab 和Cry3Bb 对二星瓢虫(Adaliabipunctata)[7]、Cry5B 和Cry6Aa 对秀丽隐杆线虫(Caenorhabditiselegans)[8-9]等特定非靶标生物具有较强的交互致死毒性,这些问题越来越掣肘Bt毒素在害虫防治上的进一步应用。尽管如此,Bt 毒素仍然是当今世界公认的最具价值的绿色高效杀虫蛋白,可挖掘的潜力和创新应用空间巨大。
近年来,得益于分子与生物信息学和基因工程技术快速发展,一些代表性的Bt 毒素(Cry、Cyt、Vip)结构功能及其对相应靶标害虫的活性机制日趋明晰,特别是3D Cry 类型Bt 毒素以活化态(关键结构如Domain I/II/III)与靶标害虫中肠钙黏蛋白(cadherin,CAD)、腺苷三磷酸结合盒转运蛋白(ATP-binding cassette transporters,ABC 转运蛋白)等关键受体强力互作诱发肠道细胞功能损伤进而导致虫体死亡的基本作用模式已经成为共识。由此,基于Bt 毒素关键功能结构域并结合其与靶标害虫潜在关键受体特异性互作的特性,为理性设计活性更高[10-11]、稳定性更强[12]、杀虫谱更广[13]、对非靶标生物安全性更高[14]甚至可应对靶标害虫抗药性[15]的有别于母体Bt 毒素的突变体、结构杂合体乃至杀虫功能效应物抗体等新型杀虫蛋白创造了可能;同时也为理性设计诸如特异性钙黏蛋白片段[16]、类钙黏蛋白片段[17]、小菜蛾PxHsp90 蛋白[18]等辅助增效,苏云金芽孢杆菌P20 蛋白[19]、LEA-II 肽[20]等促进表达,乃至借鉴化学农药复配模式的包括不同Bt 毒素[21]或具杀虫功能的几丁质酶[22]、蛋白酶抑制剂[23]、凝集素[24]、蜘蛛毒素[25]等材料在内的各类同源或异源增效物协同Bt 毒素防治靶标害虫的创新应用策略指明了方向。基于此,本文通过文献调研,在全面总结Bt 毒素结构功能及其对靶标害虫作用机制的基础上,较为系统地梳理了基于Bt 毒素功能修饰的突变体、结构杂合体以及杀虫功能模拟效应物抗体等新型杀虫蛋白理性设计和基于Bt 毒素功能增效的创新应用策略等方面的研究进展,并结合作者团队部分最新研究成果,对基于Bt 毒素的杀虫蛋白理性设计与创新应用策略在未来可能拓展的方向进行了深入探讨,有望为相关研究提供较为全面的、具有重要参考借鉴价值的文献资料和潜在启发思路。
1 Bt 毒素结构功能与活性机制
1.1 Cry 家族毒素
Cry 家族毒素是最具代表性的Bt 毒素类型,其杀虫谱涵盖鳞翅目、鞘翅目、双翅目、半翅目、膜翅目及线虫、蜗牛等,甚至个别亚种对人类癌细胞具有强特异性致死活性(表1)。Cry 家族毒素尽管在进化上具有一定保守性,但并不是所有亚种都是单一同源的蛋白家族,按结构功能和进化保守性可划分为原毒素经酶解后活化为 3 个功能结构域(Domain I-II-III)的Three-Domain Cry(3D Cry)类型、原毒素与球形赖氨酸芽孢杆菌(Lysinibacillussphaericus)产生的二元毒素(binary toxin,Bin)氨基酸功能结构类似的Bin-like Cry 类型和原毒素关键活性结构及作用模式与保守的梭状芽孢杆菌ε毒素(epsilon toxin,ETX)或球形赖氨酸芽孢杆菌杀蚊毒素(mosquitocidal toxin,MTX)类似的ETX/MTX 家族-like Cry 类型;此外,还有极其独特的不具杀虫活性但能特异性对包括人类在内的哺乳动物癌细胞产生强致死活性的Parasporin Cry 类型。

表1 Bt 毒素主要作用对象Table 1 The main targets of Bt toxins
3D Cry 类型是绝大多数Cry 家族毒素的共有特质,其原毒素的分子量大多聚集在135 kDa 左右:如Cry1类(~135 kDa)、Cry 8Ea1(128 kDa)、Cry9Ca/Ec1(130 kDa)等和聚集在65 kDa 左右:如Cry2Aa(65 kDa)、Cry39A(63 kDa)、Cry44Aa(64.1 kDa)、Cry59A(64.2 kDa)、Cry11A(72 kDa)等,前者毒素分子肽链的C 端一般都存在一段分子量在70 kDa 左右的与毒素结晶形成有关的非活性结构,而后者毒素分子肽链的C 端则不存在这种结构,这类毒素结晶形成需要借助其他辅助蛋白或特殊的上下游基因调控元件才能实现[26]。3D Cry 类型毒素在进化上相对较为保守(多数存在5 个保守区域Block1—5),几乎所有亚型的原毒素经靶标害虫肠道碱性环境酶解后均产生分子量为60—70 kDa 的由3 个功能结构域(Domain I-II-III)组成的活化态结构[27]。其中,Domain I 是位于N 端200—250 个氨基酸的由6—7 个亲水性α-螺旋包裹中心1个疏水性α-螺旋(α5)的特殊结构,其参与了毒素蛋白寡聚物形成并与靶标害虫肠壁蛋白结合、插入细胞膜形成穿孔,是毒素发挥杀虫功能的关键区域[28];Domain II 是由居中的200 个氨基酸左右的由3 个反向平行的β折叠组合片段包裹形成希腊钥匙(Greek-key)拓扑结构并附带2 个短螺旋,其中3 个β折叠组合片段顶端裸露的Loop 环牵引毒素特异性识别并结合受体,从而决定毒素对靶标害虫的特异性[29];Domain III是位于C 端的150 个氨基酸左右的由2 个扭曲的反向平行的β折叠组合片段包裹形成β-sandwich 夹心拓扑结构,参与不同靶标害虫中肠受体结合互作和细胞膜插入过程,同时也是维持毒素结构稳定的重要部分[11];Domain II/III 共同决定毒素蛋白作用靶标害虫的类型。目前3D Cry类型毒素对靶标害虫的活性机制相对较为明晰,主流观点认为,靶标害虫取食该类原毒素后,肠道碱性环境中的蛋白水解酶首先对毒素N 端和C 端非活性区域肽段进行特异性水解,形成分子量为60—70 kDa 的Domain I-II-III 活化态,从而穿过围食膜与中肠细胞纤维膜上高丰度的氨肽酶-N(aminopeptidase N,APN)、碱性磷酸酶(akaline phosphatase,ALP)初步结合识别,接着毒素蛋白核心区域靶向与中肠上皮细胞刷状缘膜囊泡(brush border membrane vesicles,BBMV)上的一级受体CAD 强力结合(Kd值可达1 nmol·L-1),在特殊蛋白酶作用下,Domain I 的N 端α1肽段被切除,引起活化态毒素形成低聚物实现单体寡聚化(Domain II 的loop 和Domain III 的功能位点裸露),进而与细胞膜上由糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)锚定蛋白牵引的高丰度二级受体氨肽酶-N、碱性磷酸酶等非强力结合(Kd值>100 nmol·L-1),进一步促进活化态毒素寡聚化,再次增强毒素与CAD 的亲和力并同步与跨膜蛋白腺苷三磷酸结合盒转运蛋白(ABC 转运蛋白)强力互作,产生循环级联放大效应,由此在CAD、APN、ALP、ABC 转运蛋白(ABCC2/ABCC3)等系列受体牵引下,活化态毒素穿插到细胞膜造成穿孔裂解,引发靶标害虫肠道功能损伤、消化吸收受阻、拒食,最终导致虫体死亡,即为“穿孔形成模型”[30]。也有观点认为,靶标害虫取食的原毒素在肠道碱性环境中被水解形成Domain I-II-III 活化态,由此穿过围食膜直接与中肠上皮细胞BBMV 上的CAD 受体强力结合,在特殊蛋白酶的作用下,Domain I 的N 端α1 肽段被切除形成低聚物实现单体寡聚化,进而激发细胞膜上由α、β、γ3 个亚基组成的膜蛋白GTP 偶联调节蛋白(G 蛋白,G protein)系统和Mg2+依赖的膜整合蛋白腺苷酸环化酶(adenylylcyclase,AC)系统,引发环磷酸腺苷(cyclic adenosine monophosphate,cAMP)瞬时过表达,激活蛋白激酶A(proteins kinase A,PKA)信号转导通路,触发一系列不可逆修复的级联生化反应,导致细胞膜内外离子渗透压失衡、细胞骨架不稳坍塌,造成靶标害虫肠道功能损伤、消化吸收受阻、拒食,最终导致虫体死亡,是为“信号转导模型”[30]。
Bin-like Cry 类型毒素如Cry34、Cry35Aa,b,c/Ba、Cry36、Cry49Aa 等氨基酸序列较为保守,结构和功能与球形赖氨酸芽孢杆菌二元毒素Bin-A/B 极为类似,这类原毒素的分子量主要聚集在40—60 kDa,富含功能性β-折叠结构,目前其对靶标害虫的作用机制尚不清楚,初步研究证据认为该类型原毒素进入靶标害虫肠道碱性环境后会被水解为毒性更强的活化态肽链,进而在裸露的功能性β-折叠结构主导下与肠壁细胞BBMV 上的特异性受体强力互作,引起细胞膜穿孔,造成虫体死亡[31]。而ETX/MTX 家族-like Cry 类型毒素如Cry15Aa、Cry23Aa、Cry33Aa、Cry38Aa、Cry51Aa1,a2、Cry60以及CryC35、CryNT32 等整体氨基酸序列多样、一致性较低,但它们对靶标害虫的关键活性结构和作用机制较为相似,研究表明这类毒素大致由两个结构域组成,N 端较小的头部结构域由多样性丰富的短肽α螺旋和β折叠构成,是受体识别的关键区域,决定相应毒素作用不同靶标害虫,而C 端较大的尾部结构域氨基酸较为保守,多数都拥有与气单胞菌细胞溶素较为相似的多组功能性β-折叠结构,这种结构寡聚化主导毒素与靶标害虫中肠BBMV 上的特异性跨膜蛋白受体强力互作,导致肠壁细胞膜发生β-barrel 穿孔,造成虫体死亡[32]。Parasporin Cry 类型现有的 6 组毒素 Cry31Aa,b,c(Parasporin1)、Cry46Aa,b(Parasporin2)、Cry41Aa,b(Parasporin3)、Cry45Aa(Parasporin4)、Cry64Aa/Ba/Ca(Parasporin5)、Cry63Aa(Parasporin6)的氨基酸序列在进化上与3D Cry 类型相距较远,而与ETX/MTX家族-like Cry 类型相对较近,其中Parasporin5(Cry64)有时也被认为是ETX/MTX 家族-like Cry 类型[33];这类原毒素需要借助胰蛋白酶或蛋白激酶K 等特殊蛋白酶水解形成25—65 kDa 的活化态才具有细胞毒性,其关键活性单元同样与气单胞菌细胞溶素类似,富含功能性β-折叠结构,目前推测认为这种结构进一步寡聚化能特异性结合哺乳动物癌细胞细胞膜上GPI 锚定蛋白受体并产生强力级联互作,从而诱发癌细胞空泡性肿胀、裂解或穿孔性坍塌,造成强烈的细胞毒性[29,34]。
1.2 Cyt 家族毒素
Cyt 家族3 个亚类(Cyt1—3)毒素分子量均相对较小,多数聚集在25—28 kDa,其整体结构是由外围两组单体α螺旋呈发夹状环绕着中间多组反向平行的单体β折叠组成,主要用于防治鞘翅目和双翅目害虫(表1),尤其对公共卫生领域传播疾病的常见双翅目媒介蚊虫如按蚊(Anophelesspp.)、伊蚊、库蚊(Culexspp.)具有极强的特异性毒杀活性[35]。这类毒素对靶标害虫的活性机制目前还不是很清晰,有观点认为它们也存在与3D Cry 类型毒素类似的“穿孔形成模型”:原毒素进入靶标害虫肠道后,功能性蛋白酶对其N 端和C 端特异性位点进行水解形成活化态,进而与肠壁细胞膜上的卵磷脂、脑磷脂、鞘磷脂等饱和性膜脂表面活性受体互作,活化态毒素单体异构聚集形成类似打开的伞状多聚体结构并由中心β折叠牵引横穿插入膜脂,同时C 端裸露的单体α螺旋驱动毒素寡聚化与特异性膜蛋白受体强力互作,从而造成细胞膜通透性穿孔,诱发虫体死亡;也有观点认为,Cyt 家族毒素在对靶标害虫的毒杀活性过程是由于产生了类似于去垢剂的溶脂效应,它们在肠道中被水解活化后特异性与肠壁细胞膜脂特异性受体互作,引起细胞膜脂质双层结构溶解坍塌,诱发虫体死亡[34]。
1.3 Vip 家族毒素
Vip 家族毒素4 个亚类(Vip1—4)的基因序列特异性和靶标害虫作用受体均与Bt Cry 类型毒素存在明显不同,Vip1(~100 kDa)/Vip2(~52 kDa)属二元毒素,它们协同对半翅目和鞘翅目害虫具有特异性毒性,而Vip3(~88 kDa)和Vip4(~108 kDa)则分别对部分鳞翅目害虫和线虫具有较强毒性。Vip1/Vip2 二元毒素协同作用靶标害虫过程,Vip1 被认为是受体结合结构域毒素,目前结构尚不清晰,有推测认为其关键活性区域可能是由亲水性残基和疏水性残基交替构成的β-strand 结构,当毒素进入靶标害虫肠道后,经蛋白酶水解活化,与肠壁细胞膜受体结合并形成单体寡聚化,造成细胞膜双层脂质结构超导化形成孔道[36];而Vip2则被认为是细胞毒性结构域毒素,其结构与产气荚膜梭菌(Clostridiumperfringens)分泌的I 毒素(Iota toxin)类似,由外围短螺旋结构缠绕中心多组短折叠片层组成,其借助Vip1 造成的细胞膜孔道通过细胞内吞作用进入细胞质,从而干扰二磷酸腺苷核糖基转移酶活性,影响微丝肌动蛋白合成和组装,造成细胞骨架裂解,诱发虫体死亡[37]。Vip3 毒素如Vip3A、Vip3B 等一般是由5 个功能结构域缠绕形成的四聚体,N 端主体为短螺旋结构,是维持毒素蛋白稳定和发挥杀虫活性的功能区域,C 端主体则为短螺旋和卷曲的复合结构,决定毒素对靶标害虫的特异性[38];Vip3 毒素活性机制尚不明确,原毒素进入靶标害虫肠道后会被蛋白酶水解形成分子量为62—66 kDa 的活化态,推测认为其很可能是与中肠壁细胞膜上的某些特异性受体结合互作,造成相应靶标害虫中肠细胞膜双层脂质结构离子通道渗透失衡,引发细胞空泡性肿胀穿孔直至裂解,也可能毒素同步通过细胞内吞作用进入胞内,造成溶酶体和线粒体DNA 损伤,从而启动细胞凋亡或自噬程序,由此综合诱发虫体死亡[39]。Vip4 毒素是由N 端28 个氨基酸短信号肽连同两个保守的功能结构域组成,其在进化上与Vip1 毒素和二元毒素Bin-B 相对较近,目前发现其对鞘翅目害虫玉米根虫(Diabroticavirgifera)防治效果显著[40],但活性机制尚不清楚。
1.4 Sip 家族毒素
Sip 家族是目前发现的唯一对鞘翅目害虫具有杀虫活性的分泌型Bt 毒素,这类毒素的分子量在41 kDa左右,一般以包涵体形式分泌到细胞外,N 端存在一段具有革兰氏阳性细菌典型特征的保守的分泌信号短肽(30 个氨基酸),关键活性区域存在多组典型的α螺旋、β折叠以及无规卷曲结构,其在进化上与ETX/MTX家族中的MTX3 毒素显著相似,由此推测这类毒素对靶标害虫的活性机制可能属于对中肠壁细胞膜形成β-barrel 穿孔类型[41]。
2 基于Bt 毒素的杀虫蛋白理性设计
锚定Bt 毒素功能结构域乃至关键活性位点,结合靶标害虫潜在关键受体互作信息和生测验证,是理性设计基于Bt 毒素的杀虫蛋白功能改造和功能模拟效应物的核心依据,目前实现手段主要采用关键活性区域或位点突变、同源或异源功能性结构域杂合以及全新的依托抗独特型抗体功能模拟3 种方式。
2.1 基于Bt 毒素的突变体理性设计
突变是驱动Bt 毒素功能改进的最主要方式,事实上,Bt 毒素在自然条件下也会偶然发生功能进化性突变,如DANDAPAT 等[42]就发现在自然条件下Cry1Ab毒素Domain Iα7 区域223 位点氨基酸S 突变为F,对靶标害虫水稻三化螟(Scirpophagaincertulus)的杀虫活性提高近40%,这也为Bt 毒素特性功能修饰的突变体理性设计提供了很好例证。目前,基于Bt 毒素的杀虫蛋白突变体理性设计,最主要目标是改进其杀虫活性,关注对象则聚焦在Cry 类型毒素上,其中核心重点是3D Cry 类型,此外Cyt、Vip、Sip 等类型毒素均有所涉及,代表性实例见表2。

表2 基于Bt 毒素的突变体理性设计实例Table 2 Examples of mutant rational design based on the Bt toxins
3D Cry 类型毒素各结构域(Domain I/II/III)的结构功能和对相关靶标害虫的作用机制相对较为明晰,这为其功能改造,特别是杀虫活性改进上的理性设计创造了极为有利的条件。其中,对Domain Iα螺旋结构中α2—α3[43-44]、α3—α4[45-47]、α4—α5[48]等关键功能位点进行定点突变,对Domain II Loop 结构中Loop1[49]、Loop2[4,50-54]、Loop3[52,55]等关键功能区域进行定点突变,对Domain IIIβ折叠结构中β16—β22[56-59]等关键功能区域进行定点突变,均能设计获得相应毒素杀虫活性乃至紫外线照射降解耐受性[12]显著提高的突变体。当然,这种针对关键活性位点或关键功能区域的理性设计所产生的突变体的杀虫活性并不都是正向提高,如Cry4Ba 毒素Domain Iα2 区域两个位点氨基酸突变(D111K 或K115D)对靶标害虫埃及伊蚊的致死毒性几乎完全丧失[60],Cry4Aa 毒素Domain IIβ6—β7 之间的Loop2 区域428SCDNKYLNDYN438氨基酸突变为KAQTTPN 或IPATYK 对靶标害虫尖音库蚊(Culex pipiens)的致死毒性几乎完全丧失[61],Cry1Ab 毒素Domain II Loop3 区域3 个氨基酸突变(S441R/N442V/S446V)对靶标害虫烟草天蛾(Manducasexta)的致死毒性降低至原毒素的1.4%[62]。锚定关键活性位点或关键功能区域对3D Cry 类型毒素进行定点突变,突变体与靶标害虫BBMV 或CAD、APN、ALP、ABC 转运蛋白(ABCC2/ABCC3)等潜在关键受体的互作亲和力是初步判定其杀虫活性强弱的重要参考依据,因为包括突变体在内的3D Cry 类型毒素的杀虫活性往往与这些受体的亲和力呈正相关关系,但并不是亲和力越高杀虫活性就一定越强[4,55],靶标害虫生测仍然是判定突变体杀虫活性的最终依据。
Cyt、Vip 和Sip 类型毒素尽管在结构功能和对靶标害虫的活性机制上的信息相对较少,但对其定向突变改造也取得了一定成效。目前,Cyt 类型毒素的定点突变改造主要是围绕Cyt1/Cyt2 的Loop 区域进行定点突变或肽段突变替换,如Cyt1Aa Loop6-αE 区域204 位点氨基酸突变(E204A)[63]、Cyt1Aa Loop6/7/9 替换突变为同源的Cry1Ab 毒素Loop3 区肽段[64]、Cyt2Aa 替换突变为异源的豌豆蚜(Acyrthosiphonpisum)肠道结合肽肽段[65],从而增强原毒素对靶标害虫的杀虫活性;Vip 类型毒素的定点突变改造集中在Vip3A 的Domain I[66]、II[67]、IV[68]和V[69]等区域,获得的突变体对靶标害虫的致死毒力普遍提高2—8 倍,其中设计对Vip3A Domain V 区域776 位点氨基酸突变(N776Y)后对靶标害虫甜菜夜蛾(Spodopteraexigua)的致死毒力不仅提高2.27 倍,而且毒素蛋白在37 ℃条件下保持活性由1 个月延长至3 个月,热稳定性显著增强[70];而Sip 类型毒素的定点突变改造现仅涉及Sip1Aa 毒素的128 位点氨基酸(K128A)、153 位点氨基酸(G153C)、248位点氨基酸(H248C)突变,相应突变体对靶标害虫白菜叶甲(Colaphellusbowringi)的致死毒力提高2—10倍[41,71]。
2.2 基于Bt 毒素的结构域杂合体理性设计
基于结构功能特性是理性设计Bt 毒素功能改进的杂合体的关键依据,通过针对性引入同源的异种Bt毒素或异源的其他杀虫蛋白进行特定结构域替换、重组、融合,从而实现杀虫活性更强、杀虫谱更广乃至可抵御靶标害虫抗药性的新型Bt 毒素杂合体的构建创制;目前相关研究以结构功能较为明晰的3D Cry类型毒素间的结构域杂合或其与其他类型杀虫蛋白杂合为主,此外也涉及个别Vip 类型毒素的杂合改造,代表性实例见表3。

表3 基于Bt 毒素的结构域杂合体理性设计实例Table 3 Example of domain hybrid rational design based on Bt toxins
Domain I 是3D Cry 类型毒素发挥杀虫功能的关键区域,锚定该区域进行结构域替换是获得更高杀虫杂合体的可行手段,如SHAH 等[80]将对棉铃虫几乎无杀虫活性的Cry9Aa Domain I替换为对该虫具高致死活性的Cry1Ac Domain I,创制的杂合体对棉铃虫的致死毒力较Cry1Ac 毒素还提高4.9 倍;而HU 等[81]则将Cry2A Domain I 替换为与其基因同源性(41.5%)相近的异源杀虫蛋白PirB toxin,所产生的杂合体对草地贪夜蛾的致死毒力提高2.41 倍。Domain II/III 共同决定3D Cry类型毒素作用靶标害虫的类型,其中Domain II 在进化上相对较为保守,目前针对该结构域的替换研究较少,而Domain III 则不仅是维持活化态毒素稳定的重要结构域,其在进化上也是3 个功能结构域中最为活跃的区域[82],因此针对该结构域的杂合改造是关注的重点,相关功能改进成功的研究较多(表3)。如依托同源的异种Bt 毒素进行杂合的策略中,Cry1Ac[83]、Cry1Ba[84]、Cry1Ca[85]的Domain III 分别替换为Cry1Ca、Cry1Ca和Cry1Ac 的Domain III 所产生的杂合体对相应靶标害虫的致死毒力提高数十倍乃至上百倍,Cry1Gb Domain III 替换为Cry1Ig 的Domain III 所产生的杂合体则对Bt毒素耐药性草地贪夜蛾具有强致死活性,有望成为相应害虫抗性治理的优质材料;而依托异源的其他杀虫蛋白进行杂合的策略中,供杂合的杀虫蛋白结构功能同样是用于Bt 毒素改进的重要依据,典型的如具杀虫功能的大蒜凝集素与Cry1Ac Domain III 在折叠结构和受体识别结合上具有一定相似性,因此以其替换Domain III结构产生的杂合体对靶标害虫中肠受体结合能力得到增强,从而提高对虫体的致死毒力[86]。除了单个功能结构域替换杂合外,多结构域杂合也是Bt 毒素功能改进的重要手段,而这种策略有望集成母体毒素杀虫活性和靶标害虫特异性等多重优势,因此在扩大毒素蛋白杀虫谱、提高毒素稳定性甚至是抗药性害虫治理上具有独特优势,如将Cry1Ac 前体肽、Cry1Ah Domain I、Cry1Ac Domain II 和Cry1Ca Domain III 组装所产生的杂合体对鳞翅目害虫的杀虫谱更广[13];Cry1Be Domain I-II、Cry1Ca Domain III 和Cry1Ab C 端晶体稳定肽(Domain 4—7)组装所产生的杂合体对草地贪夜蛾Bt 抗性品系具有显著致死活性;Cry1Ab Domain I、Cry1Ac Domain II、Cry1F Domain III、Cry1Ab C 端晶体稳定肽(Domain 4—7)组装所产生的杂合体对玉米螟的致死毒力较3种母本供体提高8—11 倍[87],同时热稳定性也较3 种母本供体更强[88]。此外,非结构域杂合的“Bt-Bt”或“Bt-其他杀虫蛋白”基因融合形成全新的复合物杂合体策略,也是改进Bt 毒素功能的可行手段,如Cry1Ac C 端肽段与Cry4Ba N 端融合[89]或N 端与Ricin B-chain lectin 融合[90]、Vip3Aa C 端与Cry1Ac N 端片段融合[91]或N 端与PCx 基因融合[92],甚至借助Bt 毒素部分结构融合具杀虫功能的蛋白酶抑制剂[93]等形成的复合杂合体均对相应靶标害虫的杀虫活性有显著提升。
2.3 基于Bt 毒素的功能模拟效应物理性设计
设计抗体模拟包括化学农药、生物农药在内的抗原关键结构乃至生物功能的效应物是农药免疫检测和农药新材料研发的新兴领域,该路径以抗体免疫网络理论为依据,认为具备独特型抗原识别结合特性的独特型抗体(idiotype antibody,也称为Ab1)在机体内也会充当“抗原”角色逆向刺激免疫系统产生该独特型抗体的抗体即“抗抗体(Ab2)”,并持续诱发级联免疫反应直至动态稳定到逐渐结束,该过程中由Ab1 分子上的独特型抗原受体部位刺激免疫系统产生针对该独特型抗原受体骨架区的抗抗体(Ab2α)、针对互补决定区的抗抗体(Ab2β)、针对靠近互补决定区的抗抗体(Ab2γ)和针对远离互补决定区的抗抗体(Ab2ε)4种类型的抗独特型抗体(anti-idiotype antibody,Anti-Id),其中Ab2βAnti-Id 直接由独特型抗原受体部位与独特型抗原发生互作的关键核心区域即互补决定区所诱导产生,从而与独特型抗原形成互为内影像效应,因此在一定程度上具备模拟抗原部分结构乃至生物功能的特性[14]。基于这一特性,在生物医药领域可设计制备模拟相关药物的功能替代效应物用于疾病治疗,如催乳素[106]、万古霉素[107]等均有相应功能模拟效应物(Ab2βAnti-Id)创制成功的报道;在农业领域,SHI等[108]通过动物免疫诱导获得了可模拟玉米赤霉烯酮特征构象的单克隆Ab2βAnti-Id;WANG 等[109]借助噬菌体展示抗体库筛选设计获得了可模拟黄曲霉毒素特征构象的基因工程Ab2βAnti-Id,均可替代原毒素标准品建立免疫检测方法用于农产品中相应毒素检测。作者团队近年来则依托Ab2βAnti-Id 具有模拟抗原构象乃至生物功能的这一特性,以从剑桥大学蛋白质工程中心引进的高质量人源化噬菌体展示抗体库:Tomlison I+J 单链抗体(single chain variable fragment,scFv)库,库容量分别为1.47×108和1.37×108pfu/mL;DAb 重链单域抗体库:库容量为3.0×109pfu/mL;以及自构建的鼠源、兔源等免疫偏向噬菌体展示抗体库等为库源材料,设计Bt 毒素抗体(单克隆抗体/多克隆抗体)或其关键功能片段(如Fab)为固相化包被靶点“抗原”,通过“抗原包被-洗涤-封闭-洗涤-库投入-结合吸附-洗涤-酶切洗脱-侵染扩增”等步骤多轮循环富集淘筛,获得的阳性单克隆噬菌体展示抗体经与相应Bt 毒素竞争抑制及与相应靶标害虫中肠BBMV 或CAD、APN、ALP、ABCC2 等潜在关键受体结合互作等多重分析鉴定[110],从而获得符合Ab2βAnti-Id 特征的阳性克隆,并结合靶标害虫生测验证结果,最终确定具模拟Bt 毒素杀虫功能的目标效应物抗体(Ab2βAnti-Id)。团队前期以3D Cry 类型毒素为重点模拟对象,现已初步实现涵盖具备模拟Cry1Aa,b,c/1B/1C/1F/2Aa 等类型在内的Bt 毒素杀虫功能的新型杀虫功能效应物抗体靶向设计,相关功能模拟效应物材料在结构特点上与模拟对象的部分关键活性区域存在一定相似性,且对供试的小菜蛾、棉铃虫、稻纵卷叶螟等靶标害虫的致死率达到相应原Bt 毒素的23.3%—77.87%[14],具有重要的科学研究意义和潜在应用价值。
3 基于Bt 毒素的杀虫蛋白创新应用策略
推进Bt 毒素创新应用模式是实现其杀虫活性或稳定性等功能增效乃至靶标害虫抗药性治理的重要手段,目前主要策略包括催化毒素活化、驱动毒素靶向受体结合、促进毒素表达以及同源或异源杀虫材料复配或共表达的协同促效等,代表性实例见表4。
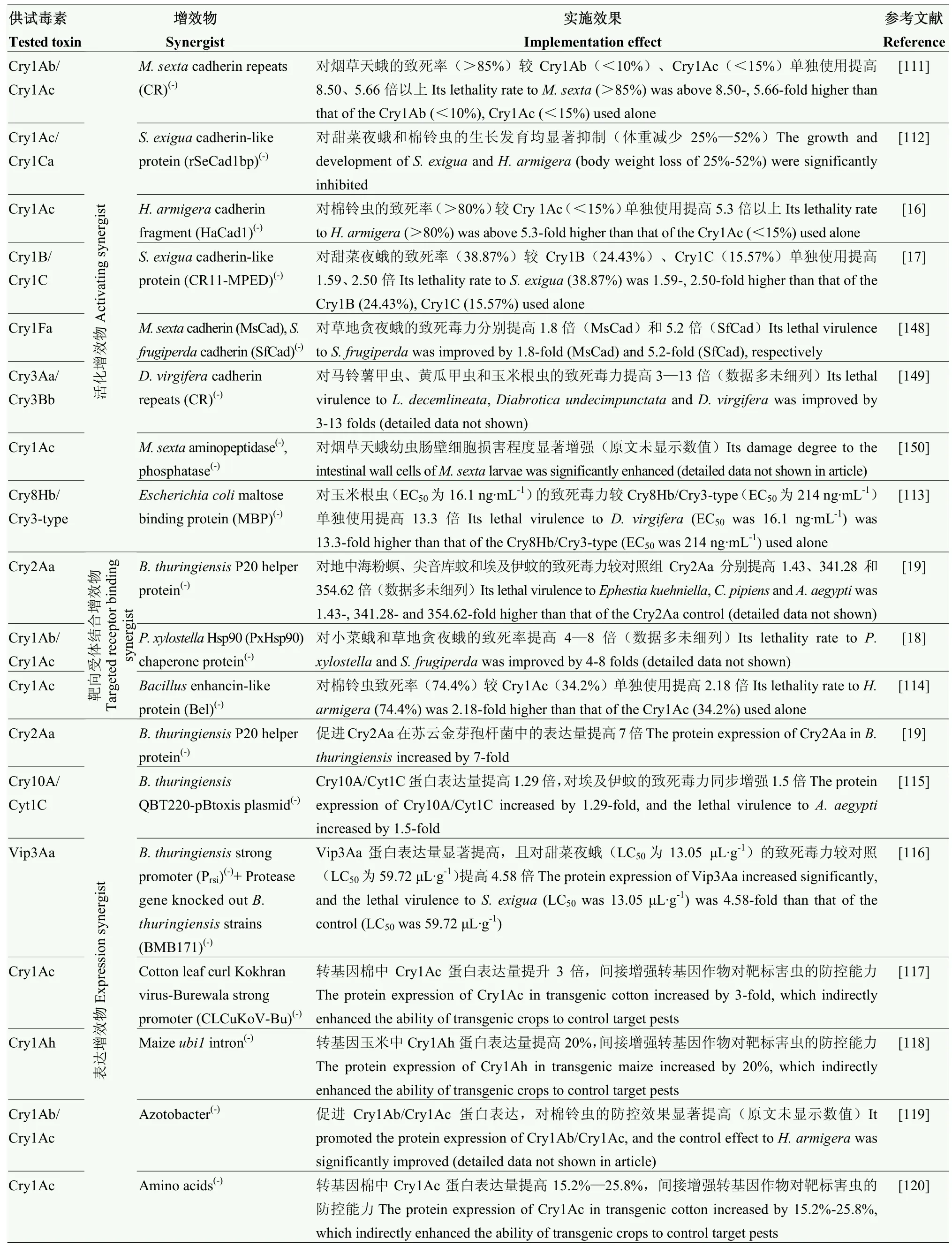
表4 基于Bt 毒素的抗虫增效应用创新策略Table 4 Innovative application strategy of insecticide enhancement based on Bt toxins
催化毒素活化增效策略目前主要依托钙黏蛋白功能片段[111]、类钙黏蛋白功能片段[112]为增效物,它们通过催化毒素(3D Cry 类型)活化态寡聚化,极大提升毒素与靶标害虫中肠受体结合的效率和强度,从而助推毒素杀虫增效;此外,大肠杆菌maltose binding protein(MBP)也能通过调控靶标害虫肠道功能酶活性,促进Bt(Cry8Hb/Cry3-type)原毒素非活性晶体结构溶解并快速释放活化态[113],也是助推毒素杀虫活性的重要增效物。而驱动毒素靶向受体结合增效策略主要是借助如苏云金芽孢杆菌辅助蛋白P20 helper protein[19]、小菜蛾伴侣蛋白PxHsp90 chaperone protein[18]等特殊功能蛋白具备介导牵引Bt 毒素靶向结合害虫中肠受体的特性,或借助如芽孢杆菌类增强蛋白 enhancin-like protein[114]具备干扰害虫肠道保护酶的特性,助推相应毒素与中肠受体高效互作,从而引发毒素杀虫增效。表达增效则主要是通过促进Bt 毒素在工程菌或转基因作物中的表达量从而增强相应菌剂或转基因作物对靶标害虫的杀虫活性,目前可行策略包括借助高效表达载体如源于苏云金芽孢杆菌的QBT220-pBtoxis plasmid[115]、强启动子如源于苏云金芽孢杆菌的Prsi[116]和源于棉花卷叶病毒的CLCuKoV-Bu[117]、调控表达的内含子如源于玉米的ubi1[118],甚至是如固氮菌Azotobacter[119]、氨基酸[120]或多肽[20]等促生长或表达的共生菌或其他类似肥料功效的材料,均能提升目标毒素在相应工程菌或转基因作物中不同程度的表达增效。此外,借助噬菌体或核糖体展示表达,帮助Bt 毒素转录表达过程正确折叠,也能增强毒素对靶标害虫的致死活性[121]。这些增效策略的共同点是涉及的增效物本身对供试靶标害虫并不具备杀虫活性,它们在对Bt 毒素的增效作用中扮演着类似催化剂、介导剂或表达调节剂的角色。
依托同源或异源杀虫材料对Bt 毒素杀虫功能协同促效的创新策略类似于化学农药联合复配增效,是推进Bt 毒素杀虫活性乃至稳定性的较为快捷有效手段,相关策略较多(表4)。同源复配或共表达增效策略,主要是利用不同Bt 毒素类型部分功能结构域相似[122]的特征或不同Bt 毒素类型对相同靶标害虫存在不同作用受体[123]或对不同靶标害虫存在相同或类似作用受体[124-126]的特性,通过复配或共表达实现供试毒素杀虫活性协同增强或害虫抗药性治理的目的。其中,较为典型的如Cry1Ca[127]、Cry4Aa[128]、Cry4Ba[21]、Cry 10Aa[128]、Cry11Aa[129]、Cry11Ba[130]等3D Cry 类型毒素与Cyt 类型毒素正向或反向互为增效物的联合应用对蚊虫等双翅目靶标害虫的增效作用非常明显,致死毒力普遍较相应毒素单独使用提高1.19—71.0 倍;而Cry9Aa[131]、Cry9Ee[132]以Vip3Aa 增效物或Vip3Aa[133]以Cry1F 和Cry1Ie 为增效物,对相应靶标害虫的致死毒力较各毒素单独使用提高1.1—287.76 倍;此外,Cyt1Aa 以Bt 毒素同源的BinA 毒素为增效物,对Cyt1Aa 抗药性致倦库蚊(Culexquinquefasciatus)幼虫的致死毒力提高近5 倍[134],这种增效策略在相应害虫抗药性治理上具有独特优势。而以异源杀虫材料对Bt 毒素杀虫功能协同促效的增效策略,则在形式上更加多样、机理上也更为复杂。在增效物选择上,主要利用具杀虫功能的如几丁质酶、凝集素、蛋白酶抑制剂以及防御素等通过抑制靶标害虫肠道胰蛋白酶、V-ATP酶、α-淀粉酶、半胱氨酸蛋白酶、α-糖苷酶、β-葡萄糖苷酶等与消化吸收相关的功能酶的特性[135],或如蜘蛛毒素、海葵毒素等杀虫短肽通过干扰靶标害虫肠道细胞钠、钙、钾等离子通道或抑制功能性门控通道蛋白(如烟碱乙酰胆碱受体)引起虫体神经兴奋性麻痹毒性的特性[136],协同Bt 毒素对靶标害虫产生毒力叠加的增效效应。此外,源于真菌的阿维菌素[137]、源于植物提取物的芥子油[138]和黄酮[139]甚至是活体菌球孢白僵菌(Beauveriabassiana)[140]、嗜线虫致病杆菌(Xenorhabdusnematophila)[141]、多角体病毒(Autographa californica multiple nuclearpolyhedrosis virus,AcMNPV)[142-143]以及具备RNA 干扰(RNA interference,RNAi)功能的特异性dsRNA[144]等具杀虫功能的生物材料均能作为增效物,在一定程度上直接或间接增强Bt 毒素对特定靶标害虫的致死毒力。值得一提的是,最近报道的一些诸如源于嗜线虫致病杆菌的Txp40(42 kDa)[145]、源于蒙氏假单胞菌(Pseudomonas monteilii)的Mpf2Ba1(53 kDa)[146]、源于发光杆菌(Photorhabdusakhurstii)的TcaB(63 kDa)[147]等与Bt 毒素功能结构或杀虫活性机制上具有一定相似之处的新型杀虫蛋白,理论上也具备协同Bt 毒素对共同靶标害虫毒力增效的潜力,相关研究值得推进。
4 结语与展望
自20 世纪初,Bt 毒素具备特异性防治害虫的功能被发现并加以利用以来,其在农业、林业乃至公共卫生等领域中的害虫防治发挥了巨大作用,在世界范围内掀起了一场害虫防治的绿色革命,带来了巨大的经济价值和社会生态效益。Bt 毒素作为源于微生物的大分子蛋白类杀虫材料,其对常见农林害虫和公共卫生病毒媒介蚊虫的特异性广谱高毒杀活性以及对非靶标生物特别是人类的高度安全性等方面的得天独厚的优势,是其他绿色杀虫材料所无法比拟的,无论是过去、现在还是可预见的未来相当时间内,围绕Bt 毒素靶向增强稳定性、提升杀虫活性、扩大杀虫谱、提高非靶标生物安全性乃至害虫抗药性治理等方向的杀虫蛋白理性设计与创新应用仍然是害虫绿色防治领域竞相追逐的持久性热点。
基于Bt 毒素的杀虫蛋白理性设计方面,锚定活性位点氨基酸的突变改造策略尤其在高效改进Bt 毒素杀虫活性上具有显著优势,个别毒素的特定位点突变不仅扩大杀虫谱还能降低对非靶标生物的毒性甚至增强热稳定性或增强对紫外线的耐受稳定性,但这种策略目前尚无法有效应对靶标害虫抗药性问题;而结构域杂合策略则取长补短,具备定向集成了不同Bt 毒素关键功能结构域特征或其他杀虫蛋白特定功能特性的优势,这种策略不仅在增强毒素杀虫活性上较为有效,同时在扩大杀虫谱、增强稳定性甚至应对害虫抗药性等方面均具有独特优势。这两种策略是Bt 毒素理性设计的传统经典方式,创制出的杀虫蛋白均属于性能加强版的Bt 毒素,在靶标害虫防治上具有更强的实用性和适用性。基于Ab2βAnti-Id 理论的Bt 毒素抗虫功能模拟效应物理性设计,是一种全新的杀虫蛋白靶向创新创制策略,以抗体模拟Bt 毒素杀虫功能,在害虫防治应用上由于模拟物的抗体属性,理论上对非靶标生物特别是对人类和高等级动物较原Bt 毒素更具安全性上的优势;同时该技术路径不局限于Bt 毒素杀虫功能模拟物创制,理论上也适用于所有蛋白类杀虫材料的功能模拟物设计,有望成为害虫绿色防治新材料创制上的新捷径。目前,该设计策略尚处于室内的起步探索阶段,相关Bt 毒素杀虫功能模拟物对供试靶标害虫的致死毒力仅达到原毒素的23.3%—77.9%[14],在应用上仍有很大差距。不过这种策略创制的杀虫模拟物本质上仍然属于抗体,具备较为完整的抗体关键功能分区结构,因此当前成熟的抗体体外亲和成熟技术如定点突变、链置换、易错PCR 等均适用于这些模拟物杀虫功能的进一步修饰改造,如作者团队XIE 等[175]采用链置换技术将Cry1Ac 和Cry1B抗虫模拟物单链抗体的轻链重组并进一步点突变改造,形成的杂合突变体对靶标害虫小菜蛾的致死率提高了近40%,这些技术有望推进Bt 毒素杀虫功能模拟物抗体甚至超过原Bt 毒素的应用价值,值得深入探究。
基于Bt 毒素的杀虫蛋白创新应用方面,采用催化毒素活化和驱动毒素靶向受体结合的策略促进供试毒素对靶标害虫的致死毒力或致死效率,主要得益于对相应毒素结构功能与作用机制的解析,两种策略中的增效物具有鲜明的特定毒素类型靶向增效的特性,是助推Bt 毒素应用价值的重要辅助手段;而促进毒素表达以及同源或异源杀虫材料复配或共表达的协同促效策略,尤其在靶标害虫高效防治上的效果普遍较为明显,这也是当前包括Bt 毒素在内的几乎所有蛋白类杀虫材料在增强害虫防治效果的创新应用中极为实用的最主要手段,不仅如此,这些策略对增强毒素稳定性、扩大杀虫谱以及害虫抗药性治理等方面也同样具有优势,特别是Bt 毒素正面临日趋严峻的害虫抗药性压力,采用生物或化学类抗虫材料协同其应对害虫抗药性的策略是当前害虫抗性治理最行之有效的不二选择,可探索创新应用的空间巨大。此外,探索物理增效法也能在一定程度上促进Bt 毒素活性,如将表达Bt 毒素的苏云金芽孢杆菌孢子粉末研磨处理(颗粒由105 μm 降至210—1 171 nm)对斜纹夜蛾的致死毒力提高1.51 倍[176];借助atmospheric and room temperature plasma(ARTP)/nitrosoguanidine(NTG)对表达Bt毒素(Cry1/Cry2Aa/Vip3Aa)的苏云金芽孢杆菌X023PN(BtX023PN)进行双重诱变,突变体对小菜蛾和东方黏虫的致死毒力提高2.33 和2.13 倍,且菌体中Cry1Ac 表达量增加61%[177];甚至Bt 毒素某些特殊结构也能反向作为增效物,促进其他杀虫材料对靶标害虫的致死活性,如将Cry11Aa domain II loopα8/Cyt1Aa loopβ6-αE 肽段导入Aedesaegyptidensovirus(AeDNV)病毒中,能显著增强病毒对埃及伊蚊幼虫的致死毒力[178]。更值得注意的是,植物内生菌作为健康植株生活史过程不可或缺的共生菌,以其作为生防载体搭载外源功能性杀虫或杀菌蛋白,通过定殖宿主农作物,相应蛋白随菌体在植株体内共转录表达和迁移蓄积,由此可以达到协同宿主作物防治病虫害的目的,如DOWNING 等[179]、ZHANG 等[180]以植物内生菌为生防载体分别搭载具备抗大豆根腐病(病原菌为立枯丝核菌Rhizoctoniasolani)功能的几丁质酶和具备抗水稻白背飞虱(Sogatellafurcifera)功能的半夏凝集素,构建的重组生防工程菌直接定殖相应农作物后均可协同宿主植株防治靶标病虫害。这种以植物内生菌搭载功能性蛋白材料定殖宿主作物协同防治靶标病虫害的创新应用策略,有望推动蛋白类抗病虫害材料避开在制剂表达及产品维持活性稳定上的困境,也能跳过其转基因作物改造过程的复杂技术流程且在不改变宿主作物其他性状的前提下达到与其转基因作物类似的抗病虫害功效[135],目前尚无Bt 毒素的相关研究和应用,依托该策略,未来有望实现Bt 毒素及基于Bt 毒素的新型杀虫蛋白在靶标害虫防治上突破传统制剂或转基因方式迈向更为绿色有效的创新应用模式,具有重要的探索价值和科学研究意义。
