奥沙利铂联合卡培他滨治疗结直肠癌疗效及对炎症因子和免疫指标表达水平的影响
2024-01-17胡黎明姜勇董延琥韩建成
胡黎明,姜勇,董延琥,韩建成
结直肠癌是临床常见的消化系统恶性肿瘤,其发病率较高,一项全球恶性肿瘤统计报告显示[1],结直肠癌的发病率约为10.20%。由于结直肠癌早期的症状并无特异性,多数患者确诊时已进展至晚期,失去了根治性手术机会,因此该病的5 年生存率较低[2]。炎症反应在恶性肿瘤的发病过程中具有重要作用,中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)已被证实对恶性肿瘤患者的预后具有一定的预测价值[3]。糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)是目前临床研究比较热门的血清肿瘤标志物,与肿瘤细胞的复制活性有关,因此常作为评价恶性肿瘤病情的辅助指标[4]。
化疗是结直肠癌患者常用的治疗方法,卡培他滨是一种氟尿嘧啶类口服化疗药物,是结直肠癌的首选化疗药物。但相关研究提示单用卡培他滨化疗时有部分患者疗效欠佳,因此很多医生采用联合用药方式治疗[5]。奥沙利铂是第3 代铂类抗肿瘤药物,可用于晚期结直肠癌的辅助用药[6],但奥沙利铂和卡培他滨联合用药的相关研究较少。基于此,本研究探讨奥沙利铂联合卡培他滨治疗结直肠癌疗效及对炎症因子和免疫指标表达水平的影响,以期为临床提供参考依据。现报道如下。
1 资料与方法
1.1 一般资料
选择2020 年3 月~2023 年1 月某院收治的结直肠癌患者75 例作为研究对象。采用随机信封法分为观察组(38 例)和对照组(37 例)。对照组采用卡培他滨治疗,观察组采用奥沙利铂联合卡培他滨治疗。对照组:男性20 例,女性17 例;年龄32~75 岁,平均年龄(52.64±3.75)岁;直肠癌12 例,结肠癌25 例;病理分型:腺癌27 例,黏液腺癌10 例;肿瘤、淋巴结、转移(tumor,node,metastasis,TNM)分期:Ⅲ期20 例,Ⅳ期17 例。观察组:男性21 例,女性17 例;年龄33~72 岁,平均年龄(52.67±3.82)岁;直肠癌13 例,结肠癌25 例;病理分型:腺癌26 例,黏液腺癌12 例;TNM 分期:Ⅲ期22 例,Ⅳ期16 例。两组患者一般资料比较无统计学差异(P>0.05),具有可比性。本研究经该院伦理委员会批准。本研究患者知情并签署知情同意书。
纳入标准:①符合《中国结直肠癌诊疗规范》(2015 版)[7]结直肠癌的诊断标准,经肿瘤标志物、肠镜、病理学及影像学检查确诊为结直肠癌者。②年龄31~79 岁者。③TNM 分期Ⅲ~Ⅳ期,无法进行手术治疗,且预计生存期>3 个月者。④临床资料完整者。⑤意识清晰,依从性较好者。
排除标准:①合并其他部位原发性肿瘤者。②血液疾病、急性感染者。③妊娠期、哺乳期妇女。④肝肾功能严重不全者。⑤免疫系统疾病者。
1.2 治疗方法
对照组:口服卡培他滨片(上海罗氏制药有限公司,国药准字H20073023,规格0.15g)1000 mg/m2,bid,连服14 天后停用7 天,21 天为1 个治疗周期。观察组:在对照组基础上联合静脉滴注注射用奥沙利铂(Sanofi-Aventis France,国药准字H20171065,规格50mg)130mg/m2,D1,输注时间不少于120min,21 天为1 个治疗周期。两组患者治疗至少3 个周期。
1.3 观察指标
于治疗前、治疗3 个周期后抽取两组患者空腹状态下外周静脉血标本8ml,分装于3 支真空采血管。
(1)NLR、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和白介素-2(interleukin-2,IL-2)水平:于治疗前、治疗3 个周期后抽取两组患者空腹状态下外周静脉血标本8ml。采用BC-3000 血细胞分析仪(深圳迈瑞医疗电子股份有限公司)检测血常规,NLR=中性粒细胞/淋巴细胞比值。采用ST16R 离心机(赛默飞世尔科技公司),3000r/min(4℃)离心10min,采用酶联免疫吸附法检测血清TNF-α和IL-2 水平。
(2)Th1/Th2 水平:于治疗前、治疗3 个周期后抽取两组患者空腹状态下外周静脉血标本8ml。采用流式细胞术(CytoFLEX 流式细胞仪,美国贝克曼-库尔特公司)检测Th1 细胞和Th2 细胞情况后计算Th1/Th2。
(3)癌胚抗原(CEA)和CA19-9 水平:于治疗前、治疗3 个周期后抽取两组患者空腹状态下外周静脉血标本8ml。采用电化学发光法(MK3酶标仪,赛默飞公司)检测血清癌胚抗原CEA 和CA19-9,试剂盒购自上海臻科生物科技有限公司。
(4)癌因性疲乏评分、卡氏功能状态评分[8]:评价患者疲乏程度,分值0~10 分,得分越高表示越疲乏。卡氏功能状态评分[9]:评价患者身体机能情况,满分100 分,0 分表示死亡,100 分表示正常无症状,分数高表示身体机能好。
(5)临床疗效:① 完全缓解:病灶完全消失,持续≥4 周。②部分缓解:病灶最大径减少≥30%,持续≥4 周。③稳定:病灶最大径减少<30%或增加<20%。④进展:出现新病灶或病灶最大径增加≥20%。总有效率(%)=完全缓解率+部分缓解率。
(6)不良反应发生情况:统计两组患者白细胞下降、血小板下降、血红蛋白减少、脱发及肝功能损害等不良反应发生情况。
1.4 统计学方法
采用SPSS25.0 软件进行数据统计学分析。计量资料以±s表示,采用t检验分析指标差异;计数资料以n(%)表示,采用χ2检验分析组间指标差异。P<0.05 为具有统计学差异。
2 结果
2.1 治疗前后两组患者血清NLR、TNF-α和IL-2 水平比较
治疗前,两组患者NLR、TNF-α和IL-2 比较无统计学差异(P>0.05);治疗后两组患者NLR和TNF-α降低且观察组低于对照组(P<0.05);IL-2 升高,且观察组高于对照组(P<0.05)(表1)。
表1 治疗前后两组患者NLR、TNF-α和IL-2 水平比较 ±s
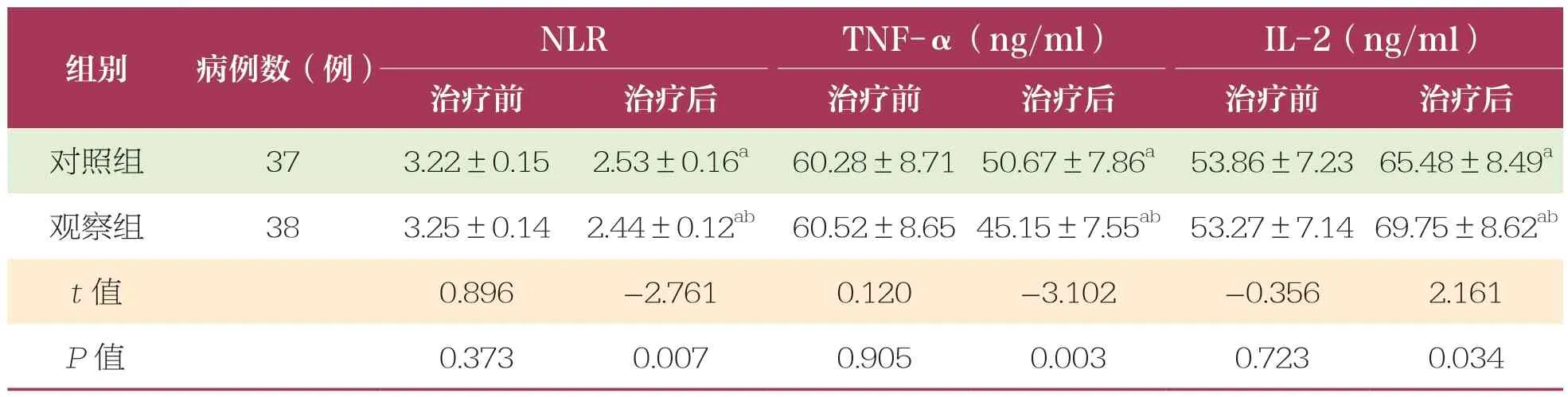
表1 治疗前后两组患者NLR、TNF-α和IL-2 水平比较 ±s
NLR:中性粒细胞与淋巴细胞比值;TNF-α:肿瘤坏死因子-α;IL-2:白介素-2。与同组治疗前相比,a:P﹤0.05;与对照组相比,b:P﹤0.05。下同
组别病例数(例)NLRTNF-α(ng/ml)IL-2(ng/ml)治疗前治疗后治疗前治疗后治疗前治疗后对照组373.22±0.15 2.53±0.16a 60.28±8.71 50.67±7.86a 53.86±7.23 65.48±8.49a观察组383.25±0.14 2.44±0.12ab 60.52±8.65 45.15±7.55ab 53.27±7.14 69.75±8.62ab t 值0.896-2.7610.120 -3.102 -0.356 2.161 P 值0.3730.0070.905 0.003 0.723 0.034
2.2 治疗前后两组患者Th1/Th2 比较
治疗前后,两组患者Th1/Th2 比较无统计学差异,组间比较无统计学差异(P>0.05)(表2)。
表2 治疗前后两组患者Th1/Th2 水平比较 ±s
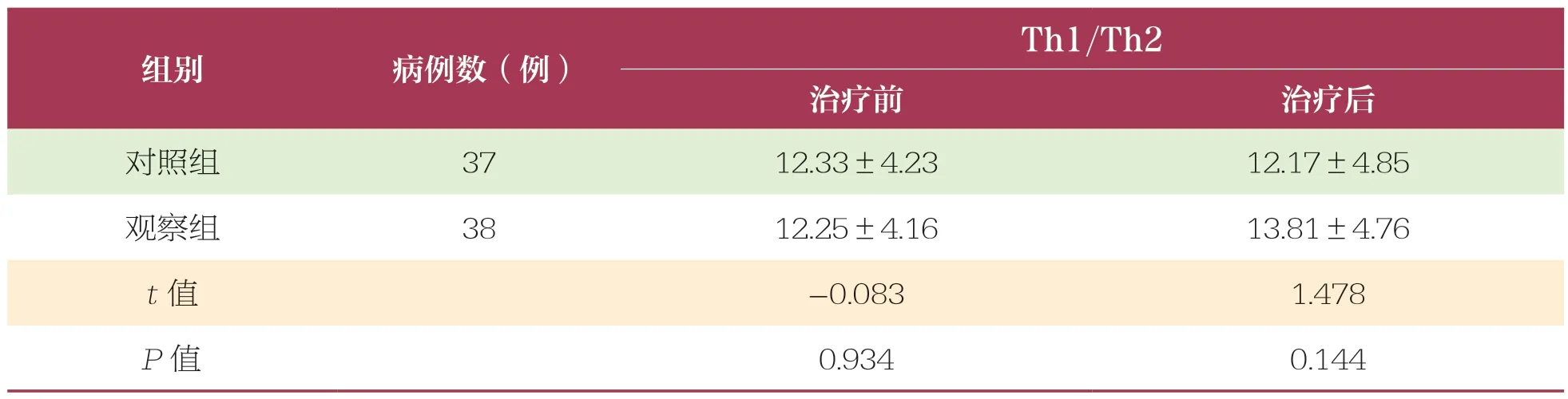
表2 治疗前后两组患者Th1/Th2 水平比较 ±s
组别病例数(例)Th1/Th2治疗前治疗后对照组3712.33±4.2312.17±4.85观察组3812.25±4.1613.81±4.76 t 值-0.0831.478 P 值0.9340.144
2.3 治疗前后两组患者CA19-9 和CEA 水平比较
治疗前两组患者血清CEA 和CA19-9 比较无统计学差异(P>0.05);治疗后,两组患者CEA 和CA19-9均下降,且观察组低于对照组(P<0.05)(表3)。
表3 治疗前后两组患者CEA 和CA19-9 水平比较 ±s
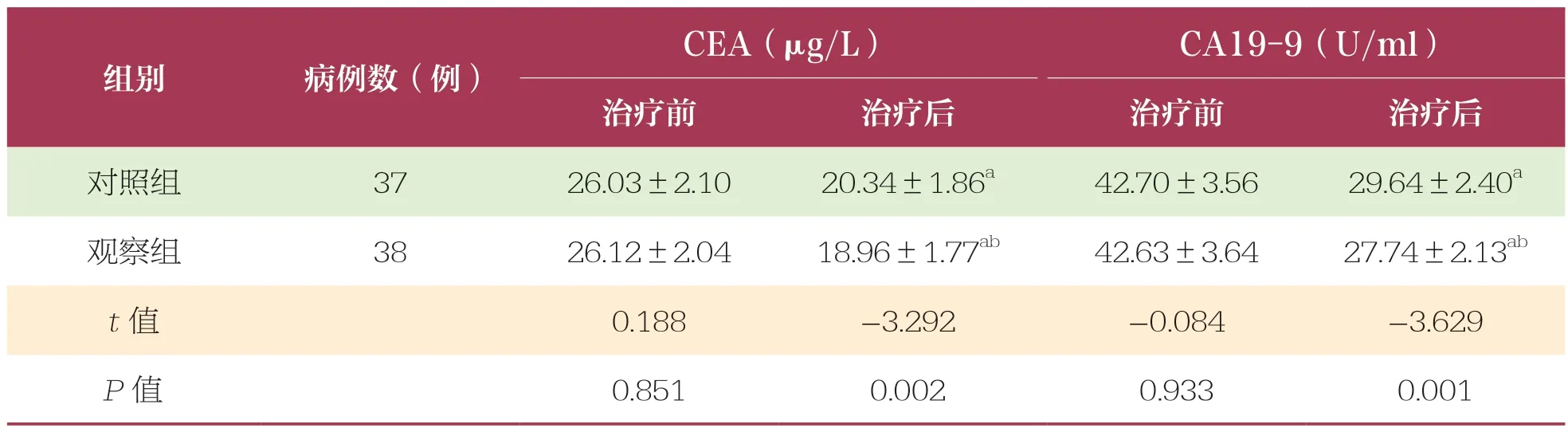
表3 治疗前后两组患者CEA 和CA19-9 水平比较 ±s
CEA:癌胚抗原;CA19-9:糖类抗原19-9
CEA(μg/L)CA19-9(U/ml)治疗前治疗后治疗前治疗后对照组37 26.03±2.1020.34±1.86a42.70±3.5629.64±2.40a观察组38 26.12±2.0418.96±1.77ab42.63±3.6427.74±2.13ab t 值0.188 -3.292 -0.084 -3.629 P 值0.851 0.002 0.933 0.001组别病例数(例)
2.4 治疗前后两组患者癌因性疲乏评分、卡氏功能状态评分比较
治疗前两组患者癌因性疲乏评分、卡氏功能状态评分比较无统计学差异(P>0.05);治疗后,两组患者癌因性疲乏评分均下降,且观察组低于对照组(P<0.05);两组患者卡氏功能状态评分均升高,且观察组高于对照组(P<0.05)(表4)。
表4 治疗前后卡氏功能状态评分、癌因性疲乏评分比较 ±s,分
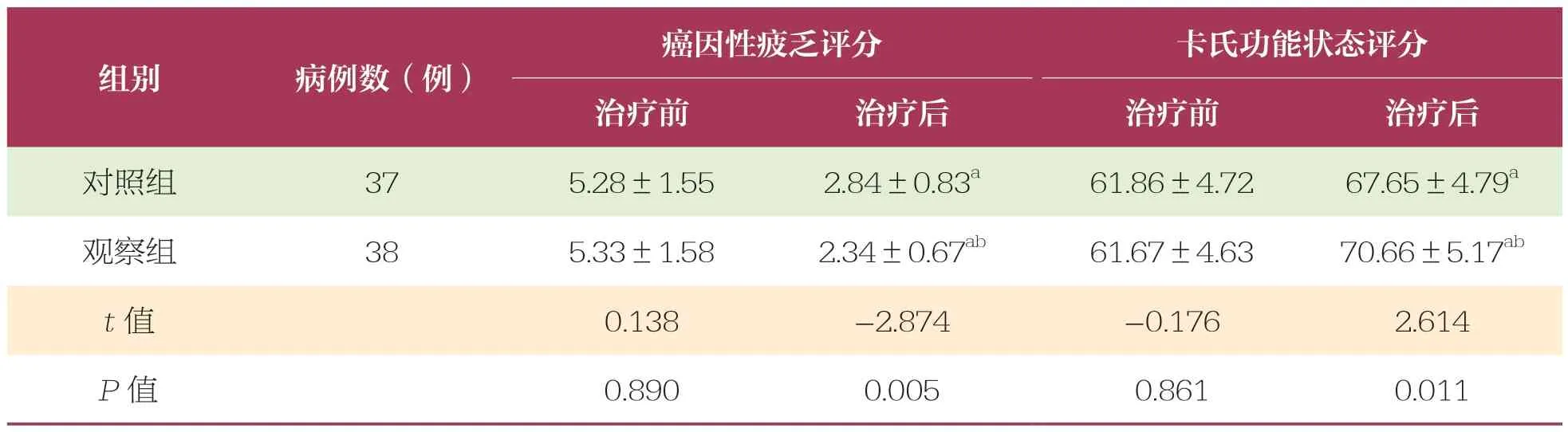
表4 治疗前后卡氏功能状态评分、癌因性疲乏评分比较 ±s,分
癌因性疲乏评分卡氏功能状态评分治疗前治疗后治疗前治疗后对照组37 5.28±1.552.84±0.83a61.86±4.7267.65±4.79a观察组38 5.33±1.582.34±0.67ab61.67±4.6370.66±5.17ab t 值0.138 -2.874 -0.176 2.614 P 值0.890 0.005 0.861 0.011组别病例数(例)
2.5 两组患者临床疗效比较
观察组临床治疗总有效率(65.79%)高于对照组(40.54%,P<0.05)(表5)。
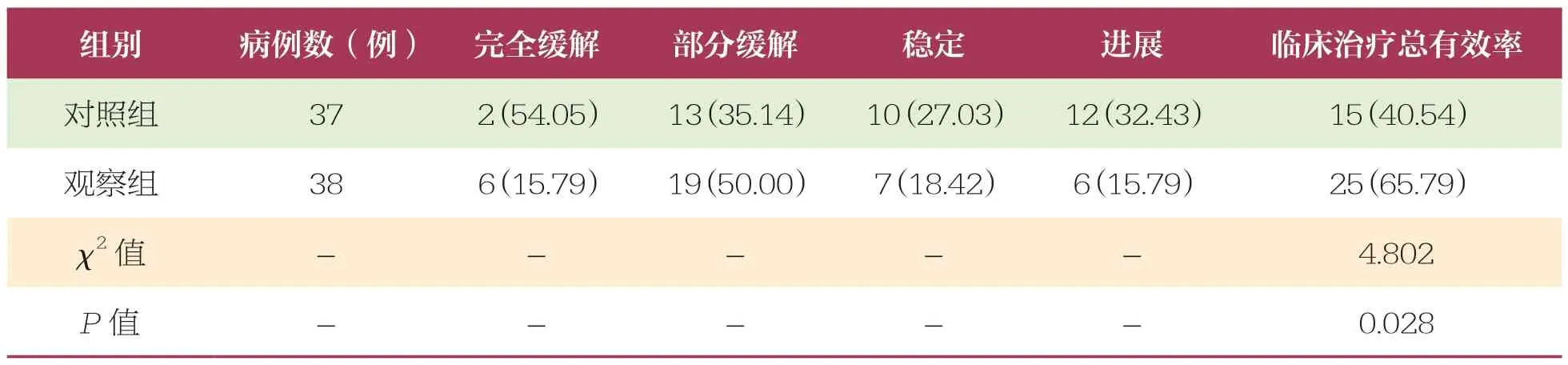
表5 两组患者临床疗效比较 n(%)
2.6 两组患者不良反应发生情况比较
观察组肝功能损害、脱发、血红蛋白减少、白细胞下降及血小板下降等不良反应总发生率(28.95%)低于对照组(37.84%),无统计学差异(P>0.05)。见表6。
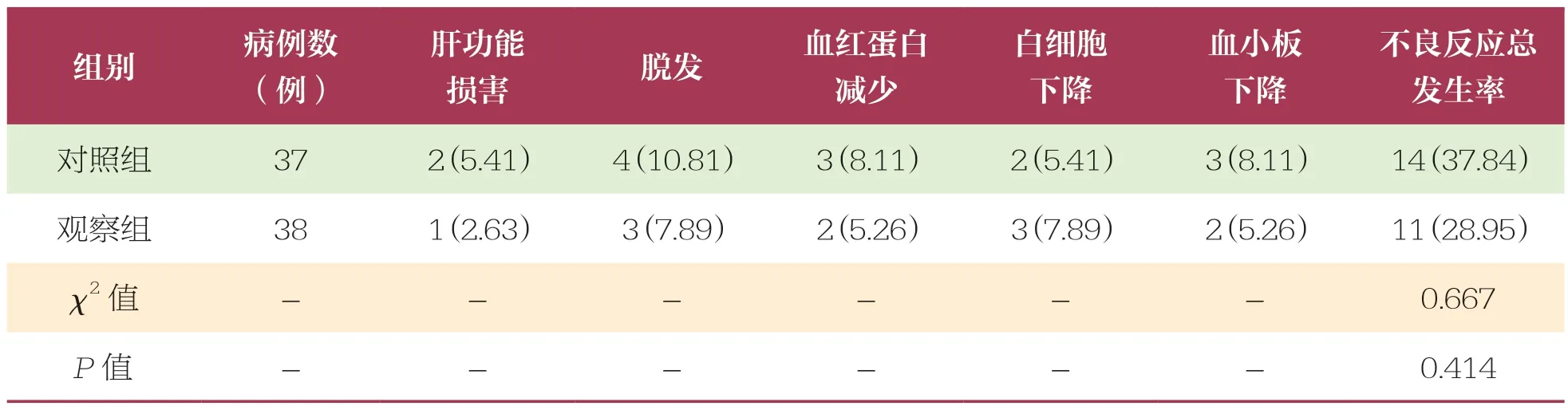
表6 两组患者不良反应发生情况比较 n(%)
3 讨论
据相关流行病学调查发现[10],结直肠癌的发病率仅次于食管癌和胃癌,位居消化道恶性肿瘤的第3 位。晚期结直肠癌患者接受根治性手术后的5年生存率仅为34.3%,而对于无法接受根治性手术治疗的晚期结直肠癌患者而言,这一数值更低。化疗可延缓肿瘤病情进展,延长生存时间,是目前临床治疗结直肠癌的重要方法[11]。卡培他滨可在体内转化为5-氟尿嘧啶,通过干扰肿瘤细胞DNA 的合成而发挥抗肿瘤作用[12]。奥沙利铂是晚期结直肠癌常用的化疗药物,对5-氟尿嘧啶治疗失败的患者也具有一定的疗效。但奥沙利铂可引起骨髓抑制、肝肾功能以及神经系统损伤等不良反应,应引起高度重视[13]。
本研究结果显示,观察组的治疗总有效率明显高于对照组;治疗后两组患者癌因性疲乏评分降低,且观察组低于对照组;卡氏功能状态评分升高,且观察组高于对照组。提示奥沙利铂联合卡培他滨治疗结直肠癌的临床疗效更好,可更好地减轻患者的癌因性疲乏,提高身体机能。这是由于口服卡培他滨后,其可迅速被肠道黏膜吸收,在肝脏经羧基酯酶的催化形成5’-脱氧-5’氟胞苷,经苷磷酸化酶催化形成5-氟尿嘧啶,而5-氟尿嘧啶可作用于肿瘤细胞脱氧核糖核酸(deoxyribo nucleic acid,DNA),形成链间及链内交链复合物,与核蛋白、胞浆蛋白结合而抑制肿瘤细胞DNA 复制[14]。奥沙利铂的作用靶点为肿瘤细胞DNA,可与DNA 链G位点结合,形成烷化结合物,引起链间交联而阻止肿瘤细胞的增殖[15]。两药联用通过不同的作用机制发挥协同抗肿瘤作用,具有更强的抗肿瘤效果,可以阻止肿瘤病情进展,减轻机体肿瘤负荷,改善患者健康状况。
细胞免疫是恶性肿瘤患者自身抗肿瘤的重要机制,辅助性T 淋巴细胞是机体细胞免疫的重要细胞,Th1/Th2 偏移与恶性肿瘤的发生有关,Th1 细胞可分泌大量的IL-2 和TNF-α等细胞因子[16]。IL-2可增强 B 细胞分泌抗体的功能,并能调控NK 细胞杀伤能力,促进单核细胞成熟、分化,而发挥抑制肿瘤细胞增殖作用[17]。TNF-α可直接杀伤肿瘤细胞,但也可为肿瘤细胞的生长、浸润提供条件[18]。中性粒细胞可分泌活性氧、一氧化氮等自由基,抑制细胞毒性淋巴细胞功能。而淋巴细胞可抑制肿瘤细胞生长,因此NLR 升高时提示淋巴细胞受到抑制,机体肿瘤细胞生长更快[19]。本研究中,治疗后观察组血清NLR 和TNF-α低于对照组,IL-2 高于对照组,Th1/Th2 比较无统计学差异。提示奥沙利铂联合卡培他滨治疗结直肠癌可更好地降低NLR和TNF-α,升高IL-2 水平,从而调动机体自身抗肿瘤能力,提高抗肿瘤治疗效果。但其在调节Th1/Th2 平衡方面并不具优势,这可能与两组患者在化疗期间糖皮质激素的应用有关。
CEA 是一种酸性糖蛋白,可促血管生成、保护肿瘤细胞免于凋亡,并能促进黏附分子的表达,从而有利于肿瘤细胞转移[20]。CA19-9 是一种黏蛋白糖脂,在消化系统恶性肿瘤患者体内高表达[21]。两者均是临床比较常用的肿瘤标志物,可在一定程度上反映肿瘤细胞复制活性。本研究中,治疗后两组患者CEA 及CA19-9 降低,且观察组低于对照组。提示奥沙利铂联合卡培他滨治疗结直肠癌的治疗效果更好,可更好地抑制肿瘤细胞的复制。本研究中,两组患者不良反应发生率比较无统计学差异。提示奥沙利铂联合卡培他滨治疗结直肠癌安全性较好,并未显著增加不良反应风险。这可能与联合用药时奥沙利铂的剂量较小有关。
综上所述,与单独用卡培他滨治疗相比,奥沙利铂联合卡培他滨治疗结直肠癌临床疗效更好,患者血清NLR、CEA 和CA19-9 水平更低,且不会增加患者不良反应的发生,值得临床推广。
