分子设计育种在棉花中的应用进展与展望
2024-01-16赵俊杰任中英章志强张飞刘艳改贺昆仑郭金峰周晓箭张文生王海娟李威杨代刚
赵俊杰,任中英,章志强,张飞,刘艳改,贺昆仑,郭金峰,周晓箭,张文生,王海娟,李威,4*,杨代刚,4*
(1.中国农业科学院棉花研究所/ 棉花生物育种及产业技术国家工程研究中心,河南安阳455000;2.奎屯华棉农业科技有限公司,新疆奎屯 833200;3.新疆生产建设兵团第七师农业科学研究所,新疆奎屯 833200;4.郑州大学农学院,郑州 450001)
1 棉花生产发展现状
棉花是我国重要的经济作物,是除粮食之外最重要的农产品和战略物资,棉花产业影响着国民经济的发展。我国是原棉生产大国,2022 年,全国棉花播种面积为300.03 万hm2,总产量597.70万t,占全球棉花总产量(2570 万t)的近四分之一(图1 和附表1)[1]。随着社会进步和人民生活水平的提高,在保证产量的基础上,提升棉花品质成为育种家的重要发力点。 此外,当前全球气候变化导致的灾害性天气频发,国际政治经济环境复杂,保证原棉这一大宗农产品的安全供给是棉花产业可持续发展的关键。

图1 1949―2022 年我国棉花逐年播种面积和总产量Fig.1 Annual plantation area and total annual production of cotton in 1949-2022 in China
我国是人口大国,在保证18 亿亩(亩为废弃单位,1 亩约为666.7 m2) 的耕地红线下,2016 年原农业部对棉花种植结构重新调整规划,将棉花种植面积调整至5 000 万亩左右, 其中将新疆植棉面积提升至2 500 万亩。 在有限种植资源下保障国家棉花生产安全是我国棉花产业必须应对的挑战。 种子是农业的“芯片”,培育突破性新品种是提振棉花产业的关键。 自新中国成立以来,通过科学家的不断奋斗,我国的棉花育种取得了巨大的成就,极大地促进了棉花产业的发展。
2 棉花育种历程
作物育种先后经历了原始驯化选育、常规育种、分子育种、分子设计育种4 个阶段[2]。 原始驯化选育(育种1.0)通过人工选择,保留最适宜栽培的野生种,优中选优,驯化成适合农耕需要的栽培种或农家种。 常规育种(育种2.0)开始和兴盛于20 世纪, 玉米杂交育种和矮秆绿色革命基因的成功应用是常规育种的里程碑,在世界粮食增产和推动农业发展方面发挥了巨大作用[3-4]。 分子育种(育种3.0)包括基于20 世纪90 年代迅速发展的分子生物学理论和技术而形成的分子标记辅助育种和转基因育种;步入21 世纪,分子设计育种(育种4.0)以新一代测序技术、基因组编辑技术、单倍体制种等新型技术为基础,将生物遗传学理论与杂交育种相结合,基于对控制作物重要性状的关键基因及其调控网络的认识,利用基因组学、表型组学等多组学数据进行生物信息学的解析、整合、筛选、优化,从而获取符合育种目标的最佳基因型, 实现性状的精准定向改良,从而高效地培育目标新品种[5-6]。
自20 世纪50 年代以来,我国棉花育种得到了质的飞跃, 棉花单产也经历了跨越式发展。2022 年,每666.7 m2皮棉产量达132.8 kg,比新中国成立初期增加12.4 倍(图2)。 我国棉花单产取得突破性提高的最重要因素是育种技术发展推动的品种改良。 据统计,品种改良对产量提高的实际贡献率达到30%以上[7]。 以下就新中国成立以来我国的棉花育种发展历程进行简单梳理。
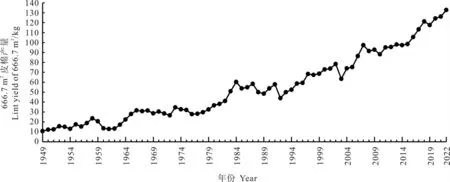
图2 1949―2022 年我国每666.7 m2 皮棉产量Fig.2 Lint yield of cotton per 666.7 m2 in 1949-2022 in China
2.1 国外引种促进我国早期棉花育种发展
20 世纪20 年代, 我国第一次引进了美国的金字棉、脱字棉、爱字棉等陆地棉(Gossypium hirsutumL.) 品种, 逐步替代了长期种植的亚洲棉(G.arboreumL.)品种;1933―1947 年,我国相继引进了德字棉531、斯字棉4 号、珂字棉100 等品种,完成了第二次引种;之后在1950 年前后引进岱字棉15 号、斯字棉5A 等美国品种,完成了我国亚洲棉和前期引进品种的更换,优化了我国的陆地棉品种[8-10]。 这些品种的成功引进,使我国棉花单产提高了15%, 纤维长度增加2~4 mm,改善了我国棉花生产上因长期使用亚洲棉以及混杂退化陆地棉品种导致的产量低、 品质差等问题,对我国棉花品种改良及棉花产业的发展起到了推动作用。
2.2 系统选育和杂交育种取得重要进展
系统选育是以原有品种产生的自然变异为前提进行的人工选择育种。 自20 世纪60 年代开始, 中国农业科学院棉花研究所在岱字棉15 号基础上选育出中棉所2 号,从乌干达棉中选育出中棉所7 号,这些系统选育的品种比对照品种岱字棉15 号增产14.3%左右[10]。 此外,前徐州农业科学研究所从斯字棉2B 中系统选育出徐州209, 该品种在当时比对照斯字棉2B 及岱字棉15 号增产(以皮棉计)15%以上[11],是我国第一个产量超美棉的大面积种植品种,并于1965 年获得国家发明奖;之后,从徐州209 后代中选育出中早熟品种徐州1818,使棉花单产提高18%,累计推广面积达7 800 万亩[10],荣获1978 年全国科学大会奖。 这些系统选育的品种逐步取代国外引进的品种,开启了我国棉花品种自主选育的发展道路。
20 世纪70 年代之后, 在推广自交品种的同时,我国也逐步开始棉花杂交育种工作。 育种家在中棉所2 号和1195 系的杂交后代中选育出鲁棉1 号,该品种比岱字棉15 号增产30%以上[12],累计推广面积超过1 亿亩,是我国第一个大规模种植的国产品种,彻底结束了美国岱字棉系列作为我国黄河流域棉区主导品种的20 多年历史,1981 年荣获国家发明一等奖。 除此之外,在黄河流域棉区通过杂交手段先后选育出徐州142、邢台6871、冀棉8 号等代表性品种;在长江流域棉区选育出鄂沙28、鄂棉18、苏棉2 号等表现优良的品种[10,12]。 进入20 世纪80 年代中期,枯萎病和黄萎病呈快速传播态势,我国育种家从乌干达4 号和邢台6871 的杂交后代中选育出抗病品种中棉所12 号, 该品种首次克服了高产与抗病性、 纤维品质遗传负相关的难题,1986―1997 年累计推广面积超过1.6 亿亩, 成为当时推广面积最大、单年种植面积最高和衍生品种最多(超过200 个)的历史性品种,荣获国家技术发明奖一等奖,创造了巨大的社会效益和经济效益[13]。中棉所16 和中棉所19 早熟性好,开创了麦棉套种、两熟种植模式,化解了粮棉争地矛盾,1997 年和1999年分别获得了国家科技进步奖一等奖[14-15]。 其他育种单位在此期间也培育了很多优良的棉花品种,如山东省农业科学院育成的鲁棉6 号,其皮棉产量高于对照品种冀棉8 号13.6%,到1990 年累计推广种植6 000 万亩[12];此外,徐州农业科学研究所选育的早熟、抗病品种徐州219,河南省农业科学院经济作物研究所与中国科学院遗传与发育生物学研究所联合选育的抗病品种豫棉11 等均为当时抗病育种工作做出了突出贡献。
近几年, 新疆成为我国最大的棉花主产区,棉花种植面积和总产量常年稳居全国第一位。新中国成立后, 我国从苏联先后引进了2 依3、910 依、5904 依、8763 依等海岛棉(G.barbadenseL.)品种并直接推广种植[10],这些品种为我国西北内陆地区早期海岛棉育种奠定了基础,开启了新疆地区棉花传统育种工作的新篇章。 自20 世纪60 年代后,新疆地区开始推广自育品种吐海1 号和军海1 号等,其中军海1 号以其抗病、早熟、丰产特性,成为我国种植时间最长、推广面积最大的海岛棉品种[10]。20 世纪80 年代之后,推广种植的新海3 号、 新海11 等新海系列抗病品种结束了新疆棉花育种初期品种多、乱、杂的局面,使新疆逐步发展为我国的主要海岛棉种植区。 在引进海岛棉的同期,我国从苏联引进司3173、108 夫、司1470 等早熟、大铃的陆地棉品种,逐步淘汰了原先种植的草棉(G.herbaceumL.)和黑籽棉[10]。之后,以108 夫、克克1543、司1470 为材料,自育出军棉1 号、新陆早3 号、新陆中1 号、新陆中3号等棉花品种,其中军棉1 号是最早育成的中熟陆地棉品种,具有产量高、适应性广、抗逆性强的特点,其累计推广面积达2 400 多万亩,对我国西北棉区品种更替发挥了重要作用,该品种的成功选育也彻底结束了引进苏联品种进行推广应用的局面[16]。 之后陆续培育的新陆早33 号、新陆中54 号和新陆早66 号等品种使得我国新疆植棉区棉花产量大幅度提高[17-18]。
2.3 分子育种技术是棉花育种的“加速器”
分子育种技术是通过利用分子手段对目标材料进行性状改良,进而培育出符合育种需求的新品种, 主要包括分子标记辅助育种和转基因育种[19-20]。 借助分子标记辅助选择技术,我国培育了纤维品质突出的中棉所70,该品种的纤维上半部平均长度达32.5 mm, 断裂比强度33.5 cN·tex-1,马克隆值4.3,纺纱均匀性指数166,达到了“双30”标准(即纤维上半部平均长度超过30 mm,断裂比强度超过30 cN·tex-1), 是我国首个国审优质抗虫杂交棉品种[21]。之后,利用该育种方法又陆续培育出中棉所78、中棉所96、中棉所101 等优质抗虫杂交棉品种[22]。 20 世纪90年代,棉铃虫和红铃虫成为我国棉花生产的灾难性害虫。我国科学家成功构建具有自主知识产权的苏云金杆菌(Bacillus thuringiensis,Bt)转基因体系,并成功选育出sGK321(1998 年)、中棉所41(2001 年)和中棉所45(2003 年)等转基因抗虫棉品种,打破了国外技术垄断,实现抗虫棉的国产化[23]。我国成为继美国之后第二个成功培育出转基因抗虫棉品种的国家[24]。 其中,中棉所41 是借助花粉管通道法等技术培育的第一个国审转基因抗虫棉品种,使棉铃虫危害降低了70%~80%,种植面积曾占山西、陕西2 省种植面积的50%以上,在2009 年荣获国家科技进步二等奖,被专家评价为“该品种是我国转基因抗虫棉育种的重大突破”。 之后,我国科学家又相继培育出转基因杂交棉品种鲁棉研28 号、中棉所63、中棉所66、湘杂棉7 号、铜杂411、鄂杂棉29 等,彻底打破美国抗虫棉的垄断。 自1997 年我国开始商业化种植转基因棉花以来,种植规模快速增长,由当年的150 万亩增长到5 850 万亩,在2002 年,国产转基因抗虫棉的种植面积占转基因棉总种植面积的52%,首次超过国外品种[24-26]。
分子标记辅助育种也推动了多基因控制的重要农艺性状的协同改良。 中国农业科学院棉花研究所马雄风等在传统育种基础上借助高通量基因分型平台,筛选了聚合优异基因、遗传背景优良的中间材料,选育了集早熟(110 d)、高产(亩产量450 kg)、 优质 (纤维上半部平均长度超过31 mm,断裂比强度超过31 cN·tex-1)、稳产的突破性品种——中棉113。该品种于2019 年通过甘肃省审定,并在北疆植棉区引种种植,连续入选新疆生产建设兵团主推品种,其推广应用令北疆部分风险棉区转变为适宜棉区。 该品种有望成为北疆地区确保高品质棉花供应、超越“澳棉”品质标准的“芯片品种”[27-29]。 由于综合性状突出,中棉113 入选了农业农村部2022 和2023 年度主导品种,并获批出口“一带一路”沿线国家,通过塔吉克斯坦共和国品种审定[30-31]。
3 棉花分子设计育种的重要成果
随着分子生物技术特别是基因编辑技术、高通量测序技术的发展,分子设计育种将“经验育种”转变为“精准育种”,大大提高了育种效率。 近十年,由科技部实施的“七大农作物育种”项目和由中国科学院启动实施的战略性先导科技专项(A 类)“分子模块设计育种创新体系”“种子精准设计与创造”项目,分别开展了水稻、玉米、大豆、小麦、棉花等复杂性状的解析和设计育种技术的开发[32-34]。 虽然棉花分子育种相关研究开展较晚,但在“863”和“973”重大计划、国家重点研发计划等项目支持下, 我国棉花基础研究取得不少突破,在棉花基因组研究、群体遗传研究、重要农艺性状的分子模块解析等方面都取得较大进展,其中基因组研究已处于国际领先水平。
3.1 棉花基因组测序取得重大进展
棉花基因组测序的完成和不断更新对群体遗传研究、基因定位、分子育种模块构建等起到巨大的推动作用。 目前大面积种植的陆地棉是由A 基因组和D 基因组大约在100 万~160 万年以前杂交加倍而形成的异源四倍体棉种[35]。 2012年,美国科学家和我国科学家分别公布了陆地棉D 亚基因组供体雷蒙德氏棉 (G.raimondiiL.)基因组序列[36-37]。 随着基因组测序技术的发展,又先后重新组装和更新了雷蒙德氏棉的基因组序列,最终确定其基因组大小为737~750 Mb[38-39]。2014 年, 我国科学家首次公布了A 基因组亚洲棉的基因组序列[40],经过不断更新,确定该基因组大小为1 637 Mb[39,41-42]。 同时,另一个A 基因组棉种草棉(非洲棉)的基因组序列也完成组装,其基因组大小为1 556 Mb[41]。 针对陆地棉A 亚基因组供体的争议, 朱玉贤院士团队明确了A 亚基因组的供体来源并不是上述的亚洲棉和非洲棉,而是草棉和亚洲棉已经灭绝的共同祖先基因组A0[41]。
陆地棉和海岛棉是世界上广泛种植的2 个四倍体棉种。 2015 年,中国农业科学院棉花研究所和南京农业大学分别牵头组装了陆地棉遗传标准系TM-1 的全基因组序列, 首次揭示四倍体棉花的全基因组参考序列和进化规律[43-44]。 经过先后6 次数据更新,确定其基因组大小为2287Mb,并将97.4%的序列锚定到26 条染色体上[41,45-50]。为弥补我国自育陆地棉品种基因组的空白,我国科学家分别在2019 年和2021 年公布了中棉所24 和农大棉8 号的全基因组数据,为研究棉花基因组结构变异及我国本土棉花遗传改良提供了参考图谱[50-51]。 在开展陆地棉基因组测序的同时,2015 年公布了第一个海岛棉栽培种——“3-79”的基因组序列,之后我国科学家对海岛棉品种新海21、海7124、Pima90 的基因组序列进行组装,为海岛棉重要基因的挖掘和陆地棉品种的改良提供了新的资源和参考,最新公布的海岛棉基因组大小为2 210 Mb[45,48,51-53]。
3.2 棉花纤维发育分子模块鉴定
棉花产量和纤维品质是育种改良的重要性状,而纤维发育对其有直接影响。 1992 年科学家首次克隆了在初生细胞壁合成后期和次生细胞壁合成早期阶段高表达、与纤维表皮细胞发育相关的基因pCKE6[54],自此开始棉纤维发育分子调控机理的研究。
转录因子在调控棉花纤维发育方面发挥着重要作用,包括MYB、bHLH、WRKY 等。 MYBWD40-bHLH 复合体在纤维起始分化中扮演关键的角色[55]。 MYB 转录因子是植物中数量庞大的一类家族,目前在棉花中发现524 个MYB[56]。 通过无纤维棉突变体和转基因试验验证发现,GhMYB25和GhMYB109正向调控纤维的起始和伸长, 过表达会导致纤维起始数目和叶片毛状体增加[57-58]。图位克隆定位到两个MYB25-like基因——GhMML3_A12和GhMML4_D12, 在GhMYB109和GhMYB25上游分别调控短绒和长纤维两种胚珠表皮细胞的纤维起始,对棉纤维的发育具有重要作用[59-61]。 在光子突变体N1中,GhMML3_A12能产生小RNA,经自我剪切,导致GhMML3_A12低水平表达, 影响棉纤维发育[60]。位于Dt12 染色体上的GhMML4_D12主要控制长绒纤维起始分化,被视为调控纤维发育起始的“开关”[61]。 对短纤维突变体和野生型棉纤维进行甲基化组和转录组联合分析, 发现转录因子GhMYB44的m6A 甲基化修饰程度在两种材料中差异显著,沉默GhMYB44能显著提高棉纤维的伸长[62]。 WRKY 类转录因子GhWRKY16 在纤维发育早期被GhMPK3-1 蛋白磷酸化后,能直接激活GhHOX3、GhMYB109、GhCesA6D-D11和GhMYB25基因的转录, 从而促进纤维的起始和伸长[63]。
激素是植物体内的微量有机化合物,调节各种生理过程,在棉纤维发育中发挥重要功能。 赤霉素(gibberellic acid, GA)能够促进棉花纤维伸长, 而加入GA 合成抑制剂会使纤维短而少[64]。GhHOX3是GA 信号通路的一个重要转录因子,沉默该基因会导致棉纤维缩短80%,进一步研究发现,GhHOX3 可以结合到棉花细胞壁松弛蛋白基因GhRDL1和GhEXPA1的启动子上,进而促进棉纤维伸长[65]。 而GhRDL1和GhEXPA1均属于细胞壁蛋白编码基因,共表达之后能显著改善棉纤维长度、强度和马克隆值[66]。 此外,当GA 浓度升高时,组成DELLA 阻遏蛋白的GhSLR1 被蛋白酶降解,释放GhHOX3 与增强子GhHD1 结合,促进棉纤维伸长[65-67]。 茉莉酸(jasmonic acid,JA)在表皮毛发育中起着重要作用。 JA 在纤维起始阶段可抑制纤维发育的负调控因子GhJAZ2的表达, 影响GhJAZ2与下游的MYB25-like和GhGL1相互作用,进而促进棉纤维形成[68]。 油菜素内酯(brassinosteroid, BR)是调控细胞伸长的重要激素,外源施加BR 能够正向调控纤维发育[69]。沉默编码BR 应答激酶受体蛋白的基因GhBRI1会使细胞次生壁的发育受到强烈抑制,影响纤维素在次生细胞壁中的沉积, 导致纤维成熟度降低[70]。类固醇5α 还原酶是BR 合成通路中的关键限速酶, 在种皮特异性表达编码类固醇5α 还原酶的基因GhDET2能够增加棉纤维的数量和长度[71]。 Yang 等[72]创制的功能获得型突变体pag1中,过表达编码细胞色素P450 的基因GhPAG1导致内源BR 失活从而抑制纤维伸长,该突变体植株矮小、纤维长度显著低于野生型。作为BR 信号通路下游的正调控因子,GhPRE1A 能够与GhAIF3 相互作用,解除GhAIF3 和bHLH 转录因子GhPAS1 的结合,重新激活GhPAS1 对下游靶基因的调控,从而促进棉花纤维的伸长[73]。酸性调控蛋白Gh14-3-3 可以与BR 信号转导途径中的关键转录因子GhBZR1 相互作用调节棉纤维的起始和伸长[74]。除BR 外,外源施加乙烯(ethylene,ETH)能够显著促进棉纤维细胞伸长。 1- 氨基环丙烷-1- 羧酸氧化酶(1-aminocyclopropane-1-carboxylic acid oxidase, ACO)是ETH 合成途径中的一个酶,目前在棉花中已克隆了3 个同源基因GhACO1、GhACO2、GhACO3,这些编码限速酶的基因在纤维伸长期高表达[75]。生长素(auxin,AUX)是植物重要的激素之一,利用表皮特异启动子FBP7 在棉花中表达外源吲哚-3- 乙酸(indole-3-acetic acid,IAA)合成基因iaaM能够显著提高棉株中生长素的含量, 促进纤维起始、增加纤维数量[76]。 作为典型的CIN 类TCP基因,GhTCP4在纤维次生壁加厚期受到miR319 的调控,与IAA 合成途径中的关键基因GhAUX1、GhIAA3和GhPIN2的启动子结合,调控棉纤维的发育[77]。脱落酸(abscisic acid, ABA)是纤维发育的负调控因子,在徐州142 无绒无絮突变体的纤维起始早期阶段检测到较高的ABA 含量,同时, 外源施加ABA 也会抑制离体培养的胚珠的纤维起始和伸长[78-79]。
木聚糖是纤维细胞壁中半纤维素的重要组分,研究人员鉴定了参与半纤维素合成的糖基转移酶基因,发现GhGT43A1和GhGT43C1均在次生壁合成期大量表达;基因突变和回补实验表明,GhGT43A1和GhGT43C1基因可能通过调节棉纤维细胞壁中木聚糖的积累影响棉纤维发育[80]。 糖转运蛋白SWEETs 负责蔗糖的运输和存储,是植物碳分配的重要调节因子。 转录因子GhMYB212 在纤维伸长期能直接调控蔗糖转运蛋白基因GhSWEET12的表达,介导胚珠中的蔗糖运输到纤维,从而调控棉纤维的伸长[81]。Gh-SWEET15在纤维次生壁合成期特异表达,突变该基因引起植株活性氧增加,导致纤维中蔗糖含量降低、次生壁变薄,进而影响纤维的长度和马克隆值[82]。
除了上述的调控机制,表观遗传修饰在棉纤维发育中也起着重要作用[83]。 组蛋白去乙酰化作为重要的表观遗传修饰之一,在植物的生长发育过程中发挥着重要作用。 利用胚珠离体培养发现组蛋白去乙酰化抑制剂曲古抑菌素A 显著抑制棉纤维起始发育;组蛋白去乙酰化可以调控多个植物激素途径的关键基因,进而抑制ABA 合成和信号转导,促进纤维细胞起始[84]。GhHAD5基因编码一个去乙酰化酶,在纤维发育起始阶段高表达,其RNA 干扰株系中纤维发育相关基因启动子区的H3K9 乙酰化水平显著升高,抑制了纤维起始,导致长纤维数量减少[85]。 组蛋白H2B 单泛素化酶GhHUB2 通过泛素-26S 蛋白酶体途径降解转录抑制因子GhKNL1,消除其对棉纤维长度和细胞壁厚度的抑制作用,促进棉纤维增长和次生壁增厚;GhHUB2超表达株系中纤维长度、细胞壁厚度以及纤维素和木质素的含量、纤维强度均显著高于对照[86-87]。
3.3 棉花抗病分子模块鉴定
棉花枯萎病和黄萎病均是由真菌引起的土传病害,是棉花生产上危害最为严重且化学药剂难以有效防治的维管束病害[88-89]。 鉴定棉花对枯、黄萎病抗性调控的分子模块对培育抗病棉花品种具有重要意义。 枯萎病由尖孢镰刀菌萎蔫专化型(Fusarium oxysporumf.sp.vasinfectum)引起,MAPK 级联信号通路可调控植物抗毒素的生物合成和植株的防卫反应,由棉花GhMKK6介导的MAPK 级联信号通路在枯萎病抗性方面发挥着重要作用。GhMKK6是棉花A 亚基因组MEKs基因,利用病毒介导的基因沉默技术沉默GhMKK6后发现,棉花对枯萎病菌的抗性显著下降。 通过酵母双杂交技术筛选到GhMKK6 的互作蛋白GhMORG1 可作为MAPK 级联信号通路的支架蛋白,调控GhMKK6 介导的MAPK 级联信号通路,影响棉花对枯萎病菌的抗性[90]。深入研究发现,转录因子GhbHLH122 在GhMKK6-GhMPK4 信号通路的下游发挥枯萎病抗性调控功能,GhMPK4 参与介导了GhbHLH122 调控的1- 氨基环丙烷-1- 羧酸(1-aminocyclopropane-1-carboxylate, ACC) 合成酶基因GhACS6a和GhACS6b的转录激活过程,进而促进ETH 的生物合成,最终正调控植株对枯萎病的抗性[91]。ETH 不敏感蛋白3(ethylene insensitive 3, EIN3)和EIN3-like(EIL)蛋白是ETH 信号转导途径中重要的转录因子,在枯萎病菌胁迫和外源ETH处理下,GhEIN3基因显著上调表达;GhEIN3沉默植株更易感病,在GhEIN3沉默植株中病程相关基因GhPR1、GhPR2、GhPR4和ETH 响应因子基因GhERF1、GhACO表达水平显著降低,表明GhEIN3基因能正向调控棉花枯萎病抗性[92]。GhERF5 是位于ETH 信号传导通路下游的转录因子,其通过参与ETH、JA途径调控下游相关抗病防卫基因的表达,进而提高棉花对枯萎病的抗性[93]。
黄萎病是由大丽轮枝菌(Verticillium dahliae)引起的一种土传真菌性病害,是造成棉花产量和品质下降的重要病害,被称为棉花的“癌症”[94-95]。防治黄萎病的有效手段之一就是挖掘抗病基因用于品种改良。 Li 等[96]筛选和鉴定了与大丽轮枝菌2 号生理型抗性相关的基因GbANA1,过表达该基因能提高拟南芥的抗性水平,且群体遗传学分析表明该基因在陆地棉中发生单核苷酸缺失,无法编码完整的核酸结合位点和富含亮氨酸重复结构域,进而导致对2 号生理型小种的抗性降低。 陆地棉核糖体蛋白基因GhRPL18A-6调控细胞壁和木质素合成,在过表达GhRPL18A-6的棉花中,木质部薄壁组织细胞壁的木质化及活性氧水平提高,且一些与抗病相关的标记基因显著上调,茎秆及根中大丽轮枝菌数量减少[97]。GhROP6编码Rho 鸟苷三磷酸酶,受茉莉酸甲酯诱导上调表达,在拟南芥中超表达GhROP6能增加茉莉酸-异亮氨酸含量和木质素含量,增强其对黄萎病菌的抗性[98]。 GhBIN2 是BR 通路中重要的蛋白激酶,能够磷酸化JA 信号通路的负调控因子茉莉酸ZIM 结构域蛋白(jasmonate ZIM-domain,JAZ),从而抑制JA 信号的传导,导致棉花植株对黄萎病的抗性降低[99]。 促丝裂原活化蛋白激酶基因GhMAPKKK2响应黄萎病菌及外源JA、SA处理,沉默GhMAPKKK2基因后,植株的病情指数、 维管束褐变程度以及茎段菌丝数量明显提高,表明该基因在棉花抗黄萎病反应中发挥正调控的作用[100]。 钙调蛋白(calmodulin,CaM)是生物体中存在的Ca2+传感器,对植物免疫至关重要。在棉花被病原菌侵染后,GhCaM7 作为次级信使与Ca2+结合,导致GhCaM7 乙酰化水平显著提高,进而提高植株对黄萎病的抗性[101]。 细胞壁相关的类受体激酶GhWAKL 在受到黄萎病菌侵染时,与棉花DnaJ 蛋白相互作用激活SA 生物合成,正向调节对黄萎病菌的抗性[102]。 Zhou 等[103]通过蛋白质修饰组学联合分析发现,在大丽轮枝菌胁迫下GhDEK2D 被磷酸化、乙酰化和泛素化,进而正向调控棉花抗病性,而沉默GhDEK2D导致棉花体内活性氧水平显著升高,与防御相关的基因表达水平显著下降。 这些研究结果为防治棉花黄萎病提供了重要的理论基础和基因资源。
3.4 基于测序数据挖掘棉花重要性状分子模块
棉花的产量、纤维品质、抗性等多是数量性状,多由数量性状位点(quantitativetraitlocus,QTL)控制,基因间存在多效性、协同耦合性。 解析重要性状间耦合的遗传调控网络,明确关键调控单元是分子设计育种的关键科学问题[33]。 由多单位合作对318 份棉花的全基因组重测序揭示了我国陆地棉品种的遗传基础和演化规律, 鉴定出25个品种改良相关位点和119 个产量、 纤维品质、黄萎病抗性等关联位点,为棉花“精准育种”提供了优异的基因资源和理论指导[104]。 华中农业大学张献龙团队为揭示人工驯化对基因组的影响,构建了陆地棉的首个综合变异图谱,在全基因组范围内鉴定了93 个驯化选择区间,其中4 个位点影响纤维品质, 研究还明确了At 基因组的驯化选择基因与纤维长度相关,Dt 基因组的驯化基因与逆境响应相关[49]。 中国农业科学院棉花研究所和河北农业大学合作首次利用重测序构建了419 份陆地棉核心种质的基因型和表型变异数据,发现了分别位于Dt11 和At10 染色体上控制棉纤维长度的2 个主效候选基因,鉴定到大量与纤维长度、纤维强度密切关联的主效QTL 位点,为陆地棉分子育种提供了关键的标记选择依据[105]。 浙江大学张天真团队构建了一套包含920份材料的多亲本重组自交系(multiparent,advanced generation, inter-cross, MAGIC)群体,鉴定到54个与产量、纤维品质性状关联的基因位点,结合839 份不同年代培育的栽培种,明确约85%的优良等位基因来自早期的美国引种,该研究为揭示中国棉花栽培种的遗传组成及育种历程提供了指导[106]。
随着测序技术和研究方法的发展,除了在核苷酸变异层面解析表型影响机制外,结构变异如何影响复杂性状已成为新的热点。 华中农业大学张献龙团队构建了1 913 份棉花种质资源的遗传变异组,挖掘到29 万个结构变异,利用泛基因组数据分析了124 个与纤维品质等性状相关的获得/缺失变异(present-absent variation,PAV)在驯化和改良中的频率变化,剖析了驯化和改良中的基因组分歧,共鉴定到162 个与纤维品质、产量、开花期等16 个性状相关的QTL,从泛基因组学的角度为棉花重要性状的精准改良提供新思路[107]。该团队还构建了棉属的泛三维基因组图谱,明确结构变异、转座子插入和染色质开放程度驱动了非编码调控元件与同源基因间调控网络的演化,结合1 005 份纤维发育的转录组数据, 解析了结构变异对纤维表型差异的影响,发现SGNH基因的拷贝数变异和调控演化与不同棉种纤维品质的差异相关[108]。中国农业科学院棉花研究所李付广团队利用单分子长读长测序(single-molecule long reads) 和Hi-C 测序技术组装了陆地棉品种TM-1 和ZM24 的基因组, 基因组比较分析发现At08 染色体上存在着最长的3 个结构变异,占该染色体总长度的30%,该倒位可能影响陆地棉群体分化,对推动棉花基础生物学研究和遗传改良具有重要意义[50]。 浙江大学张天真团队通过图形泛基因组联合关联分析, 挖掘到222 个与产量、纤维品质、成熟期相关的新结构变异位点,其中位于At04 染色体的与长绒棉衣分关联的结构变异位点可能是由南美洲的野生种和农家品种导入到美国匹马(Pima)棉[109]。
分析7 个异源四倍体棉种以及其他野生棉种的基因组图谱为解析棉种的进化过程和鉴定重要性状的分子机制提供了新的视角。 陆地棉产量高、海岛棉纤维长且抗逆性较强,比较基因组发现编码磷酸肽结合蛋白的基因结构变异可能引起纤维长度发生改变,而烯酰辅酶Aδ 异构酶3 和乙烯响应因子RAP2-7 可能通过调节植物激素相关的生化途径,提高棉花对非生物胁迫的耐受性[110-111]。 中国农业科学院棉花研究所杜雄明团队对我国不同棉区的230 份亚洲棉和13 份草棉的群体结构变异研究,揭示了与抗病性、产量和生育期等性状相关的遗传分化位点[42]。 为进一步明确二倍体棉种的遗传贡献, 该团队还分析了3 000 多份棉花种质资源,鉴定到2 个新的与纤维品质密切关联的优异等位变异,这2 个变异分别源自二倍体栽培种亚洲棉和野生种瑟伯氏棉,其中来自亚洲棉的优异等位变异对纤维长度和纤维强度的提升贡献接近15%,具有显著的纤维品质改良潜力,从基因组水平证实了远缘杂交对陆地棉纤维品质的影响[112]。
4 我国棉花分子设计育种发展路径
传统育种很难实现由多基因控制的复杂性状的协同改良,分子设计育种能够将新型生物技术和育种相结合,实现精准育种目标,提高育种效率,是未来作物育种的发展方向。
4.1 棉花公共数据库平台的建立
随着棉花基因组测序的完成及海量组学数据的出现,整合多组学数据,建立系统的公共数据库势在必行。 中国农业科学院棉花研究所通过整合18 个棉属物种的高质量基因组序列以及变异位点、转录组和基因互作网络等信息,搭建了棉花资源与网络数据库(Gossypiumresource and network database,GRAND),有效提高了棉花多组学数据的利用效率[113]。 多家单位联合整合了25个棉花基因组、76 个组织样本的转录组、5 个物种的表观遗传学、4 180 个样本的群体遗传变异数据、20 个表型和768 个代谢物含量等的公共多组学数据,构建了目前最为系统和全面的棉花多组学数据库CottonMD,该数据库利用多种关联分析方法挖掘“变异- 基因表达- 表型”之间的关联信息,并提供相应数据可视化查询[114]。 浙江大学农学院建立的棉花多组学数据库COTTONOMICS收集了3.25 Tb 的多组学数据,具有高效、便捷的分析模块和可视化功能,为棉花精准育种提供重要的科研平台[115]。 中国农业科学院生物技术研究所张锐团队建立了棉花CottonFGD 数据库,该数据库经过不断更新,目前也包含了比较全面的棉属基因组数据[116]。 然而,这些数据库目前仅应用在基础研究,无法直接用于实际育种工作,主要原因是育种者很难找到针对所用育种材料的遗传信息, 而这些数据库有不同的操作流程,很难实现不同数据库的交互式切换。 下一步,应构建标准化的基因型检测系统,建立分子育种数据库登记平台,摸清不同育种材料的遗传背景信息,在系统中存档,并基于传统机器学习和深度学习对种质资源的性状数据和遗传数据进行分析,搭建“一站式”人工智能决策系统,设计最佳育种方案,定向、高效改良和培育新品种,实现由传统经验育种到智能设计育种的转化。
4.2 基因编辑技术助力棉花分子设计育种
基因编辑是对特定DNA 序列进行剪切、碱基替换或插入,实现对基因组的修改[117]。 基因编辑技术是目前全球育种行业竞争的制高点,也是现代育种4.0 时代的技术核心,其中成簇的规律性间隔的短回文重复序列及其相关蛋白(clustered regularly interspersed short palindromic repeats/CRISPR-associated protein, CRISPR/Cas)系统以其操作简便、周期短、效率高等优点得到广泛应用和迅速发展,成为农作物品种改良强有力的工具[5,118]。 棉花作为异源多倍体的模式作物,在基因编辑遗传研究方面也取得进展。 华中农业大学金双侠团队利用高通量测序方法,详细评估了CRISPR/Cas9 系统在棉花基因编辑过程中的脱靶效应,发现CRISPR/Cas9 编辑后代中存在数千个单核苷酸多态性 (single nucleotide polymor phism,SNP)和插入缺失(insertion-deletion Indel)变异, 而这些遗传变异来源于同一亲本的后代,个体间的差异或者组织培养中体细胞变异的数量远远大于CRISPR 脱靶位点的数量, 表明CRISPR/Cas9 系统对多倍体植物基因组的编辑具有高度特异性,其脱靶率极低[119]。此外,中国农业科学院棉花研究所建立了无基因型限制的棉花遗传转化体系,可将转化周期缩短至2.5~3.0个月;同时,利用花青素显色原理建立的可视化基因编辑工具检测体系能提高基因编辑的检测效率[120]。这些方法的建立加速了基因编辑技术在棉花基因功能研究中的应用,但是如何将其运用于育种中还有许多问题要解决,例如,如何减少产业化种植过程中的基因漂移? 以CRISPR/Cas9为代表的基因编辑工具对操作者及实验室环境有严苛的要求,如何将其应用于常规育种环境也是必须要解决的一个问题。
4.3 合成生物学开辟棉花使用新路径
合成生物学是融合了生命科学、工程学和信息科学等多个研究领域的交叉学科,是以分子生物学和分子遗传学等为基础,结合多种组学和系统生物学的手段,根据实际应用需要,通过合成生物功能元件和系统,对细胞或生物模块、生物系统进行从头设计、改造,使其具有满足人类需求的生物功能[121-122]。 作为重要的经济作物,棉花全株都具有重要的价值, 除纤维可直接用于纺纱、棉籽用于榨油外,棉酚与紫杉醇同为萜类化合物,具有重要的药用价值。 研究发现棉酚可以广谱抑制多种冠状病毒,以新型冠状病毒(SARSCoV-2)为实验模型,采用多学科交叉的方式,筛选并发现棉酚可以靶向结合到RNA 依赖的RNA 聚合酶活性口袋区域,阻遏SARS-CoV-2 及其变异株的复制;另外,棉酚还对猪流行性腹泻病毒、猪急性腹泻综合征冠状病毒、猪德尔塔冠状病毒等多种冠状病毒具有抑制作用[123]。纤维素合酶复合体是合成生物学的另一个研究重点。 纤维素是植物细胞初生壁和次生壁的主要组分,由位于质膜的纤维素合酶复合体合成。 最近研究人员利用冷冻电镜解析了纤维素合成酶CesA 同三聚体结构,该结构与次生细胞壁形成有关[124]。 而棉花纤维细胞壁的特性决定了纤维品质, 因此,未来可利用合成生物交叉学科创造纤维体外发生器来改良棉花纤维品质。
5 结论
分子设计育种为快速突破现有品种的局限提供了契机,然而目前基因组中与重要性状相关的有效遗传信息仍比较匮乏,也缺乏完整的分子调控网络。 随着棉花公共数据库的建立、基因编辑体系的完善和市场化以及合成生物学的有效利用,棉花将逐步建立起从功能基因挖掘、验证,到遗传数据的更新和整合,以及育种材料的选育和技术体系的改良,为我国棉花产业安全和打好种业翻身仗提供技术支撑。
附表:
详见本刊网站(https://journal.cricaas.com.cn/Jweb_mhxb/CN/home)本文网页版。
附表1 1949―2022 年我国棉花播种面积和总产量
Table S1 China cotton area and production in 1949-2022.
