不同合成条件对BSA@ZIF-8 复合物性质的影响
2024-01-15颜子文谢毅鹏王车礼
颜子文,谢毅鹏,王车礼
1.常州大学药学院生物与食品工程学院,江苏 常州 213164;
2.常州大学石油化工学院,江苏 常州 213164
蛋白类酶是具有催化功能的生物大分子,与化学催化剂相比其具有诸多优点,如在常温常压下具有极高的活性及专一性。但蛋白质易受环境影响而变性失活[1-3],其在工业上未能得到广泛应用。为了克服游离酶在应用上的诸多限制(如稳定性低、易受抑制及回收困难等),固定化酶技术应运而生[4-6]。传统酶固定化的方法有交联法、共价键法、吸附法和包埋法。近年来新型的复合物固定化技术受到了越来越多的关注,Ge 等[7]在2012 年首次提出采用有机-无机复合物对酶进行固定化,采用这种固定化方法,酶的稳定性、操作简易性和重复利用性有了很大的提高。Cui 等[8]用磷酸铜共沉淀牛胰腺脂肪酶,然后加入表面活性剂活化牛胰腺脂肪酶,其活性相比于未经活化的牛胰腺脂肪酶提高了460%。
金属有机骨架(MOF)具有超高的比表面积和稳定性,因而在化学催化、气体分离、药物输送等方面有极大的发展潜力[9]。MOF 是由金属离子通过配位键连接有机配体组成,金属离子和有机配体的连接可以形成众多的几何形状,因此可以根据功能需要设计和定制MOF 的结构[10]。沸石咪唑酸骨架(ZIF)是MOF 家族的一类,由于其出色的比表面积、热稳定性,以及合成条件温和简单、成本低等优点而被广泛研究[11-15]。ZIF 是由金属离子和2-甲基咪唑通过自组装形成的[16-18]。Liang 等[19]通过仿生矿化,将酶、蛋白质和脱氧核糖核酸(DNA)等生物大分子包埋进ZIF-8,由此提高了它们的稳定性以及重复利用性。Campbell 等[20]提出用ZIF-8 固定化脲酶,固化后的脲酶具有更好的温度耐受范围和稳定性。然而,合成条件对ZIF-8 固定化蛋白质有较大的影响,本研究将以牛血清蛋白(BSA)为模板蛋白,着力探究不同合成条件对ZIF-8 固定BSA(BSA@ZIF-8)固化物性质的影响,并采用扫描电镜(SEM)、傅里叶变换红外光谱(FT-IR)、X 射线衍射仪(XRD)、激光粒度仪、物理吸附仪和热重分析等表征手段对制备出的复合物进行表征。
1 实验部分
1.1 ZIF-8 固定化BSA 的制备
按一定物质的量比将乙酸锌、2-甲基咪唑(HmIm)和H2O(Zn:HmIm:H2O)配置成混合溶液,于25 ℃下静置24 h,此时烧杯底部有白色沉淀生成,在7 000 r/min 下离心10 min 后去除上清液,沉淀物用去离子水洗涤三次,用冷冻干燥机干燥得到ZIF-8-1,ZIF-8-2,ZIF-8-3,ZIF-8-4(Zn:HmIm:H2O分别为1:20:450,1:20:890,1:20:2 228,1:40:2 228)。
将1 mg/mL 的BSA 溶液(50 mmol/L,一定pH 值的Tris-HCl 为缓冲溶液)加入上述乙酸锌和HmIm 混合溶液,在设定温度下固化一定时间,离心洗涤冻干后得到BSA@ZIF-8 复合物样品。计算其中BSA 的包埋率(α,掺入复合物中BSA 质量占合成时加入BSA 总质量的百分比)和负载率(β,复合物中包埋的BSA 占整个复合物质量的百分比)。
1.2 样品的表征
将冷冻干燥后的ZIF-8 以及BSA@ZIF-8 样品喷金处理后在5.0 kV 电压下进行SEM(JSM-5900,德国蔡司)检测,观察它们的表面形态。采用NEXUSFTTR670 型红外光谱仪(IS-50,美国赛默飞世尔)测定样品的FT-IR,溴化钾压片法。XRD 检测(MAX2500,日本岛津公司)采用Cu-Kα辐射,波长(λ)为0.154 18 nm,外加电压为40 kV,电流为30 mA,扫描2θ为7°~50°。使用马尔文ZS-90纳米粒度仪测定ZIF-8 及复合物粒径分布。采用考马斯亮蓝法测定蛋白含量:取待测蛋白溶液1.0 mL置于10 mL 的试管中,加入5.0 mL 考马斯亮蓝溶液并震荡,反应5 min 后在595 nm 的波长下进行吸光度的测定。
2 结果和讨论
2.1 X 射线衍射
样品的XRD 表征结果见图1。由图1 可知,BSA@ZIF-8-4 的特征峰与ZIF-8-4 的特征峰非常相似,BSA@ZIF-8-4 复合物几乎保留了ZIF-8-4 的所有特征峰,说明加入BSA 以后依然形成了ZIF-8晶体。

图1 ZIF-8-4 以及BSA@ZIF-8-4 的XRD 图谱Fig.1 XRD spectra of ZIF-8-4 and BSA@ZIF-8-4
2.2 傅里叶红外光谱
图2 所示为样品的FT-IR 图谱。由BSA 图谱可见,1 649 cm-1处有一个吸收峰,其与酰胺I带在1 640~1 660 cm-1处的特征峰相吻合(主要来自C=O 伸缩振动),1 557 cm-1处的吸收峰则对应酰胺Ⅱ带在1 510~1 560 cm-1处的特征峰(主要来自C—N 伸缩振动及N—H 弯曲振动)。在ZIF-8-4 的FT-IR图谱上并未出现上述特征峰,而BSA@ZIF-8-4 复合物图谱中则出现了与BSA 相同的特征峰,证明BSA 已成功包埋于复合物内。
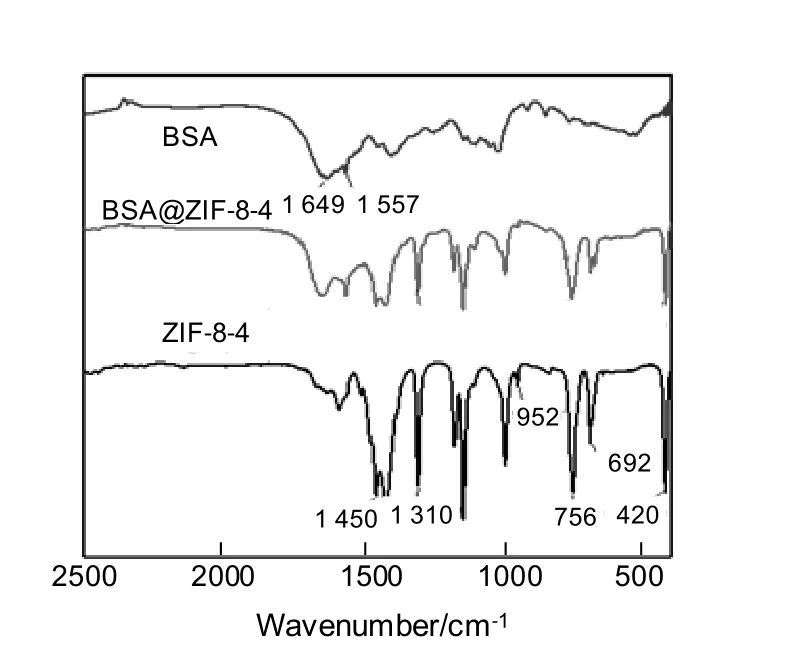
图2 ZIF-8-4,BSA@ZIF-8-4 和BSA 的傅里叶红外光谱Fig.2 FT-IR spectra of ZIF-8-4, BSA@ZIF-8-4 and BSA
ZIF-8-4 谱图中420 cm-1处的吸收峰为ZIF-8 独特的Zn—N 伸缩振动,692 cm-1及756 cm-1处的强烈吸收峰则属于咪唑环平面外弯曲振动,952 cm-1及1 310 cm-1处的吸收峰则为咪唑环平面内弯曲振动,1 450 cm-1处的强烈吸收峰为2-甲基咪唑甲基的弯曲振动。以上诸特征峰在BSA 的红外图谱中皆未体现,而在复合物谱图中出现了相应的特征峰,证明成功形成了ZIF-8 骨架。
2.3 热重分析
样品的热重分析结果见图3。由图3 可知,对于ZIF-8-4,在温度升至100 ℃后开始有质量损失,此时15.57%的质量损失为ZIF-8-4 晶体中所含的结合水,当温度升至 600 ℃后质量迅速损失,此时ZIF-8-4 开始分解。说明低于600 ℃时ZIF-8-4 有良好的热稳定性。由BSA@ZIF-8-4 的热重分析结果可知,样品在加热过程中也只有两个失重台阶。温度从100 ℃升至200 ℃的过程中,BSA@ZIF-8-4 复合物的质量损失为28.67%,与ZIF-8-4 相比多出13.10%的质量损失为包埋的BSA 及BSA 所带结合水。测量得知BSA@ZIF-8-4 中BSA 负载率约为3%(见表1),因此剩余约25%的质量损失均为结合水。当温度升至600 ℃后的质量损失仍为ZIF-8 骨架的降解。

表1 不同配比BSA@ZIF-8 的BSA 包埋率和负载率Table 1 Embedding ratios and loading ratios of BAS in BSA@ZIF-8 with different material ratios

图3 ZIF-8-4 和BSA@ZIF-8-4 热重分析结果Fig.3 Thermogravimetric analysis results of ZIF-8-4 and BSA@ZIF-8-4
2.4 粒径分析
Zn:HmIm:H2O 不同时制得的ZIF-8 和BSA@ZIF-8(恒定温度为25 ℃,反应时间为24 h,pH 值为7.4)的粒径分布见图4。由图4 可以看出,当ZIF-8 包埋入BSA 后,其颗粒粒径普遍增大,复合物的粒径普遍在100 nm 以上,但未超过1 000 nm,说明其晶体的生长存在一定的限制。

图4 不同Zn:HmIm:H2O 时制备的ZIF-8 以及BSA@ZIF-8 的粒径分布Fig.4 Particle size distributions of ZIF-8 and BSA@ZIF-8 synthesized for different Zn:HmIm:H2O
图5 为不同条件(pH,反应时间,温度)下制备的BSA@ZIF-8-3 的粒径分布。由图5(a)可见,4℃下制备的复合物的粒径分布更集中且平均粒径比25 ℃下的稍大,这可能是由于低温下晶体的生长速率较低、生长较均一;而40 ℃下晶体的生长速率较快但生长并不均一,导致其粒径较为分散。由图5(b)可知,合成时间为24 h 与72 h 时得到的复合物的粒径分布几乎一致,且均比合成时间为2h 时样品的要大,这说明当合成时间为2 h 时复合物晶体还在继续生长,时间达24 h 时已停止生长。由图5(c)可知,当pH 为中性(pH=7.4)时得到的复合物粒径稍小,这可能是因为酸性或碱性溶液中蛋白表面会带较多的正、负电荷,有利于复合物的形成。

图5 不同条件下制备的BSA@ZIF-8-3 的粒径分布Fig.5 Particle size distributions of BSA@ZIF-8-3 synthesized under different conditions
2.5 扫描电镜
不同配比的ZIF-8 以及对应复合物的扫描电镜照片见图6。由图6 可见,当Zn:HmIm:H2O 为1:20:450 时,合成的ZIF-8-1 颗粒轮廓较为模糊,当水的比例增大至2 228 时(ZIF-8-3),则呈现非常规则的正十二面菱形结构,而在此基础上再增加2-甲基咪唑的量(ZIF-8-4),则反而会导致结构出现缺陷。对应的BSA@ZIF-8 复合物(如图6E~图6H 所示)基本体现了相应的ZIF-8 结构但其表面十分粗糙,这可能是由于合成过程是以BSA 为内核的外延生长,从而导致生长不均一,晶体表面粗糙。

图6 不同配比的ZIF-8 以及对应BSA@ZIF-8 的SEM 图片Fig.6 SEM images of ZIF-8 with different material ratios and corresponding BSA@ZIF-8 BSA@ZIF-8: 25 ℃, 24 h, pH=7.4
2.6 复合物中BAS 的包埋率和负载率
不同配比ZIF-8 在固化温度为25 ℃,固化时间为24 h,缓冲溶液pH 值为7.4 的条件下制得了BSA@ZIF-8 复合物,其中BAS 的包埋率和负载率见表1。由表1 可知,当水的比例由450 增加至2 228时,BSA 的包埋率和负载率均有明显增加,而将2-甲基咪唑比例增加后,包埋率和负载率均有下降,说明2-甲基咪唑浓度的增加不利于BSA 的包埋和负载。
在不同固化温度、不同固化时间以及不同pH 缓冲溶液的条件下由ZIF-8-3 制备的BSA@ZIF-8-3中BSA 的包埋率和负载率见表2。如表2 所示,固定化温度对BSA 包埋率和负载率的影响较大,40 ℃下合成样品的BSA 负载率约为25 ℃下合成样品的一半,而包埋率却未有显著降低,说明较高的温度有利于ZIF-8 的生长,导致其晶体质量较大,负载率较低,图5(a)也印证了这一点。对比不同固化时间得到的样品的BSA 包埋率和负载率发现,从2 h 到24 h 有显著增加,而72 h 时有显著下降,说明在2~24 h 的固定化过程中复合物有一定生长,而24 h 以后部分复合物可能发生重构,一部分BSA重新溶解,从而导致其尺寸不变[见图5(b)]的情况下BSA 包埋率与负载率均降低。中性条件(pH=7.4)下得到复合物样品的BSA 包埋率和负载率明显更大,与图5(c)相结合分析可知,中性环境有利于BSA 的包埋,而酸性与碱性环境则有利于ZIF-8 晶体的生长。

表2 不同条件下得到的BSA@ZIF-8-3 的BSA 包埋率和负载率Table 2 Embedding ratios and loading ratios of BAS in BSA@ZIF-8-3 prepared under different conditions
3 结 论
本研究通过FT-IR、SEM、TGA 和激光粒度计对不同合成条件下制备的BSA@ZIF-8 复合物进行了表征分析。发现原料配比中2-甲基咪唑的浓度越高,BSA@ZIF-8 复合物中的BSA 负载率和包埋率越低,较高的固定化温度有利于ZIF-8 晶体的生成,从而导致较大的粒径和较低的BSA 包埋率和负载率,固定化时间在2~24 h 仍有生长,BSA@ZIF-8 复合物粒度与其中的BSA 负载率和包埋率均有显著增长,而24 h 以后一部分BSA 反而会重新溶解,中性固定化环境下有利于BSA 的包埋,而酸或碱性环境有利于ZIF-8 的生长。本工作对模板蛋白的研究结果可为其他酶的包埋研究提供一些参考。
