miR-146a调控铁死亡过程对甲状腺乳头状癌细胞增殖和转移的调控作用
2024-01-12苏鹏程
龚 烨, 王 胄, 苏鹏程
(新疆维吾尔自治区人民医院乳腺甲状腺科, 乌鲁木齐 830001)
甲状腺癌(Thyroid cancer, TC)是一种分泌癌,占所有内分泌恶性肿瘤的90%,且发病率呈上升趋势[1]。据报道,2020年在全球所有癌症的发病率中TC排名第9位,确诊病例超过58.6万例,TC在女性中的发病率是男性的3倍[2]。TC中最常见的是乳头状甲状腺癌(PTC),多数PTC患者预后情况较好,10年生存率较为理想[3],但有5%~20%的PTC患者预后有甲状腺外侵犯、血管侵犯或远处转移,预后情况相对较差,5年生存率为25%,10年生存率为10%,是PTC患者主要的死亡原因[4]。铁死亡是一种细胞死亡方式,通常由铁依赖性的氧化应激和脂质过氧化所引发,在铁死亡过程中,细胞内的铁离子被过量动员和利用,使得活性氧(ROS)和活性氮(RNS)的生成增加,这些活性分子会攻击细胞内的脂质、蛋白质和DNA,导致细胞死亡[5-6]。有研究报道,铁死亡与PTC的侵袭转移有着密切联系,抑制铁死亡可以促进PTC的进程和转移[7-8]。研究表明miRNA是调控铁死亡的关键介质,参与调节铁死亡的多个关键步骤,包括谷胱甘肽-GPX4途径、谷氨酸/胱氨酸运输、铁代谢和脂质代谢,在肿瘤的发生发展中发挥重要的作用[9-11]。微小核糖核酸-146a(miR-146a)是一种微小RNA,位于人体染色体19上,是一个内源性非编码RNA,在多种细胞生物学过程中发挥关键作用,在多种恶性肿瘤中调节肿瘤细胞增殖、分化、凋亡、耐药和脂肪代谢等生物学功能[12-13]。但关于miR-146a与铁死亡之间的调控关系有待进一步探索。本研究探究miR-146a通过影响铁死亡过程对人甲状腺癌细胞(TPC-1)细胞增殖和转移的调控作用,现报道如下。
1 材料与方法
1.1 细胞TPC-1细胞(武汉普诺赛生命科技有限公司)。
1.2 试药miR-146a激活剂(上海吉玛制药有限公司,批号:312379);miR-146a抑制剂(上海吉玛制药有限公司,批号:291742);Erastin(美国MCE公司,批号HY-15763);胎牛血清(美国Gibco公司,批号:10099-141C);胰蛋白酶-EDTA溶液(美国GIBCO公司,批号:25200072); CCK-8试剂盒(北京博奥森生物技术有限公司);结晶紫(上海碧云天生物技术有限公司);ROS试剂盒(北京索莱宝科技有限公司);Erastin(美国Med Chem Express生物科技公司);谷胱甘肽过氧化物酶4(GPX4)试剂盒、还原型谷胱甘肽(GSH)测定试剂盒(南京建成生物工程研究所有限公司提供);Cell Ferrous Iron CoLorimetric Assay Kit(武汉伊莱瑞特生物科技有限公司)。
1.3 仪器Nunc细胞培养箱(Thermo Fisher Scientific公司);DMIL LED倒置显微镜(Leica公司);StepOne PLus实时荧光定量PCR仪(AppLied Biosystems公司);ChemiDoc MP蛋白质印迹仪(Bio-Rad公司);CytoFLEX流式细胞仪(Beckman CouLter公司);MuLtiskan EX酶标仪(Thermo Fisher Scientific公司); HG220-CC6低速医用离心机(北京百万电子科技有限公司)。
1.4 方法
1.4.1 TPC-1细胞孵育及传代 将TPC-1细胞转移到含有5 mL(RPMI-1640培养基+10%FBS+1% PeniciLLin-Streptom ycin SoLution)培养基的离心管中,1 000 r/min离心5 min,收集并悬浮细胞,将细胞接种到培养皿中,于培养箱内孵化培育,温度为37℃,孵化24 h。间隔2 d更换1次培养液,当细胞融合80%时,使用0.25%胰蛋白酶-EDTA收集细胞,按1∶3传代,37 ℃培养过夜。
1.4.2 TPC-1细胞转染 取“1.4.1”项下培养的TPC-1单细胞悬液20 μL,按3.5×105个/孔接种到96孔板中,在37℃、5%CO2饱和湿度条件培养过夜。转染:分别取200 μL jetPRIME buffer,加入终浓度为30 nmoL/L mimics和60 nmoL/L inhibitor;再加入4 μL jetPRIME reagent,孵育10 min。取上述混合物200 μL分别加入细胞培养液中,6 h后换新鲜培养基,在37℃、5%CO2培养24 h;inhibitor转染组换液后,实验组加入铁死亡激动剂,空白组加入等体积的PBS。转染48 h后进行后续检测。分组方法:Control组(未进行任何处理)、miR-146a mimics NC组(进行非特异性对照miR-146a模拟物处理)、miR-146a mimics组(miR-146a模拟物处理)、inhibitor NC组(非特异性对照的miR-146a抑制剂处理)、miR-146a inhibitor组(miR-146a抑制剂处理)、miR-146a inhibitor+Erastin(10 μmoL/L)组(miR-146a抑制剂和Erastin处理),共6组。
1.4.3 CCK8检测细胞增殖活性 将“1.4.2”项下各组细胞于37℃培养24 h,每孔加入10 μL CCK-8溶液,继续培养4 h后,酶标仪测定各孔450 nm处OD值。
1.4.4 Transwell实验 将“1.4.2”项下各组细胞消化、收集、离心、重悬,细胞计数板计数备用。将Matrigel用缓冲液或溶剂稀释至1 mg/mL,将稀释后的Matrigel加入到Transwell小室上,使用移液管或滴管将Matrigel滴加到小室中进行凝胶处理,将小室放置在培养箱中,让Matrigel在小室中干燥,保持适宜温度和湿度,以确保细胞生长。凝胶处理完成后,加入200 μL悬液到每个小室中,将小室放置在恒温摇床或培养箱中,培养24 h,用戊二醛对细胞进行固定、苏木精染色,在显微镜(×400倍)下观察。
1.4.5 细胞划痕实验 使用marker笔在6孔板背后均匀的划横线,横穿过孔,每孔至少穿过5条线;取经过转染的细胞,0.25%胰酶分别消化计数约为5×105个,接种于6孔板,37℃、5%CO2饱和湿度条件培养24 h;待细胞密度达到80%左右,铺满6孔板底部,用枪头划痕,加入无血清培养基,同时拍取0 h照片;放入37℃、5%CO2培养箱培养24 h后,拍照。
1.4.6 各组细胞中亚铁离子、谷胱甘肽(Glutathione,r-glutamyl cysteingl+glycine,GSH)、谷胱甘肽过氧化物酶4(Glutathione Peroxidase 4,GPX4)的表达 取“1.4.2”项下各组细胞,按照检测试剂盒说明书测定亚铁离子、GSH、GPX4水平。
1.4.7 ROS表达水平的测定 用无血清培养基按照1∶1 000稀释DCFH-DA,使其终浓度为10 μmoL/L;收集TPC-1细胞,1 000 r/min离心5 min,弃去上清液,细胞沉淀重悬于适量的DCFH-DA中,在细胞培养箱中37℃孵育5 min,混匀,使探针和细胞充分接触,孵育结束,用无血清的培养基洗涤细胞3次,加入500 μL缓冲液,检测ROS表达水平。
1.5 统计学处理采用SPSS 25.0软件进行统计分析,对计量资料进行单因素方差分析,两两比较采用LSD法,检验水准α=0.05。
2 结果
2.1 miR-146a对TPC-1细胞增殖活性的影响miR-146a mimics组TPC-1细胞增殖活性为(84.77±3.71)%,细胞增殖活性最低,差异有统计学意义(P<0.05);miR-146a inhibitor组TPC-1细胞增殖活性为(119.20±5.81)%,细胞增殖活性最高,差异有统计学意义(P<0.05),见表1。
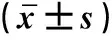
表1 miR-146a对TPC-1细胞增殖活性的影响
2.2 miR-146a对TPC-1细胞迁移和侵袭能力的影响miR-146a mimics组TPC-1细胞迁移距离为(18.33±3.79)%,细胞侵袭能力为(41.61±4.34)%,细胞迁移和侵袭能力最低,差异有统计学意义(P<0.05)。miR-146a inhibitor组TPC-1细胞迁移距离为(61.67±1.53)%,细胞侵袭能力为(172.26±9.98)%,细胞迁移和侵袭能力最高,差异有统计学意义(P<0.05),见表2,图1、2。

图1 miR-146a调控TPC-1细胞的迁移图
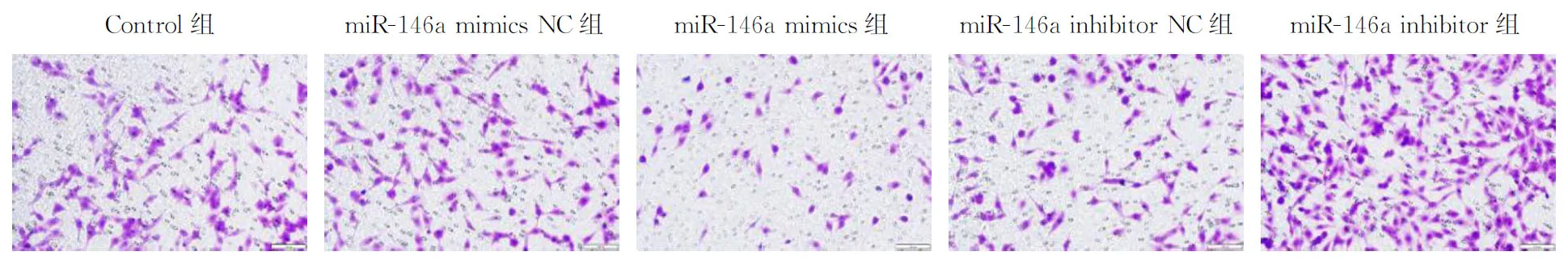
图2 miR-146a调控TPC-1 细胞的侵袭图
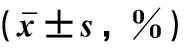
表2 miR-146a对TPC-1细胞迁移和侵袭的影响
2.3 miR-146a对TPC-1细胞发生铁死亡的影响miR-146a mimics组Fe2+和ROS水平最高,GPX4和GSH的水平最低,差异有统计学意义(P<0.05)。miR-146a inhibitor组Fe2+和ROS水平均最低,GPX4和GSH水平最高,差异有统计学意义(P<0.05),见表3、图3。
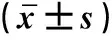
表3 miR-146a对TPC-1细胞发生铁死亡的影响
2.4 Erastin对TPC-1细胞增殖活性的影响与Control组比较,miR-146a inhibitor组和miR-146a inhibitor+Erastin组TPC-1细胞增殖活性均增大,差异有统计学意义(P<0.05)。与miR-146a inhibitor组比较,miR-146a inhibitor+Erastin组TPC-1细胞增殖活性减小,差异有统计学意义(P<0.05),见表4。
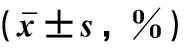
表4 Erastin对TPC-1细胞增殖活性的影响
2.5 Erastin对TPC-1细胞细胞迁移和侵袭能力的影响与Control组比较,miR-146a inhibitor组和miR-146a inhibitor+Erastin组TPC-1细胞迁移距离和侵袭能力均增大,差异有统计学意义(P<0.05)。与miR-146a inhibitor组比较,miR-146a inhibitor+Erastin组TPC-1细胞迁移距离和侵袭能力均减小,差异有统计学意义(P<0.05),见表5,图4、5。

图4 Erastin调控TPC-1细胞的迁移图
图5 Erastin调控TPC-1细胞的侵袭图
表5 Erastin对TPC-1细胞迁移和侵袭的影响
2.6 Erastin对TPC-1细胞铁死亡指标的影响与Control组比较,miR-146a inhibitor组和miR-146a inhibitor+Erastin组Fe2+和ROS的表达降低,GSH和GPX4的表达升高,差异有统计学意义(P<0.05)。与miR-146a inhibitor组比较,miR-146a inhibitor+Erastin组Fe2+和ROS的表达升高,GSH和GPX4的表达降低,差异有统计学意义(P<0.05),见表6、图6。
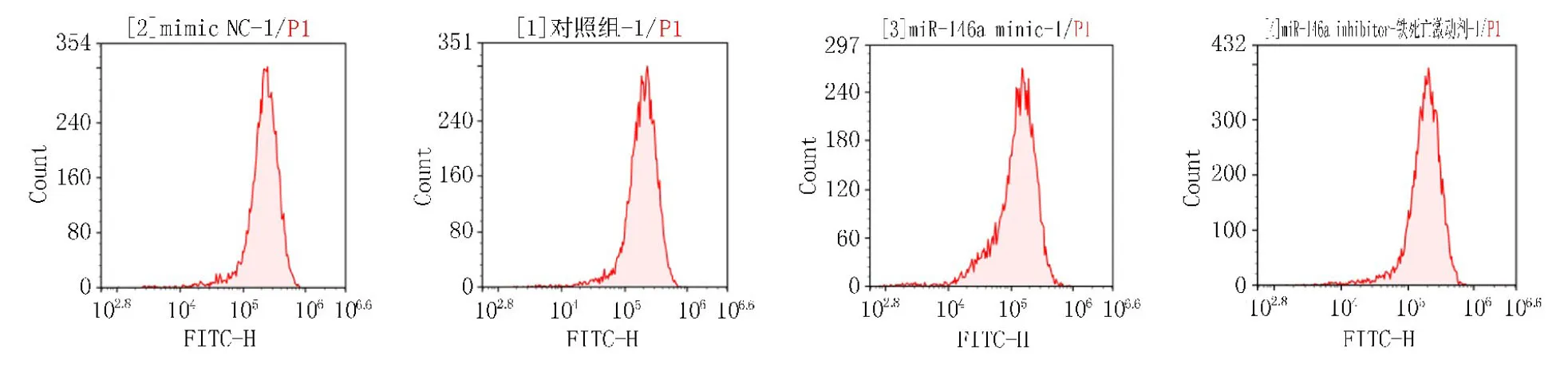
图6 Erastin调控TPC-1 细胞的ROS流式原始图
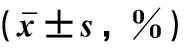
表6 Erastin对TPC-1细胞铁死亡指标的影响
3 讨论
转移是恶性肿瘤的显著特征,主要包括以下步骤:(1)原位癌变大,侵入局部血管、淋巴管,或直接扩散。(2)癌细胞随淋巴液或血液移动,在继发部位合适的转移位聚集、黏附、增殖,导致继发部位血管或淋巴管结构发生改变,通透性增加,使癌细胞能够渗透出循环系统侵入并增殖[14]。miR-146a可在多种肿瘤细胞中发生异常表达[15]。有研究报道,高表达miR-146a促进口腔癌、乳腺癌、滤泡性甲状腺癌的侵袭转移[16-18]。而高表达miR-146a-5p可抑制胃癌细胞的侵袭和增殖[19]。本研究发现,高表达miR-146a可抑制TPC-1细胞的增殖和侵袭转移能力,表明miR-146a具有调控PTC进展的效能。
铁死亡对恶性肿瘤的转移具有调节作用,主要包括对肿瘤细胞、肿瘤干细胞、免疫细胞、上皮-间充质转化、肿瘤血管生成等的调节[20]。miRNA最近被证明可通过铁死亡途径调节癌细胞的生长和发展[21-22]。miRNA的作用包括调控谷氨酸/胱氨酸转运,调节谷胱甘肽合成、铁代谢、脂质代谢调节活性氧(ROS)生成等氧化应激途径[23-25]。有研究报道,miR-545-3p可调控SLC7A11促进甲状腺癌中的铁死亡过程,miR-1231可调控GPX4诱导甲状腺乳头状癌的铁死亡过程[26]。本研究结果表明,在miR-146a inhibitor中加入铁死亡激动剂Erastin, TPC-1细胞的增殖和侵袭转移能力降低。ROS水平升高,这表明Erastin能够触发氧化应激反应,进一步促进铁死亡的发生。同时GSH和GPX4的表达水平降低,表明Erastin处理后,细胞内抗氧化系统的功能被激活,以应对氧化应激压力。
综上所述, miR-146a通过影响调控铁死亡相关指标(亚铁离子、ROS、GSH和GPX4)的表达水平,达到调控TPC-1细胞的增殖和转移进程。
