DYRK1A调控NLRP3激活在帕金森病模型中的研究
2024-01-12杨新玲
蔡 倩, 夏 欢, 罗 琴, 杨新玲
(1新疆医科大学附属肿瘤医院, 乌鲁木齐 830011; 2新疆神经系统疾病研究重点实验室, 乌鲁木齐 830063; 3新疆医科大学, 乌鲁木齐 830017)
帕金森病(Parkinson′s Disease,PD)是老年人中第二大常见的神经退行性疾病。据估计,PD占65岁以上人口的2%~3%,这给家庭和社会造成了巨大的负担[1]。尽管尚未阐明PD的确切机制,但越来越多的证据表明,小胶质细胞介导的神经炎症是大脑老化和包括PD在内的大多数神经退行性疾病的共同特征[2-3]。小胶质细胞是中枢神经系统(Central nervous system,CNS)的先天免疫细胞,在维持大脑稳态方面发挥着重要作用[4]。然而,小胶质细胞的持续过度激活会诱发慢性神经炎症反应,在帕金森病(PD)的神经炎症和神经变性中起着至关重要的作用,其中小胶质细胞富含的NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体可能作为PD治疗的潜在靶点[5]。NLRP3是其中核心蛋白之一,它的激活启动炎症小体的形成。
双特异性酪氨酸调控激酶1A(Dual specificity tyrosine-regulated kinase1a,DYRK1A)是一种蛋白激酶,在中脑黑质、纹状体及海马中表达丰富,对中脑多巴胺(Dopamine,DA)神经元发育及其生理功能至关重要。全基因组关联研究(GWAS)的荟萃分析显示DYRK1A是PD的一个危险因素[6]。本研究拟分析DYRK1A在帕金森病神经炎症中的作用,在MPP+(1-methyl-4-phenylpyridinium,1-甲基-4-苯基吡啶离子)/MPTP(1-甲基-4-苯基-1,2,3,6-四氢吡啶)诱导的PD细胞及动物模型上分析DYRK1A与NLRP3蛋白的关系,探讨可能的机制,为帕金森病的发病机制提供研究依据。
1 材料与方法
1.1 材料
1.1.1 细胞及实验动物 实验所用BV2细胞(小鼠小胶质细胞)购自上海雅吉生物科技有限公司。6~8周龄的雄性C57BL/6小鼠采购于广东药康生物科技有限公司,体重(20±1.24)g,共40只。所有的实验操作流程均符合中国动物研究协会规定,遵从伦理委员会的动物实验伦理要求。
1.1.2 试剂 MPP+(美国Sigma公司)、MPTP(美国Sigma公司)、Harmine(美国Abcam公司)、兔抗NLRP3(ABclonal)、小鼠抗Dyrk1a(美国Santa cruz公司)、小鼠抗β-actin(美国Santa cruz公司)、Alexa Fluor 555山羊抗小鼠二抗(美国Cell Signaling Technology公司)、Alexa Fluor 488山羊抗兔二抗(美国Cell Signaling Technology公司)、HRP标记的抗兔二抗(美国Thermo Scientific公司)、HRP标记的抗小鼠二抗(美国Thermo Scientific公司)。
1.1.3 主要仪器 细胞培养箱(美国Thermo Scientific公司)、全波长酶标仪(美国Thermo Scientific公司)、化学发光成像仪(英国Syngene公司)、正置荧光显微镜(日本Olympus公司)、台式低速离心机(上海卢湘仪离心机仪器有限公司)等。
1.2 方法
1.2.1 DYRK1A抑制剂Harmine处理PD细胞模型 培养BV2细胞,培养条件如下:37℃、5%CO2、高糖DMEM(Invitrogen,Carlsbad,CA,USA)和5%胎牛血清(FBS,Invitrogen)。提前24 h将BV2细胞接种于10 cm细胞培养皿中,约1×106个/皿,密度达80%~90%后,将配好的MPP+母液(10 mmol/L)解冻后,用完全培养基稀释为不同浓度(MPP+为0、50、75、100和125 μmol/L)处理BV2细胞,培养24 h后收集细胞做后续实验。选不同浓度的Harmine(0、5、10和15 μmol/L)处理BV2细胞(同时加入MPP+或者不加入MPP+)。
1.2.2 DYRK1A抑制剂Harmine处理PD慢性动物模型 40只雄性C57BL/6小鼠随机分为5组[7],分别为对照组(DMSO组)、模型组(DMSO+MPTP组)、模型低浓度抑制剂(10 mg/kg)组(DMSO+H1+MPTP组)、模型中浓度抑制剂(20 mg/kg)组(DMSO+H2+MPTP 组)、模型高浓度抑制剂(30 mg/kg)组(DMSO+H3+MPTP 组),每组8只。除对照组外,剩余4组小鼠给予腹腔注射MPTP,25 mg/kg,每周2次,连续注射5周构建PD慢性动物模型[8]。3组抑制剂组还需间隔给予腹腔注射低、中、高浓度的Harmine,共5周。
1.2.3 CCK8法检测细胞活性 细胞计数后,计算所铺细胞的孔的数量,在96孔板中每孔加入100 μL含有4 000个细胞的细胞悬液,在细胞培养箱中培养24 h;分别加入不同浓度MPP+,每个浓度设置3个复孔,细胞培养箱孵育24 h;每孔加入10 μL CCK8溶液,避光,在细胞培养箱内继续孵育2 h;在酶标仪上测定吸光度,波长为450 nm。吸光度值减去培养基的阴性对照即为相应的OD值,统计分析各个浓度的OD值。
1.2.4 免疫印迹 BV2小胶质细胞在裂解液中裂解,12 000 r/min离心15 min。参考BSA标准溶液定量上清液中的蛋白质浓度。将10 μg蛋白质上样到10% SDS凝胶上进行电泳分离,并转移到聚偏二氟乙烯(PVDF)膜上。膜在室温下用5%脱脂牛奶封闭1 h,然后在4℃下与一抗(鼠抗Dyrk1a,1∶500;兔抗NLRP3,1∶500)摇床过夜。最后,将膜与二抗(抗小鼠二抗1∶5 000;抗兔二抗1∶5 000)孵育2 h,加用ECL发光液,在化学发光成像仪下检测,获取和分析图像。
1.2.5 免疫组织荧光染色 取出冰冻切片,置于室温复温,将所需脑片贴在载玻片上,做好标记,晾干;置于37℃恒温箱内烘干;PBS水化,倒出PBS,将脑片浸泡在枸橼酸修复液中,微波炉修复;梯度冷却,PBS洗3次,0.3%Triton X-100破膜,PBS洗3次;脑片上滴加即用型山羊血清封闭液,室温封闭1 h;弃去封闭液,加一抗(小鼠抗GFAP,1∶1 000;兔抗IBA1,1∶1 000),4℃过夜;第二日,室温复温,PBS清洗3次;加荧光二抗(Alexa Fluor 555山羊抗小鼠二抗,Alexa Fluor 488山羊抗兔二抗,均为1∶1 000),室温避光孵育1 h;PBS洗3次;在脑片上滴加含DAPI的封片剂,将盖玻片盖在脑片上,正置荧光显微镜下避光观察拍照。
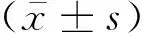
2 结果
2.1 不同浓度MPP+处理BV2细胞后DYRK1A及NLRP3蛋白的表达当MPP+浓度分别为50、75和100 μmol/L时,NLRP3蛋白表达水平较MPP+浓度为0时明显增高,差异有统计学意义(P<0.05);当MPP+浓度分别为50、75和125 μmol/L时,DYRK1A蛋白表达水平较MPP+浓度为0时明显增高,差异有统计学意义(P<0.05)(图1)。
注: (A-C)不同浓度的MPP+处理BV2细胞24 h后, WB检测DYRK1A及NLRP3蛋白表达; 与0 μmol/L MPP+相比, *P<0.05, **P<0.01, ***P<0.001。图1 不同浓度MPP+处理BV2细胞后DYRK1A及NLRP3蛋白的表达
2.2 抑制DYRK1A后可减轻MPP+对BV2的损伤及NLRP3的激活
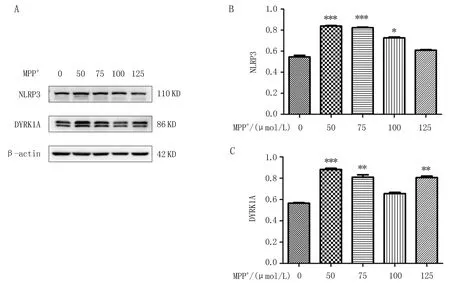
2.2.1 DYRK1A抑制剂改善MPP+损伤的BV2细胞活性 选用MPP+50 μmol/L的浓度干预BV2细胞24 h,产生毒性作用,细胞的活性下降;同时分别以0、5、10、15 μmol/L不同浓度的DYRK1A抑制剂(Harmine)处理24 h后,相比MPP+组,Harmine+MPP+组BV2细胞的活性增加,其中浓度为10、15 μmol/L时,分别为74%、78%,有统计学差异(P<0.05)(图2A)。相比MPP+组,Harmine+MPP+组细胞培养基随着Harmine浓度的升高,由黄色逐渐变为红色(图2B)。
注:(A)不同浓度的Harmine处理MPP+干预的BV2细胞24 h后,随着Harmine浓度的升高,BV2细胞活性呈浓度依赖性升高;(B)不同浓度Harmine处理MPP+干预的BV2细胞24 h,培养基颜色的变化情况,与MPP+组比较, ***P<0.001。图2 不同浓度Harmine对MPP+损伤的BV2细胞活性的影响
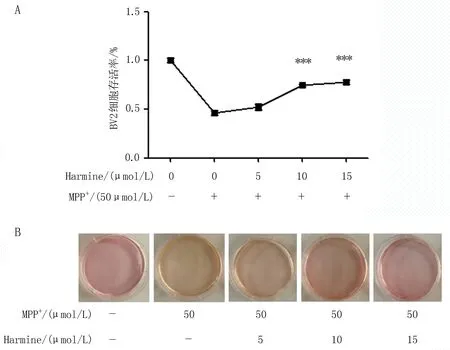
2.2.2 抑制DYRK1A后可减轻MPP+诱发的NLRP3激活 与0 μmol/L MPP+比较,50 μmol/L MPP+处理小胶质细胞后,NLRP3蛋白表达水平增加;选用10 μmol/L浓度的DYRK1A抑制剂(Harmine)及50 μmol/L的MPP+同时处理小胶质细胞时,NLRP3蛋白的表达水平降低,差异有统计学意义(P<0.05),提示DYRK1A抑制剂可减轻MPP+诱发的NLRP3蛋白激活(图3)。
注:(A-B)使用DYRK1A抑制剂处理MPP+诱导的小胶质细胞,分为对照MPP+(0 μmol/L)组(0)、MPP+(50 μmol/L)组(M)、Harmine(10 μmol/L)组(H)、Harmine(10 μmol/L)+MPP+(50 μmol/L)组(H+M),WB检测NLRP3蛋白的表达;与MPP+(50 μmol/L)组(M)比较, **P<0.01。图3 DYRK1A抑制剂处理MPP+诱导的小胶质细胞中NLRP3蛋白的表达
2.3 DYRK1A抑制剂可减少MPTP慢性PD小鼠模型中脑黑质的小胶质细胞数量免疫组织荧光结果显示,与对照组(DMSO组)相比,模型组(DMSO+MPTP组)小鼠中脑黑质的小胶质细胞数量增多;与模型组(DMSO+MPTP组)相比,模型中浓度抑制剂(20 mg/kg)组(DMSO+H2+MPTP组)小鼠中脑黑质的小胶质细胞数量减少(图4)。
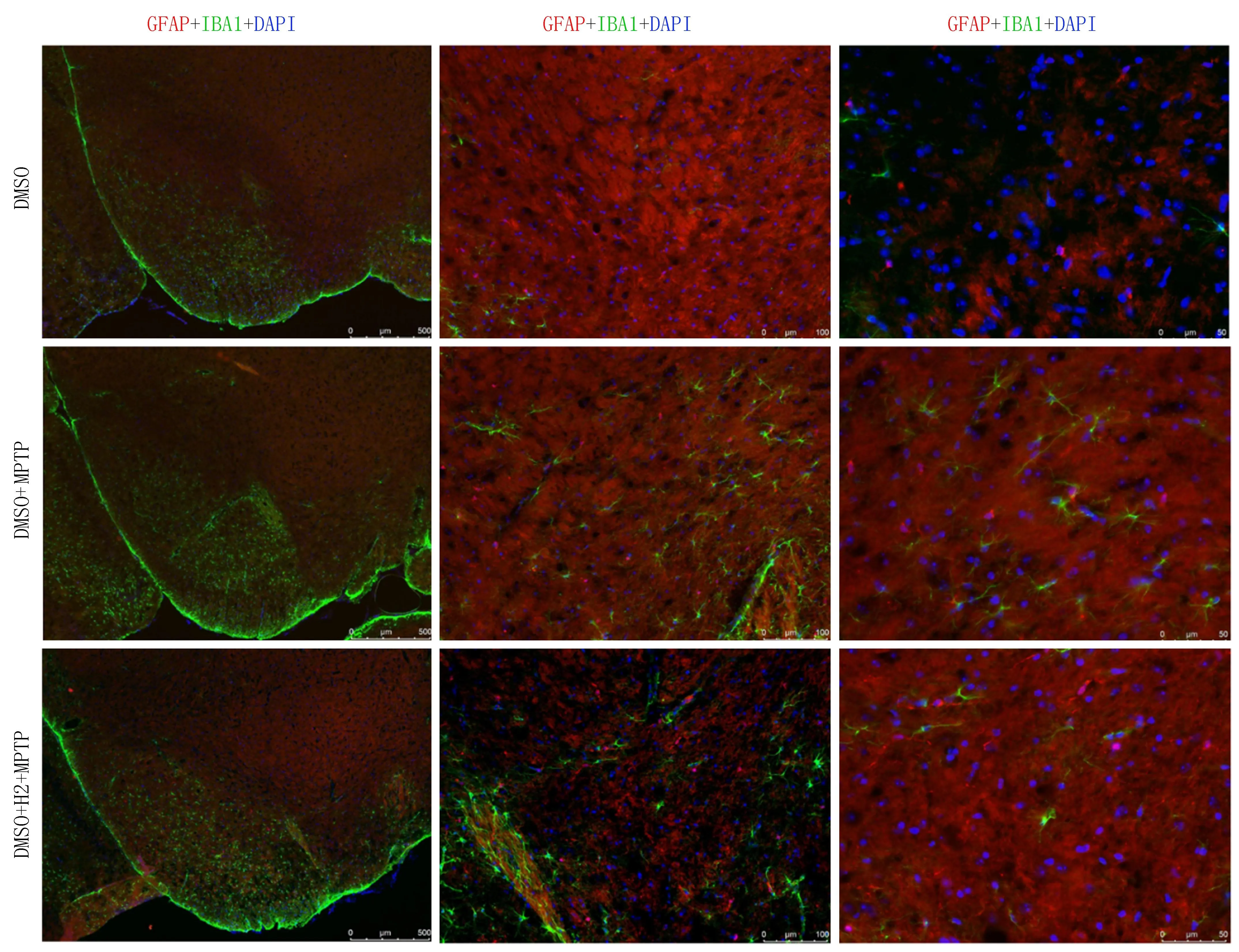
注:从左到右,标尺依次为500 μm、 100 μm、 50 μm, n=3。图4 各组小鼠黑质区小胶质细胞数量比较
2.4 抑制DYRK1A后可减轻MPTP小鼠中脑黑质区NLRP3的激活与对照组(DMSO组)比较,模型组(DMSO+MPTP组)小鼠中脑黑质中的NLRP3蛋白表达明显升高;与模型组(DMSO+MPTP组)比较,不同浓度抑制剂组小鼠中脑黑质中NLRP3蛋白表达均有下降。其中,模型中浓度及高浓度抑制剂组(DMSO+H2+MPTP、DMSO+H3+MPTP)下降明显(P<0.05)(图5)。与MPP+诱导的PD细胞模型中DYRK1A蛋白升高结果一致。
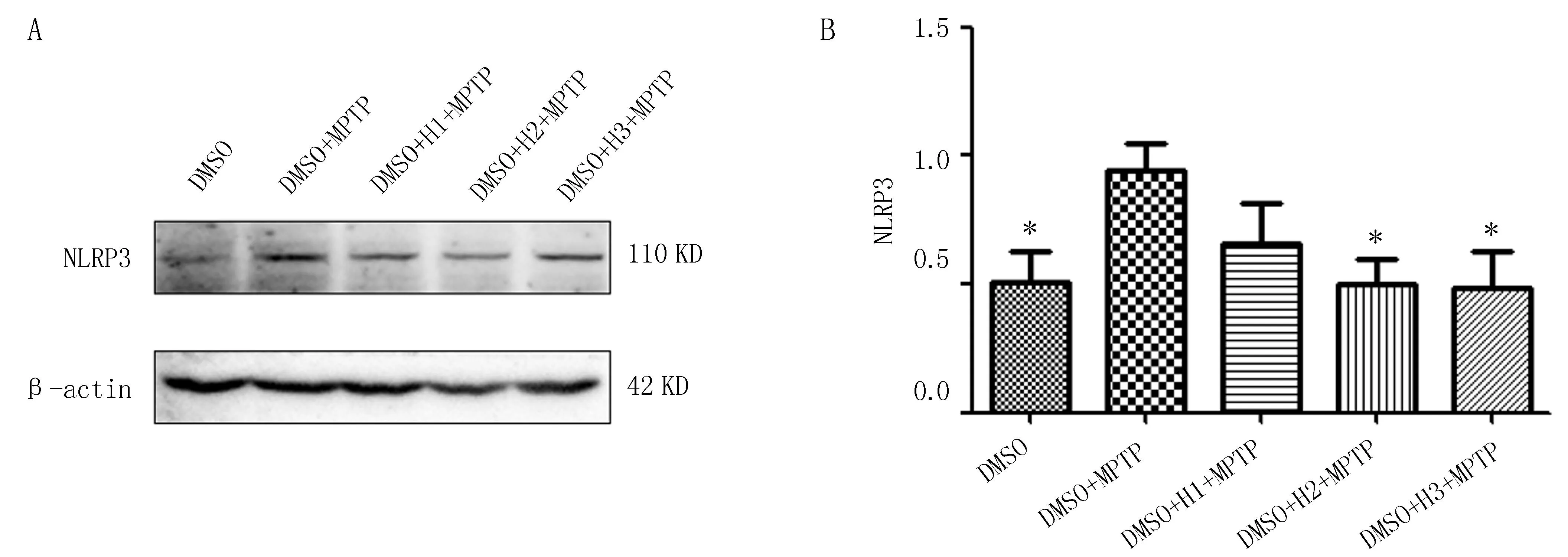
注:(A-B)使用不同浓度DYRK1A抑制剂处理MPTP小鼠模型,WB检测NLRP3蛋白的表达;与DMSO+MPTP组比较, *P<0.05, n=5。图5 DYRK1A抑制剂处理MPTP小鼠中脑黑质区NLRP3蛋白的表达
3 讨论
神经炎症是导致PD发生和发展的关键因素之一[9],研究表明小胶质细胞介导的神经炎症在帕金森病的致病过程中起着关键作用[10-11]。作为大脑的主要免疫细胞,小胶质细胞是神经炎症过程中的主要细胞介质,它的激活在神经退行性过程中至关重要[12-13]。其中小胶质细胞NLRP3炎性小体的激活和小胶质细胞释放促炎细胞因子可促进PD进展,受损的DA神经元可直接导致小胶质细胞激活,产生大量促炎细胞因子(IL-1β、IL-18)[14],而持续存在的小胶质细胞介导的神经炎症又可导致帕金森病(PD)中多巴胺能(DA)神经元的进行性丢失。
小胶质细胞NLRP3可能是神经炎症的持续来源,可以推动DA神经元病理学进行性改变,成为PD疾病缓解治疗的一个潜在靶点[15]。本研究在使用MPP+处理小胶质细胞后发现NLRP3蛋白升高,其中在50 μmol/L浓度时升高最明显,提示神经毒素MPP+在启动NLRP3激活中可能有作用。与本研究一致的观点,Lee等[11]的研究显示,在原代小胶质细胞和混合神经胶质细胞培养物中,MPTP/ATP处理通过产生线粒体活性氧促进NLRP3炎性体的稳健组装和激活。MPP+在小鼠骨髓来源的巨噬细胞中,在ATP或尼日利亚菌素处理存在的情况下诱导NLRP3炎性体激活。Qiao等[16]的研究显示,下调NLRP3蛋白表达并抑制小鼠肝脏中NLRP3炎性体的激活,减轻了MPTP触发的小胶质细胞激活和中脑DA神经元丢失[16]。目前已有不少使用该靶点进行相关药物研究的报道[17-19]。
DYRK1A是一种参与神经细胞增殖和细胞死亡的多效性激酶,在调节大脑生理功能和病理过程中起着关键作用。本课题组既往研究发现不同认知功能障碍的帕金森病患者血浆DYRK1A水平有差异,提示血浆DYRK1A水平可能与帕金森病患者的认知功能有关[20]。本研究在细胞模型上发现DYRK1A与NLRP3炎症小体有关。在MPP+处理小胶质细胞后,DYRK1A与NLRP3蛋白表达水平均有所升高;使用DYRK1A抑制剂Harmine后,NLRP3蛋白下调。考虑抑制DYRK1A可减轻MPP+诱导的帕金森病模型中NLRP3炎症小体激活,从而减少神经元丢失,起到神经保护作用。相似的研究,Ju等[21]的研究结果显示,脂多糖(LPS)诱导的永生化小鼠BV2小胶质细胞系中,DYRK1A激酶的表达和活性均因炎症而增加;使用 Harmine或siRNA沉默抑制DYRK1A可显著减少LPS刺激的BV2细胞中促炎因子的产生。Araldi等[22]的研究显示,一种DYRK1A/B酶抑制剂,新型含氟多酚衍生物(1c)在脂多糖(LPS)诱导的炎症模型和1-甲基-4-苯基-1,2,3,6-四氢吡啶 (MPTP)帕金森病动物模型这两种体内模型中表现出优异的活性。
综上,NLRP3炎性小体激活在PD的神经炎症中起关键作用,本研究结果表明抑制DYRK1A可能抑制NLRP3的激活,为帕金森病的治疗提供靶点。然而,尽管抑制NLRP3炎症小体激活已被证明在PD模型中具有治疗作用,但这些潜在药物的安全性和有效性仍需要在PD患者的临床试验中得到证实,应该加快基础研究向临床应用的转化进程,以实现PD的新治疗策略。
