维生素D通过Nrf2/HO-1抑制铁死亡缓解6-羟基多巴胺所致PC12细胞损伤的作用机制研究
2024-01-12穆清爽李沛珊李艳霞李瑞晟杨新玲
穆清爽, 李沛珊, 李艳霞, 李瑞晟, 杨新玲
(1新疆医科大学第二附属医院干部一科, 新疆神经系统疾病研究重点实验室, 2新疆医科大学第二附属医院神经内科,3新疆医科大学第二附属医院康复科, 乌鲁木齐 830063; 4新疆医科大学, 乌鲁木齐 830017)
帕金森病(Parkinson′s disease,PD)是仅次于阿尔茨海默病的第二大神经退行性疾病,占65岁以上人口的2%~3%,主要由位于基底神经节区域黑质致密部(Substantia nigra pars compacta,SNpc)的多巴胺能神经元耗竭引起的[1-2]。遗传、老龄化、环境、营养等因素均可能与PD发生相关,但其具体发病机制尚不明确[2-3]。多巴胺前体左旋多巴是PD的主要治疗药物,但其治疗效果欠佳,不能阻止PD的恶化,甚至还伴随明显的毒副作用[4]。作为一种神经保护试剂,维生素D可通过调节神经系统钙平衡以及影响神经营养因子表达而参与神经系统的代谢,发挥其对PD患者的神经保护作用[5]。维生素D可有效改善缺血缺氧所致神经元细胞损伤,上调神经元中Nrf2和HO-1的表达,导致谷胱甘肽过氧化酶4(Glutathione peroxidase 4,GPX4)、超氧化物歧化酶(Super oxide dismutase,SOD)和谷胱甘肽(Glutathione,GSH)水平升高,丙二醛(Malondialdehyde,MDA)和活性氧(Reactive oxygen species,ROS)含量降低,从而抑制铁死亡[6]。
铁死亡(Ferroptosis)是新发现的一种铁依赖的调节性细胞死亡方式,其与核因子E2相关因子2(Nuclear factorE2 related factor 2,Nrf2)/血红素加氧酶1(Heme oxygenase1,HO-1)通路激活相关[7]。PD患者多巴胺能神经元细胞所沉积的α-突触核蛋白(α-synuclein,α-syn),可引起脂质代谢紊乱及铁死亡,暗示铁死亡与PD进展相关[8],抑制铁死亡可显著缓解多巴胺能神经元细胞损伤[9]。但PD中,维生素D是否通过调控铁死亡缓解神经元细胞损伤,报道尚少。为此,本研究拟通过6-羟基多巴胺(6-hydroxydopamine,6-OHDA)刺激PC12构建体外PD细胞模型[10],维生素D干预后,观察铁死亡及Nrf2/HO-1通路激活情况。
1 材料与方法
1.1 实验材料与仪器
1.1.1 细胞培养及主要试剂 未分化的PC12(大鼠肾上腺嗜铬细胞瘤细胞)购自于赛百慷(上海)生物技术股份有限公司(货号:iCell-r025)。胎牛血清购自于CLARK公司(货号:FB15015);RPMI 1640培养基购自于美国Gibco公司(货号:31800-089);6-OHDA(货号:HY-B1081)、1,25(OH)2D3(货号:HY-10002)、Erastin(货号:HY-15763)、ML385(货号:HY-100523)购自于美国MCE公司;丙二醛(MDA)测定试剂盒(货号:A003-1-2)、乳酸脱氢酶(LDH)试剂盒(货号:A020-2-2)、超氧化物歧化酶(SOD)测定试剂盒(货号:A001-3-2)、还原型谷胱甘肽(GSH)测定试剂盒(货号:A006-2-1)购自于南京建成生物工程研究所;一氧化氮(Nitric oxide,NO)测定试剂盒(货号:S0021S)购自于上海碧云天生物科技有限公司;细胞铁含量检测试剂盒(货号:BC5310)购自于北京索莱宝科技有限公司;RIPA裂解液(货号:LS-W-03268)、Annexin V-FITC/PI(货号:LS-H-158)试剂盒、PBS(货号:LS-P-0106)、Western blot试剂盒(货号:LS-H-128)购自于武汉灵思生物技术有限公司;Anti-Heme Oxygenase 1(货号:AF5393)、Nrf2 Antibody(货号:AF0639)、XCT Antibody(货号:DF12509)、GPX4 Antibody(货号:DF6701)、Transferrin Receptor Antibody(货号:AF5343)购自于美国affinity公司;Anti-GAPDH antibody(货号:ab8245)、Anti-Ferritin-1(货号:ab75973)购自于英国abcam公司;HRP标记的山羊抗兔IgG(货号:GB23303)购自于武汉赛维尔生物技术有限公司;SYBR Green PCR试剂盒(货号:AQ131)购自于北京全式金生物技术有限公司。
1.1.2 主要仪器 3111型CO2培养箱购自于美国Thermo公司;LC96型Real-time PCR检测仪购自于美国罗氏公司;Nano-100型微量核酸测定仪购自于杭州奥盛仪器有限公司;HBS-1096A型酶标仪购自于南京德铁实验设备有限公司。
1.2 实验方法
1.2.1 PC12细胞培养 PC12细胞复苏后,置于RPMI 1640,并添加5%胎牛血清、10%热灭活马血清和1%的青-链霉素于培养基中,培养的气相条件:空气95%,二氧化碳5%。培养温度为37℃,培养箱湿度为70%~80%。
1.2.2 PD细胞模型构建 参考文献[9-10], 利用40 μmol/L的6-羟基多巴胺(6-OHDA)处理PC12细胞24 h,构建PD模型。
1.2.3 VD干预浓度筛选 按照1.2.2构建PD模型后,利用不同浓度的1,25(OH)2D3(20 ng/mL、40 ng/mL、80 ng/mL)处理24 h。收集细胞,CCK-8检测细胞活力。利用30 mmol/L[11]的铁死亡激活剂Erastin或者5 mmol/L[12]的Nrf2抑制剂ML385分别处理PC12细胞6 h,按照1.2.2构建PD模型后,再利用不同浓度的1,25(OH)2D3(20、40、80 ng/mL)处理24 h。收集细胞,CCK-8检测细胞活力。
1.2.4 实验分组 PC12细胞随机分成:空白对照组(Control)、6-羟基多巴胺组(6-OHDA)、维生素D组(VD)、铁死亡激活剂组(Erastin)、铁死亡激活剂+维生素D组(Erastin+VD)、Nrf2抑制剂组(ML385)、Nrf2抑制剂+维生素D组(ML385+VD);其中Control组细胞正常培养不进行任何处理、6-OHDA组细胞按照1.2.2构建PD模型、VD组按照1.2.2构建PD模型后,利用1,25(OH)2D3(40 ng/mL)处理24 h、Erastin组利用30 mmol/L的Erastin处理PC12细胞6 h后,再按照1.2.2构建PD模型、Erastin+VD组利用30 mmol/L的Erastin处理PC12细胞6 h,构建PD模型,再利用1,25(OH)2D3(40 ng/mL)处理24 h、ML385组利用5 mmol/L的ML385处理PC12细胞6 h后,再按照1.2.2构建PD模型、ML385+VD组利用5 mmol/L的ML385处理PC12细胞6 h,构建PD模型,再利用1,25(OH)2D3(40 ng/mL)处理24 h。
1.2.5 CCK-8(Cell Counting Kit-8)检测 PC12细胞按照1×104个/孔接种于96孔板,按照1.2.4分组,干预结束后,每孔加入10 μL CCK-8溶液,并在37℃条件下孵育1 h。利用酶标仪测定其450 nm处的吸光度值(OD value)。
1.2.6 流式细胞术检测细胞凋亡 PC12细胞按照1×105个/孔接种于6孔板,按照1.2.4分组,干预结束后,用预冷PBS离心洗涤,收集1×105~10×105个细胞(包括培养上清中的细胞);取 500 μL 1×Binding Buffer重悬细胞;每管加入5 μL Annexin V-FITC和10 μL PI;轻柔涡旋混匀后,室温避光孵育5 min;流式细胞仪分析,在流式细胞仪上,通过FITC检测通道检测Annexin V-FITC(Ex=488 nm; Em=530 nm)和通过PI检测通道(Ex=535 nm;Em=615 nm)检测PI。
1.2.7 MDA、LDH、SOD、GSH含量检测 PC12细胞按照1×105个/孔接种于6孔板,按照1.2.4分组,干预结束后,收集上清和细胞;参考试剂盒说明书检测MDA、LDH、SOD、GSH含量。
1.2.8 铁离子含量检测 PC12细胞按照1×105个/孔接种于6孔板,按照1.2.4分组,干预结束后,收集上清和细胞;参照试剂盒说明书检测铁离子含量。
1.2.9 qRT-PCR检测 PC12细胞按照1×105个/孔接种于6孔板,按照1.2.4分组干预,干预结束后,收集细胞,TRIzon Reagent裂解提取RNA;cDNA合成试剂盒合成cDNA后,qRT-PCR检测各基因的表达,引物由生工生物工程(上海)股份有限公司合成,其序列如表1,反应程序为94℃,30 sec;(94℃,5 sec)×40个循环;61℃,35 sec。采用2-△△CT法分析目的基因的相对表达量,计算公式如下:△Ct= Ct目的基因-Ct内参,即△△Ct=△Ct样本-△Ct对照,再计算各组2-△△CT值,即为各组中基因的相对表达量。

表1 引物序列
1.2.10 Western blot检测 PC12细胞按照1×105个/孔接种于6孔板,按照1.2.4分组,干预结束后,收集细胞,加500 μL RIPA(含1 mmol/L PMSF);冰上裂解细胞,30 min;4℃ 12 000 r/min离心10 min,收集上清;BCA定量后,SDS-PAGE电泳;以兔抗HO-1抗体(1∶500)、兔抗Nrf2 抗体(1∶800)、兔抗XCT抗体(1∶1 000)、兔抗GPX4 抗体(1∶800)、兔抗Transferrin Receptor 抗体(1∶500);兔抗GAPDH抗体(1∶10 000)、兔抗Ferritin-1(1∶1 000)为一抗,4℃孵育过夜;PBS清洗后,HRP标记的山羊抗兔IgG(1∶2 000)室温孵育1 h,TBST洗5次,每次10 min;将配好的ECL显色液加到PVDF膜上进行曝光拍照。Image 2x软件采集各样本灰度值,蛋白相对表达量以目的蛋白灰度值/GAPDH灰度值表示。
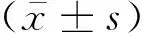
2 结果
2.1 维生素D可显著降低6-OHDA对PC12细胞活力的影响与Control组比较,6-OHDA可显著抑制PC12细胞活力(t=5.031,P=0.002);与6-OHDA处理组比较,不同浓度的VD均可显著促进PC12细胞活力(F=33.25,P=0.000),并呈现浓度依赖性;与20 ng/mL的VD相比,40 ng/mL(t=3.796,P=0.009)和80 ng/mL(t=4.607,P=0.004)的VD均可促进PC12细胞活力,见表2。
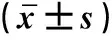
表2 预处理组细胞活力检测
与Control组比较,Erastin可显著抑制PC12细胞活力(t=15.820,P=0.000);与Erastin组比较,不同浓度的VD均可显著促进PC12细胞活力(F=3.733,P=0.041);20 ng/mL与40 ng/mL的VD对PC12细胞活力的影响相当,与20 ng/mL的VD相比,80 ng/mL的VD可显著促进PC12细胞活力(t=2.657,P=0.025)。与Control组比较,ML385可显著抑制PC12细胞活力(t=14.760,P=0.000);与ML385组比较,不同浓度的维生素D均可显著促进PC12细胞活力(F=24.440,P=0.000),并呈现浓度依赖性;与20 ng/mL的VD相比,40 ng/mL(t=2.556,P=0.043)及80 ng/mL(t=5.216,P=0.013)的VD均可显著促进PC12细胞活力,见表3。综上所述,40 ng/mL及80 ng/mL VD均可促进PC12细胞活力,但两组细胞活力相差不大,结合实验效益,故后续实验均选用40 ng/mL的VD进行实验。
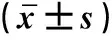
表3 Erastin干预组及ML385干预组细胞活力检测
2.2 维生素D可显著抑制6-OHDA所致PC12细胞凋亡与Control组比较,6-OHDA干预后,可显著促进PC12细胞凋亡(t=22.030,P=0.000);与6-OHDA组比较,维生素D干预后,可显著抑制PC12细胞凋亡(t=16.570,P=0.000)。与VD组比较,Erastin+VD(t=7.246,P=0.002)、ML385+VD(t=7.260,P=0.002)组细胞凋亡水平显著升高,见图1。
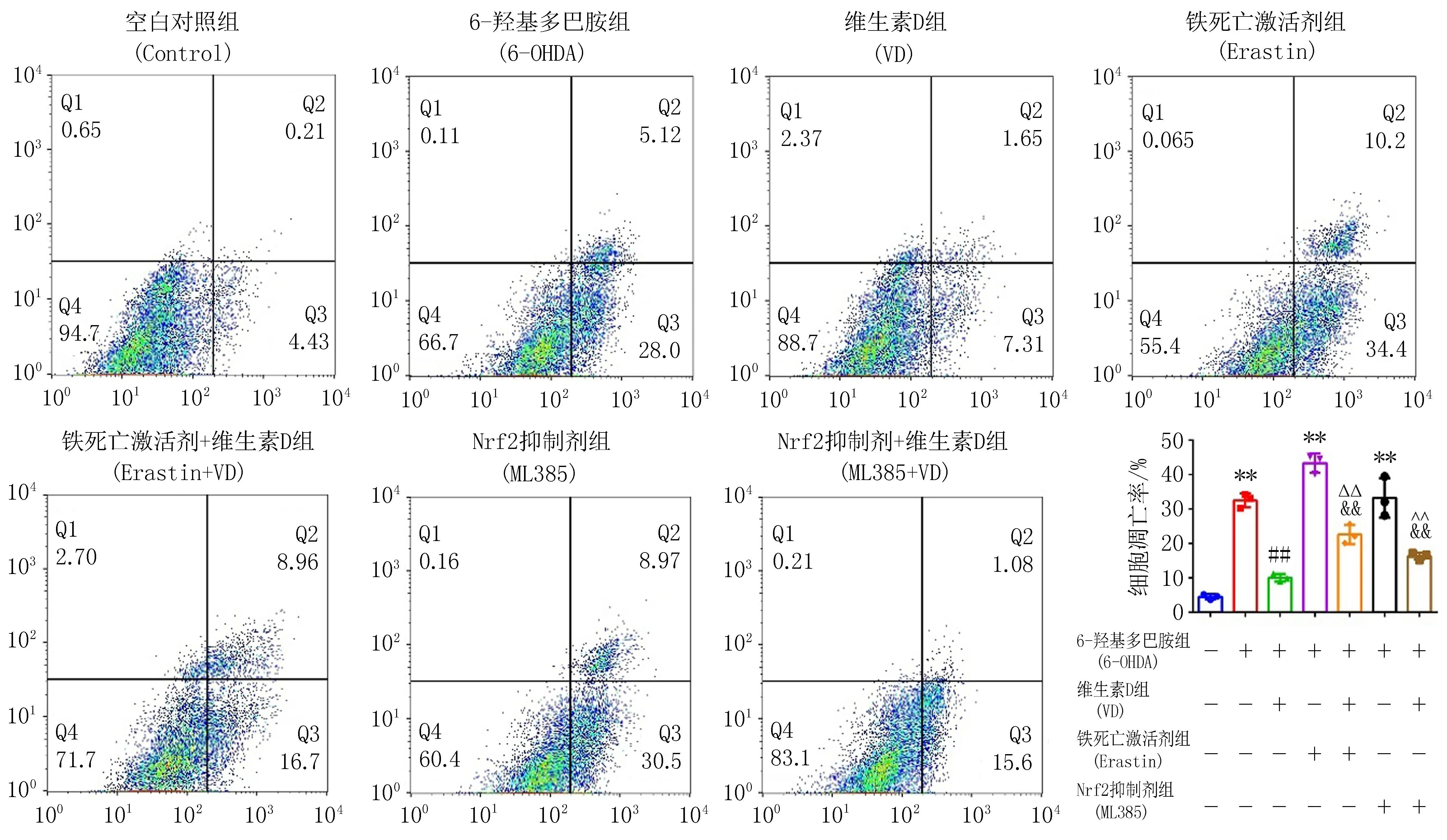
注:与Control组比较, **P<0.01; 与6-OHDA组比较, **P<0.01; 与Erastin组比较, △△P<0.01; 与ML385组比较, ∧∧P<0.01; 与VD组比较, &&P<0.01 (柱状图从左至右依次为Control组、6-OHDA组、VD组、Erastin组、Erastin+VD组、ML385组、ML385+VD组)。图1 细胞凋亡检测
2.3 维生素D可显著抑制6-OHDA所致PC12细胞氧化应激水平与Control组比较,6-OHDA干预后,PC12细胞中GSH(t=276.400;P=0.000)、SOD(t=76.000;P=0.000)水平均显著降低,而LDH(t=86.960;P=0.000)、MDA(t=16.040;P=0.000)水平显著升高。与6-OHDA组比较,VD可显著提高GSH(t=56.310;P=0.000)、SOD(t=76.330;P=0.000)水平,降低LDH(t=40.790;P=0.000)、MDA(t=9.177;P=0.000)水平。与VD组比较,Erastin+VD组GSH(t=30.260;P=0.000)、SOD(t=26.580;P=0.000)水平均显著降低,而LDH(t=26.920;P=0.000)、MDA(t=7.746;P=0.001)水平显著升高;与VD组比较,ML385+VD组等到类似的结果,见表4。
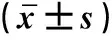
表4 GSH、LDH、MDA、SOD表达检测
2.4 维生素D可显著抑制6-OHDA所致PC12细胞铁离子沉积与Control组比较,6-OHDA干预后,PC12细胞中铁离子含量显著升高(t=54.130,P=0.000)。与6-OHDA组比较,VD可显著抑制PC12细胞中铁离子沉积(t=27.230,P=0.000)。与VD组比较,Erastin+VD组铁离子水平显著升高(t=17.530,P=0.000)。与VD组比较,ML385+VD组铁离子水平显著升高(t=6.562,P=0.003),见表5。
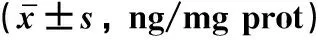
表5 铁离子含量
2.5 维生素D对FTH-1、SLC7A11、GPX4、TFR-1等铁离子相关标志物表达的影响qRT-PCR检测分析发现,与Control组比较,6-OHDA干预后,PC12细胞中FTH-1(t=21.470,P=0.000)、SLC7A11(t=89.460,P=0.000)、GPX4(t=80.880,P=0.000)的表达显著降低,TFR-1的表达显著升高(t=134.600,P=0.000)。与6-OHDA组比较,VD可显著提高PC12细胞中FTH-1(t=51.400,P=0.000)、SLC7A11(t=75.850,P=0.000)、GPX4(t=64.660,P=0.000)的表达,TFR-1的表达显著降低(t=120.200,P=0.000)。与VD组比较,Erastin+VD组FTH-1(t=41.020,P=0.000)、SLC7A11(t=46.570,P=0.000)、GPX4(t=50.440,P=0.000)的表达显著降低,TFR-1的表达升高(t=56.210,P=0.000);与VD组比较,ML385+VD组得到类似的结果,见图2。
注:与Control组比较, **P<0.01; 与6-OHDA组比较, ##P<0.01; 与Erastin组比较, △△P<0.01; 与ML385组比较, ∧∧P<0.01; 与VD组比较, &&P<0.01。图2 qRT-PCR检测FTH-1、SLC7A11、GPX4、TFR-1的表达
Western blot检测PC12细胞中FTH-1、SLC7A11、GPX4、TFR-1的蛋白表达统计结果与qRT-PCR检测结果类似,见图3。
注:与Control组比较, **P<0.01; 与6-OHDA组比较, ##P<0.01; 与Erastin组比较, △△P<0.01; 与ML385组比较, ∧∧P<0.01; 与VD组比较, &&P<0.01。图3 Western blot检测FTH-1、SLC7A11、GPX4、TFR-1的表达
2.6 维生素D对Nrf2/HO-1通路激活的影响与Control组比较,6-OHDA干预后,PC12细胞中Nrf2(t=10.430,P=0.001)、 HO-1(t=12.490,P=0.000)的表达显著降低。与6-OHDA组比较,VD可显著提高PC12细胞中Nrf2(t=8.465,P=0.001)、HO-1(t=8.422,P=0.001)的表达。与VD组比较, Erastin+VD组Nrf2(t=5.754,P=0.005)、HO-1(t=5.984,P=0.004)的表达显著降低。与VD组比较,ML385+VD组Nrf2(t=2.883,P=0.009)、HO-1(t=7.839,P=0.001)的表达显著降低(P<0.01),见图4。
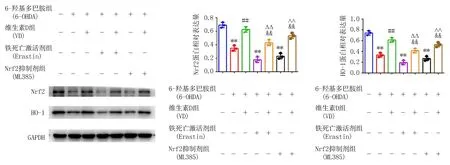
注:与Control组比较, **P<0.01; 与6-OHDA组比较, ##P<0.01; 与Erastin组比较, △△P<0.01; 与ML385组比较, ∧∧P<0.01; 与VD组比较, &&P<0.01。图4 Western blot检测Nrf2、HO-1的表达
3 讨论
帕金森病(PD)属中老年人常见的神经系统变性疾病,主要由位于基底神经节区域黑质致密部(SNpc)的多巴胺能神经元耗竭引起的[1,13],目前缺乏有效的治疗手段。研究发现,抑制铁死亡可显著缓解PD进展[14-15]。维生素D可以通过调节神经系统钙平衡以及影响神经营养因子表达而参与神经系统的代谢,发挥其对PD患者的神经保护作用[5]。本研究发现,维生素D可通过抑制6-OHDA所致PC12细胞铁死亡,进而抑制细胞损伤,提示维生素D可作为PD潜在的治疗手段。
维生素D对神经有潜在保护作用,PD患者的维生素D水平较低,PD患者缺乏维生素D较普遍的现象,与PD患者认知功能密切相关[16-17]。维生素D是一类脂溶性类固醇,可以从饮食中获得,也可以通过皮肤暴露在紫外线下产生,主要包括维生素D2(ergocalciferol,麦角钙化醇)和维生素D3(cholecalciferol,胆钙化醇)[18]。在肝脏,维生素D被双重羟基化激活,转化为25-羟基维生素D[25(OH)D],然后在肾脏,通过1-α-羟化酶的作用,成为具有活性的1,25-二羟基维生素D2[1,25(OH)2D2]或D3[1,25(OH)2D3][18]。1,25(OH)2D3可通过抑制一氧化氮合酶(Nitric Oxide Synthases,NOS)的产生而抑制活性氧物质的合成;1,25(OH)2D3也能通过提高γ-谷氨酰转移酶的含量,增加谷胱甘肽(GSH)表达而激活脑内抗氧化途径,进而减少对帕金森氏症患者黑质多巴胺能神经元的氧化损伤,阻止多巴胺能神经元的丢失;1,25(OH)2D3通过影响离子通道(Ca2+、Na+、Mg2+等),缓解神经元细胞线粒体损伤[19];1,25(OH)2D3上调神经营养因子的表达,直接促进多巴胺的释放或者抑制氧化应激的产生[20]。同时,遗传因素也可能是导致PD患者VD缺乏的重要因素,PD与VD受体单核苷酸多态性(Single nucleotide polymorphism,SNP)和维生素D结合蛋白(Vitamin D Binding Protein,DBP)的关联在PD中已有相关研究[21]。本研究发现,维生素D干预后,可显著抑制6-OHDA所引起的PC12细胞凋亡,从细胞水平说明了维生素D可缓解PD损伤。
铁死亡是一种新型细胞死亡形式,通常在细胞死亡过程中伴有大量的铁离子蓄积和脂质过氧化。已有多项研究发现铁死亡与PD进展关系密切[8-9,22]。铁作为强还原剂,会产生羟基自由基,并引起多巴胺的氧化,这促进了PD中黑质多巴胺神经元的氧化环境的形成[23],因此,铁稳态的失衡会促发PD。维生素D可有效改善缺血缺氧性脑损伤和神经元线粒体损伤,上调神经元中Nrf2和HO-1的表达,导致GPX4、SOD和GSH水平升高,MDA和ROS含量降低[6]。维生素D可通过抑制肠黏膜中ROS及MDA的累积,增加机体抗氧化能力,提高线粒体ATP酶活性,促进线粒体裂变及聚合平衡,最终降低铁死亡,抑制顺铂所导致的肠黏膜内皮细胞铁死亡[24]。不同浓度维生素D处理后,可显著提高斑马鱼的抗氧化能力,抑制肝细胞的线粒体损伤,增加铁死亡相关基因(FTH-1、GPX4、GP4a、GPX4b)的表达,最终促进斑马鱼的存活率[25]。本研究发现,6-OHDA刺激后,可促进PC12细胞铁沉积,GSH、SOD的水平显著降低,LDH、MDA水平显著升高;FTH-1、SLC7A11、GPX4、TFR-1的表达显著降低。而维生素D干预后,GSH、SOD的水平显著升高,LDH、MDA水平显著降低;FTH-1、SLC7A11、GPX4、TFR-1的表达显著升高;铁死亡激活剂Erastin可显著抑制维生素D的作用,以上结果说明维生素D缓解6-OHDA所致PC12细胞损伤与铁死亡相关。
Nrf2/HO-1通路和铁死亡关系密切[26]。抑制Nrf2后,可显著抑制氧糖剥夺所致MLE12细胞氧化应激及线粒体功能变化,降低SLC7A11和HO-1的表达,抑制铁死亡,缓解急性肺损伤[27]。在癫痫模型中,海马神经元细胞中GPX4、Nrf2及HO-1 mRNA及蛋白表达水平均显著降低,促进神经元细胞铁死亡,而提高GPX4、Nrf2及HO-1的表达,可显著缓解神经元细胞铁死亡[28]。有研究发现,维生素D可通过激活Nrf2抑制铁死亡[6]。本研究发现,利用Nrf2抑制剂ML385干预后,维生素D缓解6-OHDA所致PC12细胞铁死亡的作用显著降低,说明维生素D调控6-OHDA所致PC12细胞铁死亡与Nrf2/HO-1通路激活相关。
综上所述,本研究初步说明维生素D可激活Nrf2/HO-1通路,缓解6-OHDA所致PC12细胞铁死亡。但由于本研究局限于细胞水平,后续还需通过动物水平,进一步明确维生素D缓解PD进展与铁死亡的关系及可能调控机制。
