酵母水解物对克氏原螯虾生长性能、消化、抗氧化和免疫能力的影响
2024-01-11李玉龙付运银阮国良
李玉龙 付运银 张 恒 方 刘 , 王 乾 阮国良 ,
(1.长江大学动物科学学院, 荆州 434025; 2.长江大学小龙虾繁育与健康养殖创新技术研究中心, 荆州 434025;3.湖北省水产产业技术研究院, 荆州 434026)
克氏原螯虾(Procambarus clarkii)原产于美国南部和墨西哥北部, 20世纪30年代经从日本传入中国[1],因其肉质鲜美, 营养价值高, 深受欢迎, 现已归化为我国重要的淡水养殖虾类[2]。我国的克氏原螯虾养殖规模巨大, 2022年全国该虾养殖的总面积和总产量分别达2800万亩和289.07万吨[3]。高密度的集约化水产养殖易导致养殖生态环境恶化和养殖病害频发, 在大规模养殖中, 日益严重的细菌性及病毒性病害问题给克氏原螯虾的养殖业带来重大损失[4]。目前, 对该虾的以上病害尚缺乏非常有效的防控措施[5],主要以预防为主, 如通过营养调控提高虾体的免疫力。因此, 寻求优质的功能性饲料添加剂对于克氏原螯虾等水产动物的健康养殖具有非常重要的意义。
酵母水解物(Yeast hydrolysate, YHY)是用新鲜啤酒酵母为原料经除杂、自溶、酶解、喷雾干燥等工艺精制而成的一种优质功能性蛋白原[6,7], 其富含蛋白质、核苷酸、小肽、维生素、生物酶、酵母多糖、游离氨基酸及B族维生素[8—10]。YHY作为一种绿色、安全和高效的优质饲料添加剂在水产养殖领域已有广泛的运用, 其可显著改善和提高水产动物的生长性能、非特异性免疫力和抗氧化能力[9,11—15]。研究表明, 饲料中添加1.0%的YHY可以显著提高日本沼虾(Macrobrachium nipponense)的生长并增强其抗氧化能力[15]; 凡纳滨对虾(Litopenaeus vannamei)饲料中YHY的适量添加, 显著提高了该虾的生长和饲料的转化效率[9,14]、免疫酶(如超氧化物歧化酶、酚氧化酶和溶菌酶等)活性及耐低氧、耐低温和抗病能力[16,17]。为此, 本实验通过在基础饲料中添加不同水平的YHY, 分析其对克氏原螯虾幼虾生长、消化、抗氧化和非特异性免疫的影响, 旨在为促进该虾的饲料添加剂配方和健康养殖提供依据。
1 材料与方法
1.1 养殖管理
实验用克氏原螯虾购自湖北潜江市某养殖基地的同一批幼苗。湿法运输至室内克氏原螯虾系统实验基地。购回虾后添加适量的维生素C于暂养缸中, 降低幼虾应激反应。每天饱食投喂基础饲料,暂养2周。正式实验前禁食24h, 选用规格一致、健康和活力正常(6.43±0.55) g的克氏原螯虾300尾, 随机分为5组, 每组3个重复。养殖密度20尾/缸, 放养于15个容积为84L水族箱(0.6m×0.4m×0.35m)组成的室内养殖系统中, 水位15 cm。每日投喂2次(9:00和18:00), 投喂量为体重的3%, 自然光照, 温度为(25±0.5)℃, pH 7.5, 溶解氧(6.5±0.5) mg/L, 实验缸中放置足量遮蔽物和虾爬架以减少虾间打斗行为, 每天换水1/3—1/2, 不间断增氧, 实验用水为充分曝气的自来水, 实验期8周。
1.2 实验饲料制作及分组
YHY购自河南赛傅生物科技有限公司, 由酿酒酵母为原料经一系列复杂加工过程制成。其产品成分含量如下: 粗蛋白≥40.0%、氨基酸态氮≥2.0%、甘露寡糖≥5.0%、核酸≥7.0%、水分≤10.0%及灰分≤10.0%。本实验共配制5组饲料, 基础配方的原料配比及营养水平见表1, 在基础饲料中分别添加0.5%、1%、2%和4%剂量的YHY。饲料原料经粉碎机(皇代-800Y)粉碎, 过80目筛网, 混合均匀, 然后将豆油、鱼油及适量水均匀地洒在混合饲料中, 用手揉捏。经饲料颗粒机(NBS-150)挤压制成粒径2.0 mm的饲料, 60℃烘12h, 冷却, 密封袋分装, 标记, -20℃冰箱保存备用。饲料制作后,从5组饲料中随机抽取样品对其营养水平进行测定。

表1 基础配方的原料配比及营养水平(干物质基础)Tab.1 Ingredient and nutritional level of basic diet (dry matter basis)
1.3 样品采集
养殖实验结束后, 禁食24h。对每缸克氏原螯虾进行计数, 准确称量每尾虾的体重, 并且用游标卡尺精确测量每尾虾的体长, 做好记录, 用于生长性能指标的计算。解剖前每组随机选取12尾虾, 用1 mL一次性无菌注射器从虾的头胸甲后缘插入, 从围心腔中抽取血淋巴于1.5 mL离心管。每缸随机解剖3尾虾, 取性腺组织, 称重, 用于检测性腺指数。取0.1 g胃组织制作混样, 每组4个重复, 分装于EP管中, -80℃冰箱保存, 用于评估其消化能力。剥去肝胰腺称重后, 每缸取3尾虾肝胰腺0.1 g制为混样, 每组4个重复, 分装于EP管中, -80℃冰箱保存,用于检测其消化、抗氧化及免疫指标; 每组随机取6尾全虾和上述取样虾腹部肌肉, 分别放入相应编号的封口袋中, -80℃冰箱保存, 用于体成分测定。
1.4 指标测定
(1) 生长指标的计算
增重率(WGR, %)=(W1-W0)/W0×100
特定生长率(SGR, %/d)=(lnW1-lnW0)/d×100
肝胰腺指数(HSI)=WH/W1×100
性腺指数(GSI)=WG/W1×100
肥满度(CF, g/cm3)=W/L3×100
式中,N1为实验结束后存活的虾尾数;N0为实验前虾的初始尾数;W1为实验结束后虾的体重;W0为实验前虾的重量;WH为肝胰腺重量;WG为性腺重量;L0为虾初体;L1为虾末体长; d为养殖天数。
(2) 全虾、肌肉及饲料营养成分测定
粗蛋白含量采用凯氏定氮法(GB/T6432-1994)测定, 粗脂肪含量采用索氏乙醚抽提法(GB/T6433-2006)测定, 粗灰分含量采用马弗炉灼烧法(GB/T6438-1992)测定, 水分含量采用105℃恒温烘干法(GB/T6435-2006)测定。
瘢痕子宫是产科临床常见的问题,我国人口政策的调整(二胎政策的放开),我国剖宫产率逐年增加,美国数据也显示剖宫产率增加,疤痕子宫再次妊娠的阴道分娩问题受到产科届特别的关注和重视[1-4]。疤痕子宫因盆腔粘连再次行剖宫产术的困难及复杂程度明显升高,容易引发凶险型前置胎盘甚至胎盘植入导致产后大出血、新生儿窒息、产褥感染等并发症[5-7]。本课题通过建立适合我国国情的疤痕子宫再次妊娠经阴道分娩的风险评分制表,评估VBAC的分娩结局,做好VBAC管理和规范。
1.5 胃组织和肝胰腺消化酶活性的测定
称取采集的胃组织和肝胰腺组织样品, 通过添加9vol (V/W)的生理盐水并使用匀浆器匀浆, 用高速冷冻离心机在4℃、4000 r/min的条件下离心15min,保留上清液, 制成10%的组织匀浆。测定指标包括:胃组织和肝胰腺的淀粉酶、胃蛋白酶及脂肪酶活性; 肝胰腺的过氧化氢酶(CAT)、超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-PX)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)等酶类的活性、总抗氧化能力(T-AOC)及丙二醛(MDA)含量。
将所采集血淋巴样品在4℃冰箱静置过夜后,用高速冷冻离心机在4℃、3500 r/min条件下离心10min制备血清, 检测血清总蛋白(TP)和白蛋白(ALB)的含量及谷丙转氨酶(ALT)和谷草转氨酶(AST)的活性。肝胰腺、肠道和胃组织及血淋巴指标测定所用试剂盒均购自南京建成生物科技有限公司, 具体测定方法参照试剂盒所附说明书。
1.6 数据处理
数据经Excel 2019初步处理后使用SPSS 26.0软件进行统计学分析。在实验数据满足正态分布和方差齐性的基础上, 进行单因素方差分析(One-way ANOVA)并用Duncan’s法进行多重比较, 以P<0.05表示差异显著。数据用平均值±标准差(SD)表示,最后用Origin 2022b软件绘图。
2 结果
2.1 YHY对克氏原螯虾生长性能的影响
由表2可知, 饲料中添加YHY可以改善克氏原螯虾生长性能。增重率(WGR)、存活率(SR)、特定生长率(SGR)、肝胰腺指数(HSI)和性腺指数(GSI)随着YHY添加量的升高呈现先上升后下降的趋势。WGR和SGR在1%YHY添加组达到最大值,显著高于其他组(P<0.05)。SR、HSI和GSI在2%YHY添加组达到最大值且均显著高于对照组和0.5%添加组(P<0.05)。1%与2%YHY添加组的终末体重(FBW)和终末体长(FBL)无显著性差异(P>0.05), 但均显著高于其他组(P<0.05)。1%YHY添加组的肥满度(CF)显著高于0.5%添加组(P<0.05), 其他组间的CF无显著性差异(P>0.05)。

表2 饲料中添加不同水平酵母水解物对克氏原螯虾生长指标的影响Tab.2 Effects of different levels of dietary yeast hydrolysate on growth performance of P.clarkii
2.2 YHY对克氏原螯虾肌肉和体成分的影响
由表3可知, 饲料中添加YHY对克氏原螯虾全虾水分、粗脂肪和粗灰分无显著影响(P>0.05); 全虾粗蛋白呈现先上升后下降的趋势, 在1.00%YHY添加组达到最大值, 且显著高于其他组(P<0.05)。

表3 饲料中添加不同水平酵母水解物对克氏原螯虾肌肉和体成分的影响Tab.3 Effects of different levels of dietary yeast hydrolysate on muscle and whole body composition of P.clarkii
饲料中添加YHY对克氏原螯虾肌肉水分和灰分无显著影响(P>0.05); 粗蛋白和粗脂肪均在2%YHY添加组达到最大值, 且粗脂肪含量显著高于对照组(P<0.05); 2%和4%YHY添加组粗蛋白含量显著高于0.5%和1%添加组(P<0.05), 但与对照组都无显著性差异(P>0.05)。
2.3 YHY对克氏原螯虾胃和肝胰腺组织消化酶活性的影响
如图1所示, 2%YHY添加组的胃组织淀粉酶活性达到最高值, 且2%和4%YHY添加组的胃组织淀粉酶活性显著高于其他组(P<0.05; 图1A)。随着饲料中YHY含量的升高, 胃组织蛋白酶活性和脂肪酶活性呈先升后降的趋势, 2%YHY添加组的蛋白酶活性达到最大值, 显著高于其他组(P<0.05); 1%和2%YHY添加组的脂肪酶活性无显著差异(P>0.05),但均显著高于其他组(P<0.05; 图1B和1C)。
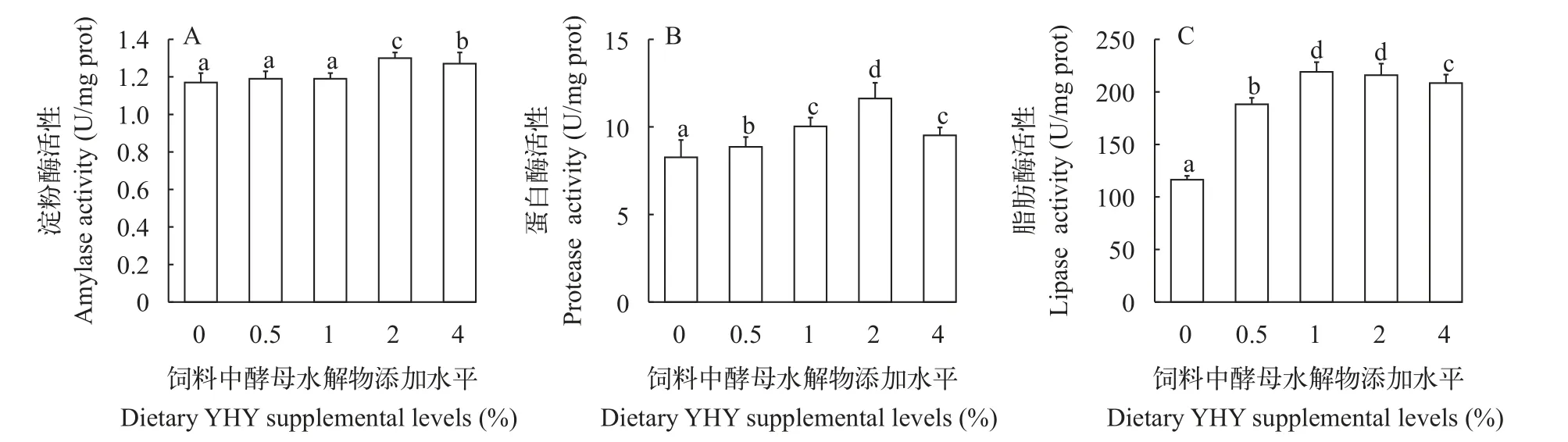
图1 饲料中添加不同水平酵母水解物对克氏原螯虾胃组织消化酶活性的影响Fig.1 Effects of different levels of dietary yeast hydrolysate on digestive enzyme activities in gastric tissue of P.clarkii
如图2所示, 酵母水解物添加组的肝胰腺组织淀粉酶、蛋白酶和脂肪酶活性均呈现先升高后降低趋势。肝胰腺淀粉酶和蛋白酶活性均在2%YHY添加组达到最大值(图2A和2B), 脂肪酶活性在1%YHY添加组达到最大值, 但随着YHY添加量的增加, 脂肪酶活性并无显著差异(P>0.05; 图2C)。2%YHY添加组肝胰腺的淀粉酶活性显著高于对照组和4%YHY添加组( P<0.05; 图2A), 蛋白酶活性显著高于其他各组(P<0.05;图2B), 脂肪酶活性显著高于对照组和0.5%YHY添加组(P<0.05; 图2C)。结果表明, YHY可提高克氏原螯虾胃和肝胰腺组织的消化酶活性, 具有提高该虾消化能力的作用。

图2 饲料中添加不同水平酵母水解物对克氏原螯虾肝胰腺消化酶活性的影响Fig.2 Effects of different levels of dietary yeast hydrolysate on digestive enzyme activities in hepatopancreas of P.clarkii
2.4 YHY对克氏原螯虾肝胰腺抗氧化能力的影响
如图3所示, 随着饲料中YHY添加量的升高,克氏原螯虾肝胰腺CAT、T-SOD和T-AOC活性均呈先增后降的趋势, 且均在2%YHY添加组达到最大值。2%YHY添加组肝胰腺CAT和T-SOD活性显著高于其他各组(P<0.05; 图3A和3B); 2%和4%添加组肝胰腺T-AOC能力均显著高于其他组(P<0.05;图3C)。1%YHY添加组的肝胰腺GSH-PX活性显著高于其他各组(P<0.05), 2%与4%YHY添加组肝胰腺GSH-PX活性显著高于对照组和0.50%添加组(P<0.05; 图3D)。随着饲料中YHY添加量含量的升高, 肝胰腺MDA含量呈先降后增的趋势, 2%YHY添加组肝胰腺MDA含量最低, 1%和2%YHY添加组肝胰腺MDA含量均显著低于对照组和其他实验组(P<0.05; 图3E)。结果表明, 饲料中适量添加YHY可以增强克氏原螯虾肝胰腺抗氧化酶的活性, 降低与氧化损伤有关的MDA含量从而提高该虾的抗氧化能力。
2.5 YHY对克氏原螯虾血清生化指标的影响
如图4所示, 随着饲料中YHY含量的升高, 克氏原螯虾血清TP和ALB含量呈先增后降的趋势, 均在2%添加组达到最大值, 且显著高于其他组(P<0.05;图4A和4B)。血清ALT和AST活性随着YHY含量的升高呈先降后升的趋势, 均在2%添加组下降到最低值; 1%和2%YHY添加组血清ALT显著低于其他组(P<0.05), 2%YHY添加组血清AST活性显著低于其他组(P<0.05; 图4C和4D)。结果表明, 饲料中添加YHY可改善克氏原螯虾血清生化指标。

图4 饲料中添加不同水平酵母水解物对克氏原螯虾血清生化指标的影响Fig.4 Effects of different levels of dietary yeast hydrolysate on serum biochemical indices of P.clarkii
2.6 YHY对克氏原螯虾肝胰腺免疫酶活性的影响
如图5所示, 随着饲料中YHY添加量的升高,克氏原螯虾肝胰腺AKP、ACP和LZM活性均呈现先升高后下降趋势, AKP与ACP活性均在2%YHY添加组达到最大值, 且AKP活性与1%添加组无显著性差异(P>0.05)但均显著高于其他组(P<0.05; 图5A),ACP活性显著高于其他组(P<0.05; 图5B)。肝胰腺LZM活性在1%添加组达到最大值且显著高于其他组(P<0.05), 此外, 2%和4%YHY添加组的肝胰腺LZM活性仍然显著高于对照组和0.50%添加组(P<0.05; 图5C)。以上结果表明, 饲料中添加适量的YHY可以提高克氏原螯虾肝胰腺免疫相关酶的活性, 从而增强该虾的非特异性免疫能力。

图5 饲料中添加不同水平酵母水解物对克氏原螯虾肝胰腺免疫酶活性的影响Fig.5 Effects of different levels of dietary yeast hydrolysate on immunoenzymatic activities in hepatopancreas of P.clarkii
3 讨论
3.1 YHY对克氏原螯虾生长性能及体成分的影响
在动物生长过程中, SR、SGR和WGR等是评价养殖动物生长情况的重要参考指标, 也是最直观的指标。对本实验的结果分析发现, 饲料中添加2%YHY可以显著提高克氏原螯虾的SR、WGR和SGR指标, 说明YHY有利于该虾的存活与生长。究其原因, 可能与YHY中所富含的氨基酸、核苷酸及甘露寡糖等营养物质被机体消化吸收有关, 这与在日本沼虾幼虾[15]和凡纳滨对虾[9]的研究结果相似。但YHY的最适添加量在不同物种甚至同一物种中存在一定差异。熊家等[14]研究发现饲料中添加5%的YHY可改善凡纳滨对虾的生长性能, 显著提高该虾的FBW、WGR和SGR且显著降低其FCR, 而0.5%—2%添加量对其生长性能无显著影响。时博等[7]研究发现饲料中添加5 g/kg的YHY对大口黑鲈(Micropterus salmoides)的SGR、SR等生长指标无显著影响。由此可见, YHY在水产动物中的最适添加水平存在较大差异, 可能与养殖模式、养殖动物种类、生长阶段及饲料配方等因素有关。
粗蛋白质、粗脂肪和粗灰分等物质是评价肌肉化学品质的重要参考指标[18], 且蛋白质作为六大营养素之首, 其含量高低也是评价肌肉品质和营养价值的重要指标[19]。在本实验中, YHY添加组中全虾的粗蛋白含量均有所提高, 在1%添加组达到最大值, 显著高于其他组, 而粗脂肪含量无显著变化;肌肉中粗蛋白质和粗脂肪含量均在2%添加组达到最大值, 且粗脂肪含量显著高于对照组。全虾粗蛋白含量的提高表明饲料中添加YHY可能促进了克氏原螯虾蛋白质的沉积, 这可能与YHY中所含小肽的高消化吸收率有关, 而肌肉中粗脂肪含量的变化,可能与肌肉中脂肪的合成和沉积速率或者生长速率的变化有关, 具体机制有待进一步研究。熊家等[14]对凡纳滨对虾的研究发现, 5%YHY组的全虾粗蛋白含量显著增高; 在饲料中添加1.88 g/kg以上的YHY可显著增加大口黑鲈肝脏粗蛋白质含量[20]。然而,饲料中添加酿酒酵母对欧洲鳇(Huso huso)的体组分无显著影响[21]。曾本和等[22]的研究发现, 饲料中添加适宜YHY可分别显著提高和降低草鱼(Ctenopharyngodon idellus)鱼体的粗蛋白与粗脂肪含量;在饲料中添加YHY可以显著提高青鱼(Mylopharyngodon piceus)幼鱼肌肉中粗灰分和全鱼中粗脂肪含量[23]。以上研究结果的差异可能与物种、生长阶段和食性等多种因素的不同有关。
3.2 YHY对克氏原螯虾消化酶活性的影响
消化酶活性大小可用来衡量动物对营养物质的消化吸收能力。虾类的生长与其消化酶活性紧密相关[24,25], 与此同时, 食物营养素的质和量又是影响甲壳类动物消化酶活性的关键因素[26]。本实验发现, 2%YHY添加组的克氏原螯虾胃和肝胰腺组织的淀粉酶和蛋白酶活性最高, 1%YHY添加组的脂肪酶活性最高但与2%YHY添加组无显著差异;1%— 4%YHY添加组克氏原螯虾胃和肝胰腺组织中的3种消化酶活性均显著高于对照组。这些结果表明YHY可提高该虾的消化酶活性, 与熊家等[14]在凡纳滨对虾中的研究结果类似。这种消化酶活性促进作用可能与YHY对机体所需氨基酸、核苷酸、甘露寡糖和营养小肽等的营养补充有关, 进而促进其对饲料营养物质的消化、吸收和利用[27—29]。朱波等[30]的研究表明, 饲料中添加0.05%的甘露寡糖可以提高草鱼增重率, 增强肠道消化酶活性, 提高机体非特异性免疫力。因此, 在饲料中添加1%—2%YHY可增强克氏原螯虾的消化吸收能力进而有利于其生长。
3.3 YHY对克氏原螯虾肝胰腺抗氧化指标的影响
水生动物的抗氧化能力可用于反映其健康状况[12], MDA是由脂质过氧化物分解产生的毒性物质且其含量可反映机体的氧化损伤程度, 而CAT、SOD、GSH-PX及T-AOC等常被用于反映机体的抗氧化能力与机体健康程度[15,31]。SOD、CAT和GSHPX可以有效地清除氧自由基, 减少机体氧化损伤,提高机体免疫力[32,33]。本实验结果显示, 随着YHY添加量的增加克氏原螯虾肝胰腺MDA含量呈现先下降后上升的趋势, CAT、T-AOC和T-SOD活性均呈现先上升后下降的趋势, 且均在2%添加组达到最小值或者最大值, 与对照组差异显著; YHY添加组GSH-PX活性均显著上升, 且在1%添加组达到最大值。这表明饲料中添加YHY可以增强克氏原螯虾的抗氧化能力。与本实验结果相似的是, 饲料中添加2%的YHY可以显著提高日本沼虾肝胰腺TAOC和SOD活性, 增强该虾的抗氧化能力[15]; 饲料中添加1%的YHY可显著提高大菱鲆(Scophthalmus maximus)幼鱼的T-AOC, 且2%的添加量可降低其肝脏的MDA含量[6]。此外, 在中华绒螯蟹(Eriocheir sinensis)[34]与凡纳滨对虾[35]等甲壳类及建鲤(Cyprinuscarpiovar.Jian)[36]、异育银鲫(Carassiusauratus gibelio)[37]、罗非鱼(Oreochromis niloticus)[11]、齐口裂腹鱼(Schizothoraxprenanti)[38]、大口黑鲈[12]等鱼类中也发现YHY可提高机体的抗氧化能力。其原因可能是YHY经破壁处理, 释放酵母细胞内容物,使其中β-葡聚糖、小肽、核苷酸和维生素等免疫生物活性物质的功效性得到最大利用, 从而增强机的抗氧化损伤能力[39—41]。
3.4 YHY对克氏原螯虾血清生化指标的影响
水产动物血液生化组成与机体生理健康、物质代谢、营养及疾病状况密切相关[42—44]。血清中的酶活力水平可以反映蛋白、肽类及氨基酸等物质的吸收代谢状况, TP由ALB和球蛋白组成, 是反映机体蛋白质代谢和肝脏功能的重要指标[45], 血清TP含量增加可以促进机体蛋白质沉积, 促进生长;ALB作为营养物质的载体, 与机体生长变化密切相关[46]。因此, TP和ALB指标的变化都可直观反映出机体的生长、代谢及免疫状况[45,47]。本研究结果显示, YHY添加组血清TP和ALB含量均显著高于对照组, 且在2%YHY添加组达到最大值, 说明饲料中添加YHY可以促进机体蛋白质合成, 增强机体免疫能力。类似的研究表明, 饲料中添加5%YHY显著提高凡纳滨对虾血清TP含量[43]; 0.2%—0.6%蜜糖YHY和0.6%啤酒YHY可提升异育银鲫的蛋白合成能力, 促进机体消化吸收蛋白质[48]。ALT和AST作为参与动物机体蛋白质代谢的重要氨基酸转移酶是反映肝脏功能的重要指标[47]。正常状态下血清中相关转氨酶活性处于较低水平, 肝脏细胞受损导致其细胞膜通透性变强时, ALT和AST才会大量渗透到血液[49,50], 故血清AST和ALT活性可反映出肝细胞受损状况。在本实验中, YHY可以显著降低血清中AST和ALT活性且在添加量为2%时达到最低值, 说明YHY的添加有利于促进克氏原螯虾肝胰腺的健康。杜瑞玉等[20]和易婉婷等[31]研究发现, 饲料中添加YHY可以大口黑鲈的降低血清AST活性;5%YHY的饲料中添加可显著降低凡纳滨对虾的血清AST和ALT活性[43]。因此, 饲料中添加YHY对克氏原螯虾有肝保护作用, 有助于维持其机体正常的肝胰腺功能。
3.5 YHY对克氏原螯虾非特异性免疫能力的影响
克氏原螯虾属于淡水甲壳类动物, 主要依靠先天性免疫系统进行防御[51,52]。AKP和ACP作为代谢调节酶, 在甲壳动物的非特异性免疫反应中发挥重要作用[53,54]。LZM是由巨噬细胞分泌的碱性蛋白, 在免疫过程中催化细菌细胞壁的水解及诱导合成和分泌免疫因子[55], 在先天免疫中具有非常重要的作用。本实验结果显示, 添加YHY可以显著提高克氏原螯虾肝胰腺免疫酶活性, 且其AKP和ACP活性均在2%添加组达到最大值, LZM活性在1%添加组达到最大值。相关研究结果显示, 添加1%的YHY可提高凡纳滨对虾的血清PO、NOS和LZM活性[43], 添加5%的YHY可提高日本沼虾肝胰腺NO含量和NOS活性, 增强虾的非特异性免疫性能[15]。此外, YHY的饲料添加可以提高齐口裂腹鱼的血清LZM、SOD和ACP活性[38]及大口黑鲈肝脏的ALP、ACP和SOD活性[56]; 饲料中添加1.0%—2.0%的YHY可显著增强吉富罗非鱼(Oreochromis niloticus)的抗无乳链球菌感染能力[57]。因此, 饲料中添加YHY可改善克氏原螯虾的非特异性免疫功能, 这可能与YHY中所含酵母细胞壁、核苷酸、小肽和β-葡聚糖等的抗菌及免疫增强作用有关。
4 结论
在本实验条件下, 饲料中添加酵母水解物可提高或改善克氏原螯虾的生长性能、肌肉粗蛋白和粗脂肪含量、消化酶活性及抗氧化与非特异性免疫能力, 且2.00%的添加量对该虾的上述促进效果最佳。
