铜死亡相关lncRNA 预测三阴性乳腺癌患者预后及与肿瘤免疫微环境的关系
2024-01-11许春景郭旭陈杰马波周娟娣
许春景 郭旭 陈杰 马波 周娟娣
乳腺癌是女性最常见恶性肿瘤,其发病率及死亡率在全球范围内居高不下[1]。随着技术进步及新药研发,乳腺癌筛查技术和治疗策略不断更新;但由于乳腺癌的高度异质性,不同亚型对治疗反应存在明显差异[2-3]。三阴性乳腺癌(triple-negative breast cancer,TNBC)存在较高恶性生物学特征,在治疗过程中化疗耐药和免疫逃逸较常见,预后相对较差[4-5]。因此,迫切需要鉴定新型治疗靶点或预后指标来指导TNBC 治疗。铜死亡是由过量铜离子引起的细胞死亡形式,与已知的细胞焦亡、坏死性凋亡和铁死亡等明显不同[6-7]。从机制上看,积聚的铜离子可以靶向三羧酸循环中的硫辛酰化蛋白,后者过度聚集并导致铁硫簇蛋白的降解,引发毒性反应促使细胞死亡[8-9]。铜死亡相关基因如硫辛酸合酶基因(lipoic acid synthase,LIAS)、二氢硫辛酰胺S-乙酰转移酶(dihydrolipoamide Sacetyltransferase,DLAT)、丙酮酸脱氢酶E1 亚基α1(pyruvate dehydrogenase E1 component subunit alpha 1,PDHA1)和丙酮酸脱氢酶E1 亚基β(pyruvate dehydrogenase E1 component subunit beta,PDHB)等,已被报道在乳腺癌的发生、发展中起重要作用[10-11]。此外,Shanbhag 等[12]发现具有高水平硫辛酰化蛋白的乳腺癌细胞对铜离子积聚更敏感;Zhou 等[13]证明铜螯合剂能够抑制乳腺癌细胞生长和转移。这些研究都提示铜死亡可能在乳腺癌中发挥重要调控作用。长链非编码RNA(long non-coding RNA,lncRNA)虽然不具备编码功能,但可通过染色质功能调节、转录干扰等多方面影响肿瘤发生、发展和转移,有望成为乳腺癌新型靶点及标志物[14-15]。事实上,lncRNA 与铜离子集聚密切相关,如Scheurer 等[16]发现短期暴露于含铜焊接烟尘可导致巨噬细胞中多种lncRNA 水平升高。此外,铜死亡相关lncRNA 已被报道可预测结直肠癌、肝癌、骨肉瘤和肾细胞癌等多种肿瘤的预后[17-21]。本研究利用肿瘤基因组图谱(the cancer genome atlas,TCGA)数据库获取TNBC 患者的临床资料和转录组测序数据,建立铜死亡相关lncRNA 预后模型并评估其预测能力;通过比较不同风险分组患者转录组的分子差异,揭示铜死亡相关lncRNA 与TNBC 患者预后及肿瘤免疫浸润的关系。
1 对象和方法
1.1 临床资料 登录TCGA 数据库(https://www.cancer.gov/ccg/research/genome-sequencing/tcga)获取TNBC 患者的转录组测序数据和临床资料。纳入标准:(1)经病理检查确诊为TNBC;(2)具有完整随访信息。排除标准:(1)临床病理资料缺失;(2)生存时间<30 d,死于TNBC 以外原因。下载对应的转录组测序信息及肿瘤分期信息,对数据进行合并、探针注释和信息提取,共得到93例TNBC患者转录组表达矩阵和肿瘤分期信息。
1.2 铜死亡相关基因及lncRNA 筛选 根据Science期刊上刊登的铜死亡代表性论文《Copper induces cell death by targeting lipoylated TCA cycle proteins》,共获得16 个铜死亡相关基因[LIAS、DLAT、PDHA1、PDHB、铁氧化还原蛋白1(ferredoxin 1,FDX1)、脂酰转移酶1(lipoyltransferase 1,LIPT1)、二氢硫辛酸脱氢酶(dihydrolipoyl dehydrogenase,DLD)、金属调节转录因子1(metal-regulatory transcription factor-1,MTF1)、谷氨酰胺酶(glutaminase,GLS)、细胞周期蛋白依赖性激酶抑制剂2A(cyclin-dependent kinase inhibitor 2A,CDKN2A)、铜转运ATP 酶β(ATPase copper transporting beta,ATP7B)、溶质载体家族31 成员1(solute carrier family 31 member 1,SLC31A1)、铜转运ATP 酶α(ATPase copper transporting alpha,ATP7A)、二氢硫辛酸琥珀酰转移酶(dihydrolipoamide S-succinyltransferase,DLST)、二氢硫辛酰胺支链转酰酶E2(dihydrolipoamide branched chain transacylase E2,DBT)和甘氨酸裂解系统蛋白H(glycine cleavage system protein H,GCSH)][8]。从转录组测序数据中分离出含有铜死亡相关基因和lncRNA 的表达矩阵,为了分析铜死亡相关基因与lncRNA 的共表达情况,采用Pearson 相关计算铜死亡相关基因与lncRNA 间的相关性,以|r|>0.3 和P<0.05 作为筛选铜死亡相关lncRNA 的标准。
1.3 Cox 回归分析与预后模型构建 根据1.2 确定的铜死亡相关lncRNA,使用“survival”包对TNBC 患者生存时间、铜死亡相关lncRNA 进行单因素Cox 回归分析,以P<0.05 为标准筛选TNBC 预后相关铜死亡lncRNA。HR<1 代表该lncRNA 为保护因素,反之为危险因素。采用Cox 比例风险回归模型得到铜死亡相关lncRNA 的回归系数,依据铜死亡相关lncRNA 表达水平和回归系数计算个体风险评分,以风险评分中位数为截点划分高风险组和低风险组。使用“survminer”包和Kaplan-Meier 生存分析构建生存曲线以比较不同分组之间的生存差异。使用“timeROC”包计算模型预测1、3、5 年生存期的AUC,评估模型的预测效能。绘制预后模型与肿瘤分期的ROC 曲线并比较AUC,评估预后模型的预测效能。
1.4 功能富集分析与肿瘤免疫浸润分析 从转录组测序数据中分离出高风险组和低风险组的基因表达矩阵,从分子特征数据库(molecular signatures database,MSigDB)中获取经专家校验的基因集合(https://www.gsea-msigdb.org/gsea/msigdb/human/genesets.jsp?collection=CP:KEGG_LEGACY),应用“基因集变异分析(gene set variation analysis,GSVA)”包将不同风险组的基因表达矩阵转化为基因集表达矩阵,以评估相关通路在不同风险组中的富集情况。采用“CIBERSORT”和“xCell”包通过反卷积算法量化TNBC 患者肿瘤组织免疫细胞浸润比例,评估免疫微环境状态。
1.5 统计学处理 采用R 4.2.2统计软件。采用单因素和多因素Cox 比例风险回归模型建立预后模型。采用Kaplan-Meier 法绘制生存曲线,使用log-rank 检验比较TNBC 不同风险组患者生存情况。通过ROC 曲线评估预后模型的预测效能。P<0.05为差异有统计学意义。
2 结果
2.1 铜死亡相关lncRNA 筛选与预后模型构建Pearson 相关显示,93 例TNBC 患者转录组表达矩阵中共111 个lncRNA 被鉴定为铜死亡相关lncRNA。单因素Cox 回归分析显示与TNBC 患者预后相关的铜死亡lncRNA 共5 个,分别为MELTF-AS1(HR=0.410,95%CI:0.210~0.800)、APTR(HR=0.223,95%CI:0.060~0.780)、DHRS4-AS1(HR=0.468,95%CI:0.230~0.940)、LINC02188(HR=0.628,95%CI:0.420~0.930)和URB1-AS1(HR=0.407,95%CI:0.170~0.980)(均P<0.05)。
2.2 铜死亡相关lncRNA 预后模型的预测效能 根据Cox 比例风险回归模型得到铜死亡相关lncRNA 的回归系数,计算风险评分=[(-0.480 9)×Exp(MELTFAS1)+(-0.708 9)×Exp(APTR)+(-0.626 6)×Exp(DHRS4-AS1)+(-0.424 5)×Exp(LINC02188)+(-0.547 9)×Exp(URB1-AS1)]。根据风险评分中位数将纳入患者划分为不同风险组。生存曲线显示,低风险组的生存时间长于高风险组(P<0.05),见图1A。模型预测TNBC 患者1、3、5 年总生存率的AUC 分别为0.891、0.860 和0.825,见图1B。预后模型、肿瘤分期预测TNBC 患者总生存率的AUC 分别为0.823 和0.739,可见预后模型的预测效能高于肿瘤分期,见图1C。

图1 预后模型的效能评估(A:高风险组和低风险组TNBC 患者的Kaplan-Meier 生存曲线;B:基于TNBC 患者预后模型的ROC 曲线;C:预后模型和肿瘤分期对TNBC 患者预测预后的ROC 曲线)
2.3 功能富集分析 GSVA 分析发现,高风险组肿瘤组织中炎症及肿瘤相关通路相对富集,包括类风湿性关节炎相关通路、结直肠癌相关通路、胰腺癌相关通路、金黄色葡萄球菌感染相关通路、病毒性心肌炎相关通路等。低风险组叶酸介导的一碳代谢等通路相对富集,见图2。
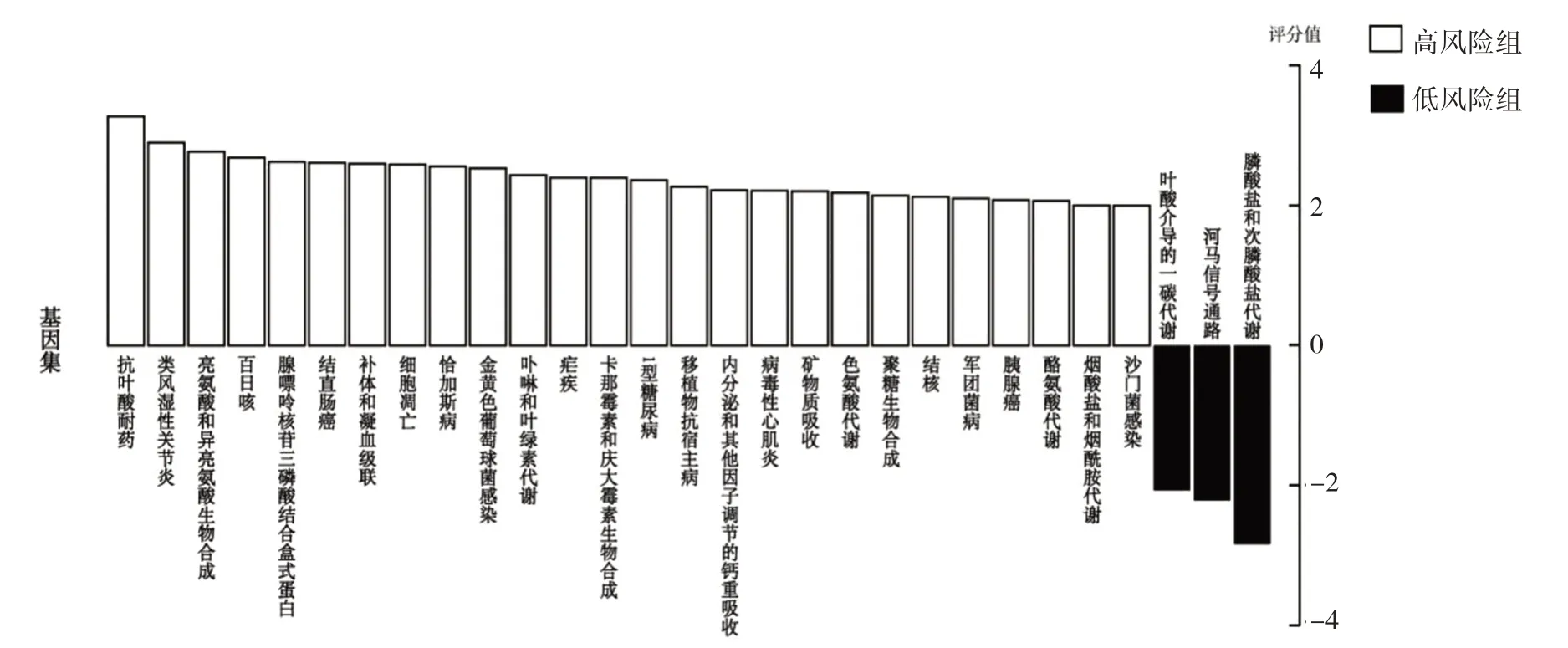
图2 不同风险分组的基因集变异分析
2.4 免疫浸润分析 基于“CIBERSORT”包的分析表明,低风险组浸润M1 型巨噬细胞(P<0.05)及活化的髓源性树突状细胞(P<0.01)显著增加,见图3A。基于“xCell”包的分析表明,高风险组浸润M2 型巨噬细胞显著增加(P<0.05),见图3B。

图3 不同风险分组的肿瘤免疫浸润分析(A:基于“CIBERSORT”包的不同风险分组免疫细胞亚群浸润情况;B:基于“xCell”包的不同风险分组免疫细胞亚群浸润情况)
3 讨论
在过去的几十年里,乳腺癌的发病率和死亡率仍未有明显下降。尽管治疗手段不断更新(如化疗、手术、免疫治疗等),晚期TNBC 患者的预后仍有待提高。因此,发掘新型生物标志物对TNBC 患者的预后判断非常重要。在多种类型的肿瘤中,铜死亡相关lncRNA显示出潜在的诊断和预后价值。如Zhang 等[22]构建了包含12 个铜死亡相关lncRNA 的子宫内膜癌预后模型,其预测预后和免疫治疗反应的高可靠性和准确性为探索子宫内膜癌发生机制和改善临床预后提供了新的视角。Liu 等[20]建立了包含7 个铜死亡相关lncRNA 的结直肠腺癌中风险预测模型,该模型预测低危组患者生存时间更长。Zhang 等[23]在肝癌中构建了一种新型预后模型,该模型包含5 个铜死亡相关lncRNA,可以预测免疫细胞浸润丰度,还能判断不同化疗药物的治疗敏感性。此外,在膀胱癌、肺癌等多种肿瘤中,基于铜死亡相关lncRNA 所构建的新型预后模型均被报道具有重要的预测价值[24-26]。
本研究首先探讨铜死亡相关lncRNA 与TNBC 预后之间的关联,结果显示MELTF-AS1、APTR、DHRS4-AS1、LINC02188 和URB1-AS1 等5 个铜死亡相关lncRNA 与TNBC 预后相关。构建包含该5 个铜死亡相关lncRNA 的TNBC 预后模型可有效区分高、低风险分组,且低风险组患者生存时间明显长于高风险组(P<0.05)。在临床价值方面,预后模型不仅比传统肿瘤分期更具价值,其预测TNBC 患者1、3、5 年生存率的准确性也较高。此外,本研究还评估了不同风险分组患者肿瘤免疫微环境的差异,基于“CIBERSORT”和“xCell”包的分析表明,高风险组患者肿瘤组织中有更多的免疫抑制性细胞浸润,这可能是导致预后不良的因素之一。
综上所述,本研究基于铜死亡相关lncRNA 所构建的预后模型不仅能为TNBC 患者提供更有效的个体化预测,更能评估不同风险分组的肿瘤免疫微环境差异。值得注意的是,本研究的预测模型是基于国外公共数据集建立的,且缺乏验证集评估模型效能,未来需进行大样本人群研究,以评估是否适用于中国TNBC 患者。
